中药饮片是指药材经过炮制后可直接用于中医临床或制剂生产使用的处方药品[1],中药材、中药饮片、中成药为中药行业的三大支柱。中药饮片质量直接关系着临床用药的安全性、有效性。同时,中药饮片作为中成药的生产原料,在中药产业中具有重要作用,其质量状况关系着行业安全生产[2]。
中药饮片主要来源于天然植物、动物、矿物等,其原料本身携带大量的微生物。在饮片的生产、运输及使用环节缺乏对微生物污染的认识,这些都对饮片的质量状况造成潜在的威胁[3]。煎煮、熬制等的服用方式能消除饮片中部分微生物对人体健康的直接威胁,但微生物的生长代谢对中药饮片有效成分、药效等带来不可逆的转变。李国红等研究表明微生物发酵中药的过程中,两者发生相互作用,导致发酵前后中药成分发生变化,从而抗菌活性发生变化[4]。目前,欧洲药典、美国药典、日本药典都对饮片的微生物检验方法和限度标准做出要求,反映了国际社会对中药饮片质量的关注[5-7]。文献数据表明,我国中药饮片生产企业在加工过程中对卫生状况的关注还需加强,饮片微生物污染现状较为严重[8-10]。近两年,业内对饮片的微生物质量状况日渐关注,部分研究表明饮片的微生物限度标准亟待完善[11-12]。2018年2月国家药典委员会发布了中药饮片微生物限度检查法(增修订草案),增加了对饮片微生物限度检查方法和标准相关内容,拟通过广泛征集意见和试验数据的方式,进一步完善检验方法、合理制定微生物限度标准。本次试验选取了不同厂家、批次的蒲黄、柴胡、青箱子各10批,考察微生物污染情况,并初步探讨煎煮服用类饮片微生物限度标准。
1 试验材料 1.1 中药饮片蒲黄共计10批,来源于安徽、山东、河北和江西的10个不同厂家;柴胡共计10批,来源于安徽、山东、河北和湖北的9个不同厂家;青箱子共计10批,来源于安徽、山东、河北和北京的9个不同厂家。
所有的中药饮片均购于青岛市,由青岛食品药品检验研究院中药检验部按照《中国药典》2015年版鉴定。
1.2 培养基pH7.0无菌氯化钠-蛋白胨缓冲液(批号:20160526),购自青岛蓝燕绿检生物技术有限公司。
含氯霉素沙氏葡萄糖琼脂培养基(批号:20161102),购自青岛海博生物技术有限公司。
胰酪大豆胨液体培养基(批号:3102475)、胰酪大豆胨琼脂培养基(批号:3103005)、肠道增菌液体培养基(批号:3104849)、紫红胆盐琼脂培养基(批号:3104750)、麦康凯液体培养基(批号:3104618)、麦康凯琼脂培养基(批号:3303011)、RV沙门增菌液体培养基(批号:3104847)、木糖赖氨酸脱氧胆酸盐琼脂培养基(批号:3104652),均购自广东环凯微生物科技有限公司。
1.3 仪器PCR仪(CFX96 Real Time System)、全自动微生物生化分析仪(VITEK 2 Compact,生物梅里埃公司)、显微镜(SCOPE A1,卡尔蔡司股份公司)等。
2 方法按照《中国药典》中药饮片微生物限度标准(修订草案)进行本次试验。
2.1 供试液制备取供试品25 g,加入pH 7.0无菌氯化钠-蛋白胨缓冲液225 mL,振摇1 min,制成1:10供试液。
2.2 需氧菌计数取“2.1”节1:10供试液,用pH 7.0无菌氯化钠-蛋白胨缓冲液稀释,采用平皿法计数,1 mL/皿,倾注胰酪大豆胨琼脂培养基,32.5 ℃培养5 d。
2.3 霉菌和酵母菌计数取“2.1”节1:10供试液,用pH 7.0无菌氯化钠-蛋白胨缓冲液稀释,采用平皿法计数,1 mL/皿,倾注含氯霉素沙氏葡萄糖琼脂培养基,22.5 ℃培养7 d。
2.4 耐热菌计数取1:10供试液,100 ℃水浴加热30 min,迅速冷却,用pH 7.0无菌氯化钠-蛋白胨缓冲液稀释,采用平皿法计数,1 mL/皿,倾注胰酪大豆胨琼脂培养基,32.5 ℃培养5 d。
2.5 耐胆盐革兰阴性菌和耐热耐胆盐革兰阴性菌定量检测取供试品25 g,加入胰酪大豆胨液体培养基225 mL,振摇1 min,制成1:10供试液。将供试液分为2份,其中1份100 ℃水浴加热30 min,迅速冷却,另1份不加热。将2份供试液室温放置2 h,以胰酪大豆胨液体培养基稀释,每个稀释度取1 mL接种至10 mL肠道增菌液体培养基中,32.5 ℃培养24 h,将上述培养物划线接种至紫红胆盐琼脂培养基平板上,32.5 ℃培养24 h。
2.6 大肠埃希菌和耐热大肠埃希菌检测取“2.1”节1:10供试液10 mL,接种至胰酪大豆胨液体培养基100 mL,32.5℃培养24 h。取上述培养物1 mL接种至100 mL麦康凯液体培养基中,43 ℃培养24 h,将麦康凯液体培养物划线接种至麦康凯琼脂培养基平板上,32.5 ℃培养48 h,检测大肠埃希菌。另取“2.4”节100 ℃加热后的1:10供试液,同上操作,检测耐热大肠埃希菌。
2.7 沙门菌检测取供试品10 g,接种至胰酪大豆胨液体培养基100 mL,32.5 ℃培养24 h。取上述培养物0.1 mL接种至10 mL RV沙门增菌液体培养基中,32.5 ℃培养24 h,将RV沙门增菌液体培养物划线接种至木糖赖氨酸脱氧胆酸盐琼脂培养基平板上,32.5 ℃培养48 h。
2.8 耐热菌和耐胆盐革兰阴性菌鉴定从蒲黄、柴胡和青箱子中各选择3批饮片,分别从“2.4”节耐热菌胰酪大豆胨琼脂平板和“2.5”节紫红胆盐平板选取不同形态的微生物,以27f和1492r为上下游引物,进行16S rDNA片段扩增,将扩增片段进行测序(上海生工测序),测序结果在NCBI数据库比对,确定微生物种属。
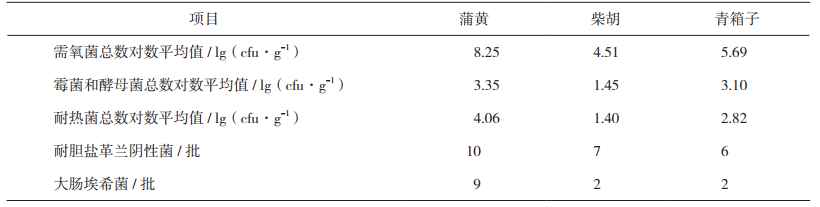
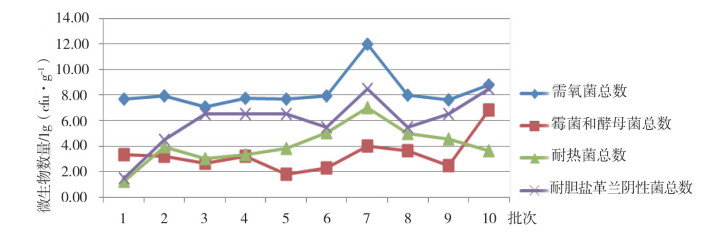
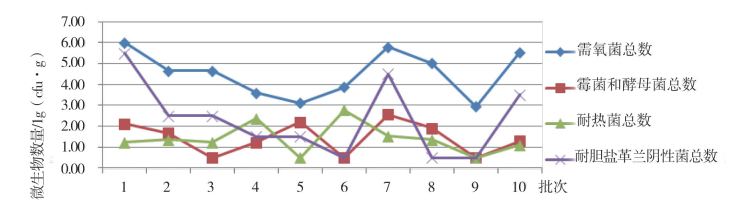
3 结果 3.1 需氧菌总数、霉菌和酵母菌总数检测结果本次试验所选取的30个批次中药饮片均检出需氧菌,26批次检出霉菌和酵母菌,详细结果见表 1和图 1~3。3种中药饮片中,蒲黄的需氧菌、霉菌和酵母菌污染程度最高,柴胡污染程度最低,其中蒲黄中需氧菌总数大部分结果介于(107~109) cfu·g-1,最高值达1012 cfu·g-1。不同批次中药饮片微生物污染情况各不相同,其中青箱子各批次间霉菌和酵母菌数差别尤为明显,这种差别最高达5个数量级。
|
|
表 1 3种饮片微生物检测结果 |
|
图 1 10批蒲黄微生物污染情况 |
|
图 2 10批柴胡微生物污染情况 |

|
图 3 10批青箱子微生物污染情况 |
本次试验中,中药饮片经100 ℃煮沸处理30 min后,微生物数量明显下降,平均下降3~4个数量级,其中柴胡需氧菌数量下降至103 cfu·g-1以下。30种中药饮片中,23批检出耐胆盐革兰阴性菌,占77.0%,所有饮片均未检出耐热耐胆盐革兰阴性菌。不同批次和来源的同种饮片耐热菌和耐胆盐革兰阴性菌差别很大。耐热菌、耐胆盐革兰阴性菌数量和需氧菌总数存在一定的正相关系,需氧菌总数较高的样品,一般耐热菌和耐胆盐革兰阴性菌数量也较高。
3.3 大肠埃希菌、耐热大肠埃希菌和沙门菌检测结果经检验,13批饮片中检出大肠埃希菌,其中蒲黄占9批,柴胡和青箱子各2批。所有中药饮片均未检出耐热大肠埃希菌和沙门菌。
3.4 耐热菌和耐胆盐革兰阴性菌鉴定结果9批饮片的耐热菌和耐胆盐革兰阴性菌16S rDNA鉴定结果见表 2,分离得到的耐热菌均属于芽孢杆菌属,这些细菌为环境中常见细菌,可能是饮片在种植和生产加工环节引入,同时,芽孢杆菌属细菌在生产环节也较难被杀灭。分离的耐胆盐革兰阴性菌分别属于变形菌门、γ-变形菌纲、肠杆菌目和假单胞菌目,这类细菌多为条件致病菌,存在一定的用药风险,尤其对于一些冲泡或直接服用的饮片,应对耐胆盐革兰阴性菌严格控制。
|
|
表 2 耐热菌和耐胆盐革兰阴性菌鉴定结果 |
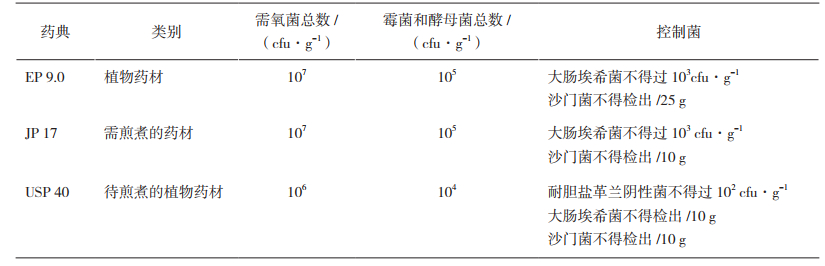
蒲黄、柴胡和青箱子均属于未经炮制处理的药材,需要煎煮服用。《中国药典》2015年版通则仅对中药提取物、直接口服和泡服的饮片规定了控制菌质量标准,对其他类型饮片微生物污染状况未作要求。近日公布的中药饮片微生物限度标准(修订草案)增加了对煎煮类饮片耐热菌和控制菌的要求。按照修订草案中的规定,5批次饮片耐热菌数量超出了限度要求,不合格率为16.7%。EP、USP和JP对中药饮片按照不同类别均设定了不同的控制标准,对煎煮类饮片限度要求详见表 3[5-7]。按照EP、USP和JP对需氧菌总数、霉菌和酵母菌总数的要求,30批饮片不合格率分别为36.7%、36.7%、43.3%。大量的研究数据表明中药饮片中污染的需氧菌和耐胆盐革兰阴性菌数量较大,尽管这类微生物通过煎煮大部分能够被杀灭,但是微生物污染对药效的影响以及耐胆盐革兰阴性菌所产生的毒素对于人体健康的威胁不容忽视[13-14]。此次发布的中药饮片微生物限度标准(修订草案)与国际药典接轨,笔者认为这是充分考虑了我国饮片行业的发展现状,通过逐步提高质量标准的方式来规范行业生产质量管理。饮片生产企业应该抓住这次发展契机,加强生产过程控制,优化产品生产工艺,逐步提高产品质量,引导行业健康发展。
|
|
表 3 EP、USP、JP中部分生药微生物限度标准 |
大部分的中药饮片在服用前需要煎煮处理,本次试验以100 ℃煮沸处理30 min模拟日常煎煮过程。经加热处理后,饮片中微生物数量均有明显下降,耐胆盐革兰阴性菌和大肠埃希菌数量降至检测限以下。但是仍有一些芽孢杆菌等耐热菌,在煎煮过程中难以被完全去除,部分批次的蒲黄中耐热菌数量甚至达到(105~107)cfu·g-1。本次试验选取的几株耐热菌经鉴定均为芽孢杆菌属,且经煎煮的饮片中耐胆盐革兰阴性菌未检出,提示煎煮后服用的饮片不存在高致病风险。但是,有研究表明冷藏保存状态下,耐热菌仍能生长增殖,会一定程度影响中药饮片的药效,煎煮好的饮片放置于冰箱保存分次服用的方式存在一定的安全隐患[15-16]。
4.3 不同来源饮片微生物污染情况试验结果表明,蒲黄中微生物污染情况比柴胡和青箱子更为严重。蒲黄是由花粉直接揉碎过筛制成,花粉营养物质丰富,颗粒细小,在重量相同的情况下,表面积更大,因此,染菌的概率较大。取自同一生产厂家,不同取样地、不同批次的饮片微生物污染情况也存在很大差异。中药饮片种类繁多,涉及的生产、流通、经营等各个环节没有形成统一标准化流程,每个环节都可能引入外源污染,给用药的安全性和有效性带来隐患。
本次试验通过对3种中药饮片30批微生物污染情况的考察,发现饮片微生物负载水平较高,卫生状况欠佳。目前,我国中药饮片的质量标准(包括微生物限度标准)和欧美等国药典存在一定差距,成为制约我国中药进入国际市场的障碍。我国中药生产加工等各环节整体控制水平有待提高,行业状况的改进需要循序渐进,过严的质量标准可能会制约行业发展。因此,要振兴我国中药事业,需要结合国情,整体把握现有的饮片质量状况,制定出合理的质量标准,加强中药生产流通各相关环节质量控制,促进工艺优化,全面提升中药产业发展水平。
| [1] |
中国药典: 一部[S]. 2015: Ⅶ.
|
| [2] |
曹明成, 黄泰康. 我国中药饮片质量的影响因素分析和对策[J]. 中国药业, 2016, 25(6): 7-9. |
| [3] |
魏引平, 徐虹. 从药材种植、饮片加工、质量标准三个重点环节谈中药质量管理[J]. 中国药事, 2015, 29(1): 36-39. |
| [4] |
李国红, 张克勤, 沈月毛. 枯草芽孢杆菌对50种中药的发酵及抗菌活性检测[J]. 中药材, 2006, 29(2): 154-157. DOI:10.3321/j.issn:1001-4454.2006.02.023 |
| [5] |
USP 40[S]. 2017: 2259.
|
| [6] |
EP 9. 0[S]. 2017: 591.
|
| [7] |
JP 17[S]. 2016: 2488.
|
| [8] |
范一灵, 李琼琼, 房蕊, 等. 上海地区10种中药饮片微生物污染情况研究[J]. 中草药, 2015, 46(13): 154-157. |
| [9] |
刘广桢, 林永强, 林林, 等. 部分地区瓜蒌饮片的微生物污染状况分析[J]. 中国药学杂志, 2016, 51(22): 1962-1966. |
| [10] |
甘永琦, 王涛, 苏顶, 等. 通草饮片的微生物污染状况考察[J]. 华西药学杂志, 2018(1): 52-56. |
| [11] |
李闽真, 马群飞, 傅武胜. 市售中药材霉菌污染情况和优势种群分布的研究[J]. 中国卫生检验杂志, 2013, 23(17): 3351-3353. |
| [12] |
邵力成, 潘建文, 谢文明, 等. 中药饮片菊花、浙贝母的微生物污染状况及其微生物限度标准的研究[J]. 中南药学, 2015, 13(10): 1093-1095. DOI:10.7539/j.issn.1672-2981.2015.10.021 |
| [13] |
刘洪祥, 曹晓云. 中药饮片中需氧菌、霉菌和酵母菌污染情况的研究及分析[J]. 天津药学, 2017, 29(1): 9-14. DOI:10.3969/j.issn.1006-5687.2017.01.003 |
| [14] |
周爽, 钱文静. 中药饮片污染耐胆盐革兰阴性菌的考察[J]. 中国药品标准, 2014, 15(6): 423-425. |
| [15] |
李珏, 郑小玲, 梁发勇, 等. 中药饮片麦冬和芫花中耐热菌的考察[J]. 中国现代应用药学, 2016, 33(5): 642-644. |
| [16] |
杨晓莉, 李辉, 绳金房. 12种中药饮片耐热菌污染状况调查及风险评估[J]. 陕西中医, 2016, 37(6): 740-743. DOI:10.3969/j.issn.1000-7369.2016.06.045 |
 2018, Vol. 32
2018, Vol. 32