榜嘎是藏族习用药材,为毛茛科植物乌头属植物榜嘎[船盔乌头Aconitum naviculare(Bruhl.)Stapf和甘青乌头Aconitum tanguticum(Maxim.)Stapf]的干燥全草[1-2],主产于西藏、青海和甘肃等藏区海拔4000~5100米的高山上,具有清热解毒、燥湿生肌、收口等功效,临床常用于流行感冒导致的发热、肺胃热病及肝胆热症、血症、疮疡、蛇蝎咬伤和黄水病[3]。目前收载的藏药成方制剂中,有41个处方含有榜嘎,约占藏药成方制剂20%,如十三味榜嘎散、十三味红花丸等。由于自然资源匮乏[4],榜嘎现都用地上部分入药,其主要含黄酮类和生物碱类成分。有文献报道,榜嘎不含乌头碱类成分,这与传统藏医用药经验关于榜嘎毒性极小一致[5-8]。本研究主要是用高效液相色谱法同时对榜嘎中2种新黄酮类结构化合物榜嘎苷A(见图 1)和榜嘎苷C(见图 2)进行含量测定,此前未有文献报道过榜嘎苷A和榜嘎苷C。本课题是在研究榜嘎特征图谱的基础上,对榜嘎中主要黄酮类成分进行分离提取和结构鉴定[9-13],并制得6种对照品Clovin、刺槐苷、榜嘎苷A、榜嘎苷B、榜嘎苷C、榜嘎苷D,由于不同样品含量差异较大且成分复杂,因此,选择定位分离较好的榜嘎苷A和榜嘎苷C,建立了HPLC法测定藏药榜嘎中榜嘎苷A和榜嘎苷C的含量,同时对采集到的17批不同产地的榜嘎药材进行测定。该方法操作简便、准确可靠、重复性良好,可作为榜嘎质量研究的参考。
|
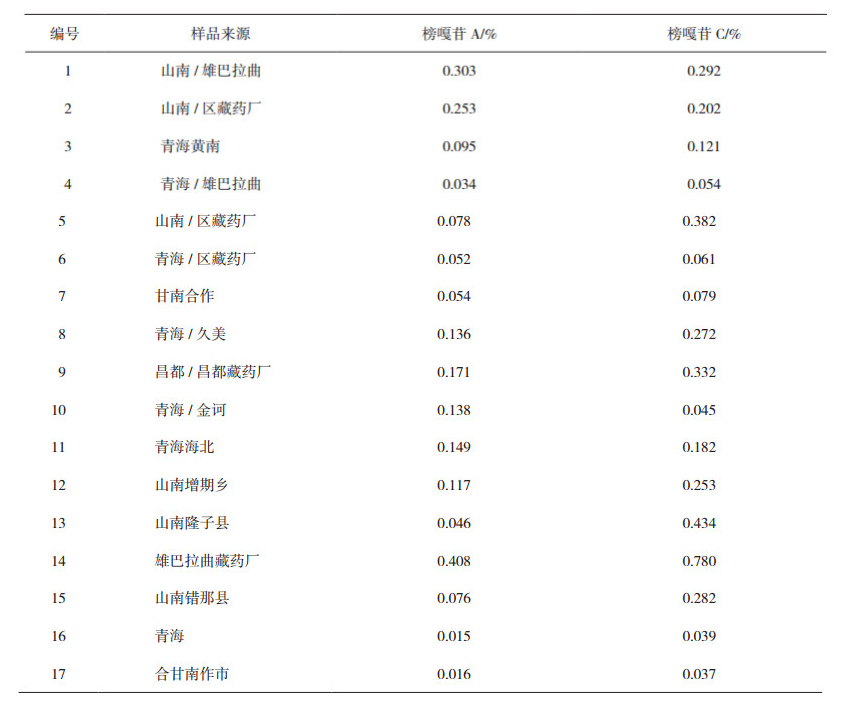
图 1 榜嘎苷A结构式 |
|
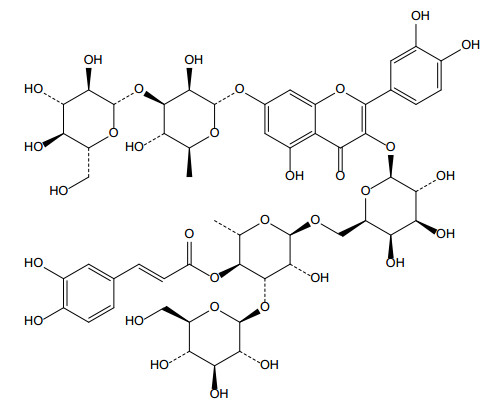
图 2 榜嘎苷C结构式 |
Waters 2695型高效液相色谱仪,PDA检测器,ELMA P120H型超声波清洗器(德国ELMA公司),Milli-Q纯水系统,Mettler XS 105 Du十万分之一天平,Mettler AE240万分之一天平。
试剂:提取用甲醇为分析纯,流动相体系中所用磷酸为色谱纯,甲醇、乙腈为色谱纯,水为超纯水。
榜嘎苷A(批号:PS010277,纯度:97.28%,采用液相面积归一法)和榜嘎苷C(批号:PS010279,纯度:99.09%,采用液相面积归一法)由成都普思生物科技股份有限公司分离提纯结构鉴定制备。药材主要是采购和野外采集,产地见表 1,经西藏自治区食品药品检验研究院次旦多吉鉴定为毛茛科植物乌头属植物榜嘎[船盔乌头Aconitum naviculare(Bruhl.)Stapf和甘青乌头Aconitum tanguticum(Maxim.)Stapf]的地上部分。
|
|
表 1 榜嘎样品来源 |
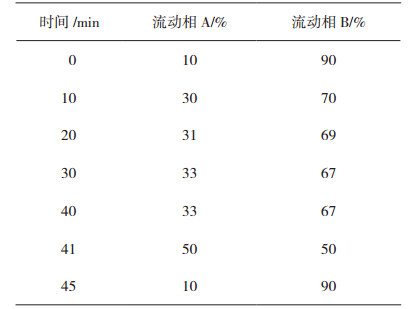
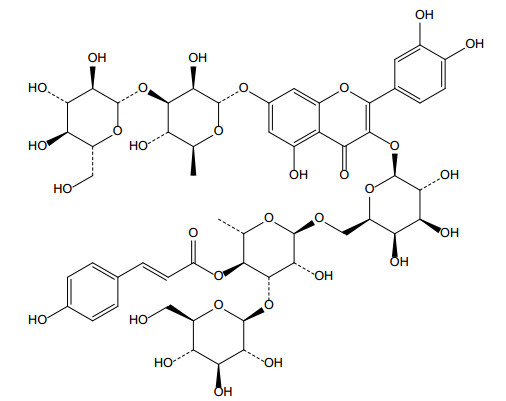
色谱柱:Agilent XDB-C18(4.6 mm×250 mm,5 μm);流动相A:甲醇-乙腈(9︰1)和流动相B:0.4%磷酸,梯度洗脱(见表 2);流速:1 mL·min-1;检测波长:325 nm;柱温:30 ℃;进样量:10 μL。色谱图见图 3。
|
|
表 2 梯度洗脱程序 |
|
图 3 榜嘎HPLC色谱图 a.榜嘎苷A对照品溶液;b.榜嘎苷C对照品溶液;c.供试品;1.榜嘎苷A;2.榜嘎苷C。 |
精密称取榜嘎苷A对照品21.80 mg和榜嘎苷C对照品21.37 mg,分别置10 mL量瓶中,用甲醇溶解并定容至刻度,即得各对照品储备液;分别取各对照品储备液适量,置10 mL量瓶中,加甲醇配制成含榜嘎苷A 101.79μg·mL-1和榜嘎苷C 101.64μg·mL-1的混合溶液,作为对照品溶液。
2.3 供试品溶液的制备精密称取榜嘎药材粉末(过三号药筛)1 g,置具塞锥形瓶,精密加入甲醇10 mL,称定重量,超声处理(功率:300 W,频率:40 kHz)30 min,取出,放置室温,称重,用甲醇补足减失的重量,摇匀,用0.45 µm的微孔滤膜过滤,取续滤液,作为供试品溶液。
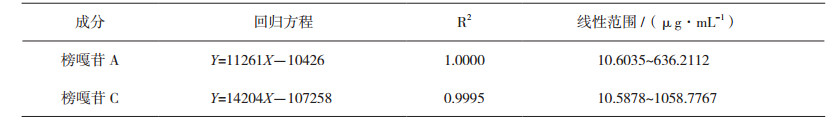
2.4 线性关系考察精密吸取榜嘎苷A对照品储备液0.05、0.1、1.0、3.0、5.0 mL,榜嘎苷C对照品储备液0.05、0.1、1.0、3.0、5.0 mL,分别置5个10 mL量瓶中,加甲醇定容至刻度,制成不同浓度的混合对照品溶液,按上述色谱条件测定,以对照品的进样量X(μg)为横坐标,以峰面积Y为纵坐标,进行线性回归,各被测成分回归方程和线性范围见表 3。结果表明,榜嘎苷A进样量在0.1060~6.3621 μg与峰面积呈良好的线性关系;榜嘎苷C进样量在0.1059~10.5878 μg与峰面积呈良好的线性关系。
|
|
表 3 各被测成分的回归方程、相关系数和线性范围 |
精密吸取“2.2”节混合对照品溶液10 μL,连续进样6次,记录峰面积。结果榜嘎苷A和榜嘎苷C峰面积的RSD(n=6)分别为0.42%和0.60%,表明仪器精密度良好。
2.6 重复性试验取样品粉末(9号样品)6份,分别按照“2.3”节方法制备供试品溶液,按“2.1”节色谱条件测定,记录峰面积,计算含量。结果供试品溶液中榜嘎苷A和榜嘎苷C的RSD分别为1.34%和1.53%,表明重复性良好。
2.7 稳定性试验取同一份供试品溶液(9号样品),分别于配制后0、2、4、8、12、24 h进样测定。结果榜嘎苷A峰面积的平均值为191.5346,RSD为1.01%,榜嘎苷C峰面积的平均值为417.8482,RSD为1.08%,表明供试品溶液在24 h内稳定。
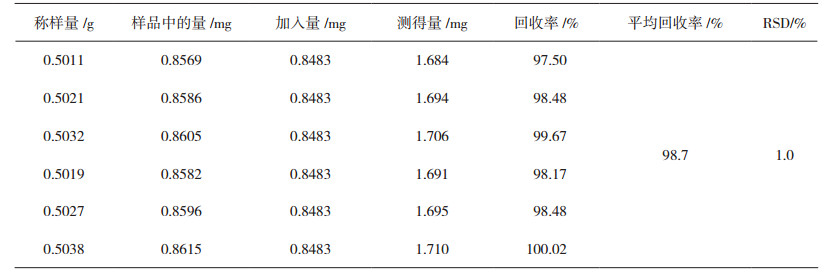
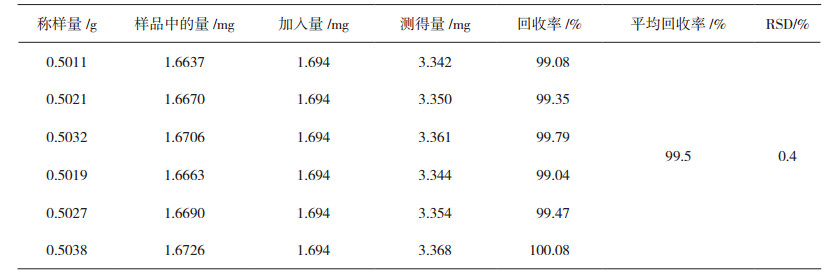
2.8 加样回收试验取已知含量的样品粉末(9号样品)6份,每份各约0.50 g,精密称定,置具塞锥形瓶中,分别精密加入浓度为0.8483 mg·mL-1的榜嘎苷A对照品溶液和浓度为1.694 mg·mL-1的榜嘎苷C对照品溶液各1.0 mL,加入提取溶液甲醇8 mL,按照“2.3”节方法平行制备供试品溶液,进样分析,计算回收率,结果见表 4、5,表明该方法加样回收试验结果良好。
|
|
表 4 榜嘎苷A加样回收率试验结果(n=6) |
|
|
表 5 榜嘎苷C加样回收率试验结果(n=6) |
每个样品取2份,分别按“2.3”节方法制备供试品溶液。精密吸取各供试品溶液10 μL,按“2.1”节色谱条件进行测定,用外标法计算17批榜嘎中2个有效成分的含量,结果见表 6。
|
|
表 6 榜嘎中2种成分含量测定结果 |
榜嘎苷A和榜嘎苷C在325 nm处均有较高吸收,故选择检测波长为325 nm。见图 4。
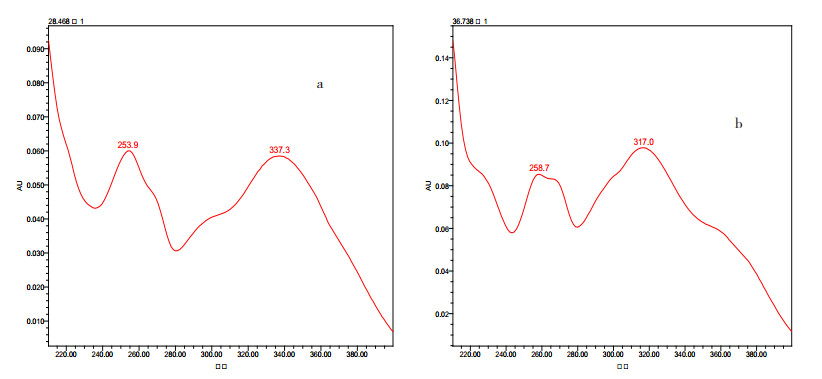
|
图 4 紫外吸收光谱图 a.榜嘎苷A紫外吸收光谱图;b.榜嘎苷C紫外吸收光谱图。 |
针对榜嘎苷A和榜嘎苷C属于黄酮类化合物的性质,分别考察了不同流动相系统甲醇-水、甲醇-磷酸水溶液、乙腈-水、乙腈-磷酸水溶液的分离效果,发现甲醇-磷酸水溶液的分离效果较好,进而优选确定甲醇-乙腈(9︰1)和0.4%磷酸作为流动相梯度洗脱,各色谱峰保留时间适中,分离较好。
3.3 供试品溶液制备方法的确定在试验过程中,分别考察了以100%、70%、50%甲醇作为溶剂的提取效果,结果显示:100%甲醇作为溶剂提取效果最佳。又以100%甲醇作为提取溶剂,比较了超声20、30、40 min的提取效率,结果显示:超声30 min提取较完全。故选择甲醇作为提取溶剂,超声30 min作为前处理条件。
3.4 结果分析榜嘎样品中不同成分的含量差异较大,但是17批样品中均含有榜嘎苷A和榜嘎苷C,为共有化合物。因此,本文选择分离度较好、特征性较强的这两种成分,建立了HPLC含量测定方法。17批样品中有1批样品榜嘎苷A含量高达0.408%,榜嘎苷C含量高达0.780%。
| [1] |
中国药典: 一部[S]. 2010: 附录285-286.
|
| [2] |
罗达尚. 新修晶珠本草[M]. 成都: 四川科学科技出版社, 2004: 245-247.
|
| [3] |
国家药典委员会. 中华人民共和国卫生部药品标准藏药: 第一册[S]. 1995: 85.
|
| [4] |
刘志明. 藏药榜嘎榜那的资源调查和药用合理性评价[D]. 北京: 北京中医药大学, 2013.
|
| [5] |
罗明. 藏药榜嘎化学成分和药理作用的研究进展[J]. 中国实验方剂学, 2012, 18(12): 299. |
| [6] |
赵翡翠, 李杰. 我国乌头属药用植物中生物碱分析方法的研究进展[J]. 中药材, 2010, 33(8): 1351. |
| [7] |
贾庆文, 闫滨. 乌头类药物的毒性研究及唐古特乌头的研究概述[J]. 食品与药品, 2012, 14(7): 300. |
| [8] |
康慧, 骆桂法, 杨凤梅, 等. 藏药榜嘎中的双酯型和内酯型生物碱分析方法研究[J]. 西北药学杂志, 2014, 29(5): 443-446. |
| [9] |
李艳茸, 李春, 王智明, 等. 藏药甘青乌头化学成分研究:Ⅲ[J]. 中国中药杂志, 2014, 39(7): 1163-1167. |
| [10] |
兰钧, 夏柯, 李启发, 等. 藏药榜嘎中黄酮类化学成分的研究[J]. 药物分析杂志, 2018, 38(6): 965-974. |
| [11] |
叶敏, 阎玉凝, 乔梁, 等. 中药菟丝子化学成分研究[J]. 中国中药杂志, 2002, 27(2): 115-117. |
| [12] |
Bharat B. S. Dall'Acqua S., Gewali MB., et al. New Flavonoid Glycosides from Aconitum Naviculare (Brühl)Stapf, a Medicinal Herb from the Trans-Himalayan Region of Nepal[J]. Carbohydrate Research, 2006, 341: 2161-2165. DOI:10.1016/j.carres.2006.05.013 |
| [13] |
Mariani C, Braca A, Vitalini S, et al. Flavonoid Characterization and in vitro Antioxidant Activity of Aconitum Anthora L. (Ranunculaceae)[J]. Phytochemistry, 2008, 69(5): 1220-1226. DOI:10.1016/j.phytochem.2007.12.009 |
 2018, Vol. 32
2018, Vol. 32