2. 中国食品药品检定研究院, 北京 100050
2. National Institutes of Food and Drug Control, Beijing 100050, China
巴日嘎-13散由凤眼草、芒果日-吉木斯(芒果核)、哈黑日各-乌热(海南蒲桃)、卓楞-乌热(大托叶云实)、查干-苏格木勒(豆蔻)、薄仁-芍沙(刀豆)、玛日那(茜草[1])、阿如拉(诃子)、额勒吉根(枇杷叶)、乌日格斯图-阿日查(刺柏叶)、巴嘎-阿拉坦其其格(波棱瓜子)[2]等13味药组成,具有清肾热、消肿的功能,用于肾损伤性热、血尿、睾丸肿痛等病证的治疗。大托叶云实暧胃、温肾;芒果核及海南蒲桃具有补肾、祛“巴干达”寒的功能;刀豆益肾、清肾热;茜草具有清血热、止泻、止血功能,用于血热、吐血、衄血、崩漏、子宫出血、侵入性肾及肺热、麻疹、肠刺痛和肠热腹泻。茜草在方中起到主要功效作用,茜草中含有的抗癌成分[3]:β-谷甾醇、二氢大叶茜草素、大叶茜草素、2-甲氧酰基-2, 3-环氧基-3-异戊烯基-1, 4-奈醌、大黄素甲醚、齐墩果酸等,其中大叶茜草素为茜草的主要有效成分,本研究参照文献[4-16]以大叶茜草素作为对照品,建立了巴日嘎-13散蒙成药中大叶茜草素的含量测定方法。通过方法学考察及阴性对照试验,表明该方法操作简单、重复性好、专属性强,方中其它组分对大叶茜草素的测定无干扰。
1 仪器与试药 1.1 仪器Dikma Dimonsil C18色谱柱(250 mm×4.6 mm,5μm)CBM-20A系统控制器,LC-20AT溶剂输送泵,SIL-20AC自动进样器,SPD-20AV紫外检测器、CTO-20A柱温箱,LCsolution色谱工作站。普析通用TU-1901型紫外-可见分光光度仪。HR-200型万分之一天平。Presia型十万分之一天平。
1.2 试剂与试药大叶茜草素对照品(C17H15O4)(中国食品药品检定研究院提供,批号:110884-200604,供含量测定用);甲醇为色谱纯;四氢呋喃为色谱纯;水为超纯水;其他试剂均为分析纯。巴日嘎-13散(锡盟蒙医研究所提供,批号:070123、080225、090427)。
2 方法和结果 2.1 色谱条件色谱柱:Dikma Dimonsil C18色谱柱(250mm×4.6 mm,5μm)。流动相:甲醇-四氢呋喃-水(527:90:3),流速: 1.0 mL·min-1,柱温:室温,检测波长:391 nm,进样量:20 μL。理论板数按大叶茜草素峰计算应不低于5000。分离度为2.58。
2.2 对照品溶液的制备取大叶茜草素对照品适量,精密称定,加甲醇制成浓度为20 μg·mL-1的溶液。
2.3 供试品溶液的制备取本品1.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,称定重量,浸泡过夜,超声处理(功率:250 W,频率:33 kHz)30 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,用微孔滤膜(0.45 μm)滤过,即得(注意避光操作[5])。
2.4 阴性供试品溶液的制备按巴日嘎-13散处方比例配制缺茜草的样品作为阴性供试品,取1.5 g,精密称定,按“2.3”节下供试品溶液的制备方法制成阴性供试品溶液。
2.5 专属性试验分别精密吸取对照品、供试品、阴性供试品溶液20µL进样,按上述色谱条件测定,结果阴性供试品的色谱图中,未出现与对照品(大叶茜草素)色谱峰保留时间相同的色谱峰,表明方中其他组分对大叶茜草素的测定无干扰,该方法专属性强。见图 1。
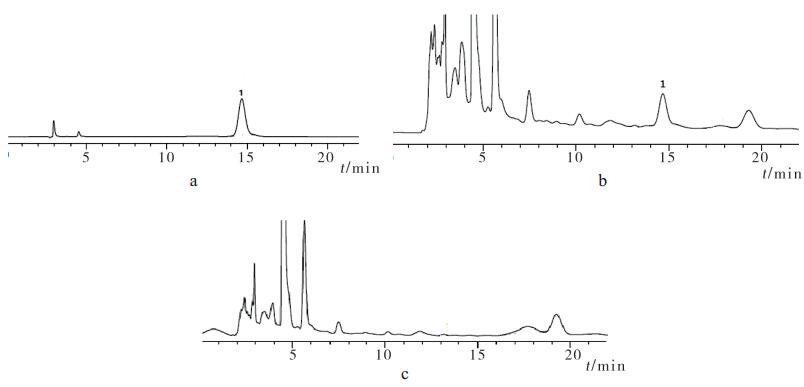
|
图 1 HPLC色谱图 a.对照品;b.供试品;c.阴性对照;1.大叶茜草素峰。 |
精密称取大叶茜草素对照品11.00mg,置100mL棕色量瓶中,加甲醇使溶解并稀释至刻度,摇匀,精密吸取0.5、1.0、1.5、2.0、3.0、4.0、5.0mL,分别置10 mL棕色量瓶中,加甲醇至刻度,摇匀,各取20µL进样,按上述色谱条件测定,峰面积为纵坐标,对照品的进样量为横坐标绘制标准曲线。回归方程:
Y=1.345781×106x+1.0021×104 r=0.9999
结果表明,大叶茜草素在5.5~55 μg·mL-1范围内呈良好的线性关系。
精密吸取同一大叶茜草素对照品溶液20μL,连续进样6次,测定峰面积积分值,计算峰面积平均值为594777,RSD为0.32%。
2.8 稳定性试验取同一供试品溶液,精密吸取20μL,分别于配置后0、2、4、8、12 h测定大叶茜草素峰面积,计算峰面积平均值为580460,RSD为0.27%。
2.9 重复性试验精密称取样品(批号:090427)6份,同法制成供试品溶液并测定。结果大叶茜草素平均含量为0.3753 mg·g-1,RSD为1.28%。
2.10 回收率试验精密称取已知含量的同一批号(批号:090427,含量:0.3753 mg·g-1)的样品0.77 g,分别精密加入大叶茜草素对照品溶液一定量,按供试品溶液的制备方法制备及上述色谱条件测定,计算回收率为102.24%,RSD为1.48%。结果见表 1。
|
|
表 1 回收率测定结果 |
取大叶茜草素对照品溶液与供试品溶液各20μL进样测定,采用外标法计算,测定结果见表 2。
|
|
表 2 样品测定结果 |
大叶茜草素易溶于三氯甲烷、苯、乙酸乙酯,能溶于乙醚、甲醇、丙酮,稍溶于乙醇,不溶于水[17]。由于三氯甲烷、苯、乙酸乙酯溶解的非极性的杂质较多,且三氯甲烷、苯的毒性较大,结合文献[1, 4-5]选择用甲醇浸泡过夜超声提取。
3.2 测定波长的选择实验中曾参照文献[1, 4]选用250 nm作为检测波长进行高效液相色谱法含量测定的条件探测,但因阴性干扰大,样品分离效果差,保留时间长,故未采用250 nm作为检测波长,而采用另一个最大吸收波长391 nm作为检测波长,结果阴性无干扰,样品分离效果好,保留时间适宜,故选择391nm作为检测波长。
3.3 浸泡时间的选择分别考察了浸泡60、90、120 min以及浸泡过夜,在不同浸泡时间对提取效率的影响,结果表明浸泡过夜再用同样超声条件可以提取完全。
3.4 定量成分的选择因芒果核、海南蒲桃、大托叶云实、诃子、波棱瓜子等多种药味均含有没食子酸,专属性差,故未选择没食子酸作为指标成分进行含量测定的研究;又因枇杷叶、刺柏叶等药味均含有槲皮素,专属性差,故未选择槲皮素作为指标成分进行含量测定的研究。
| [1] |
中国药典: 一部[S]. 2010: 218-219.
|
| [2] |
内蒙古自治区卫生厅编著. 内蒙古蒙药材标准[M]. 内蒙: 内蒙古科学技术出版社出版, 1986: 353, 356, 402, 432, 437, 444, 450, 469.
|
| [3] |
姜哲, 韩东哲. 茜草化学成分和抗癌活性研究[J]. 中国医院药学杂志, 2012, 32(14): 1126-1128. |
| [4] |
唐宇伟, 孙彬贤, 黄德杰. 参茜固经颗粒中大叶茜草素含量测定[J]. 中成药, 2005, 27(1): 28-31. |
| [5] |
刘广, 齐娜, 徐本明. 大叶茜草素在甲醇溶液中的稳定性研究[J]. 华西药学杂志, 2010, 25(3): 318-320. |
| [6] |
薛丽, 杨波, 索菲亚, 等. HPLC法测定茜草素、大叶茜草素、羟基茜草素的含量[C]//第九届全国中药和天然药物学术研讨会大会报告及论文集. 南昌, 2007: 342-348.
|
| [7] |
索菲娅, 王弘, 陈世忠. 不同采收期茜草中大叶茜草素含量的动态研究[J]. 中成药, 2006, 28(10): 1499-1501. DOI:10.3969/j.issn.1001-1528.2006.10.033 |
| [8] |
彭亮, 杨冰月, 王志华, 等. 陕西产茜草大叶茜草素的最佳提取工艺研究[J]. 现代中医药, 2010, 30(2): 63-64. |
| [9] |
乔亚芳, 王素贤, 吴立军, 等. 茜草中抗菌活性成分的研究[J]. 药学学报, 1990, 25(11): 834-839. |
| [10] |
张林, 彭亮, 胡本祥. 茜草的化学成分研究进展[J]. 现代中医药, 2008, 28(2): 52-54. |
| [11] |
方晓艳, 孙艳红, 杨林莎. 茜草的研究进展[J]. 河南中医药学刊, 2002, 17(5): 78-80. |
| [12] |
杨宇婷, 康文艺. HPLC法测定茜草及不同炮制品中大叶茜草素[J]. 中成药, 2011, 33(12): 2125-2127. DOI:10.3969/j.issn.1001-1528.2011.12.028 |
| [13] |
林文华, 朱喜梅, 严萍. 茜草中大叶茜草素、羟基茜草素含量测定方法优化的实验研究[J]. 中药新药与临床药理, 2014, 25(3): 345-348. |
| [14] |
杨连荣, 周庆华, 张哲锋. 茜草的生物学及化学成分与生物活性研究进展[J]. 中草药, 2013, 44(14): 2009-2014. |
| [15] |
王晓建, 黄胜阳. 茜草属植物化学成分及其药理作用研究进展[J]. 中国中医药信息杂志, 2012, 19(2): 109-112. |
| [16] |
郭桂明, 蔡乐, 粱晓雨, 等. HPLC法测定茜草饮片中大叶茜草素和羟基茜草素的含量[J]. 北京中医药, 2011, 37(10): 541-543. |
| [17] |
孙文基, 谢世昌. 天然药物成分定量分析[M]. 北京: 中国医药科技出版社, 2002: 391.
|
 2017, Vol. 31
2017, Vol. 31 