虾仁富含蛋白质、碳水化合物、脂肪及钙、磷、铁等微量元素,具有补肾壮阳、滋阴健胃、通畅血脉之功效,临床上用于治疗肾虚阳痿、筋骨疼痛、皮肤瘙痒、脾胃虚弱等症[1]。目前,在虾仁生产源头虾的养殖过程中,由于养殖户不规范不正确使用药物,四环素族抗生素如土霉素(OTC)、四环素(TC)、金霉素(CTC)可能被超限量应用于水产生物的养殖中,造成这类药物在水产品中的超量残留。人若长期食用,药物不断在体内蓄积,当浓度达到一定量后,就会对人体产生不良作用,主要表现为对胃、肠、肝脏的损害及牙齿的染色等,还会造成过敏反应、二重感染、致畸胎等作用[2]。对畜、禽肉类中土霉素、四环素、金霉素的测定,有国家标准方法GB·T5009 116-2003[3];对于非干制品水产品中土霉素、四环素、金霉素的测定,虽然也有报道[4-5],但这些方法用于水产干制品的处理效果都不太理想。基于以上情况,本文在这些研究内容的基础上,通过改变色谱条件和样品前处理方法,建立了一种同时测定土霉素、四环素、金霉素3种抗生素的高效液相色谱方法。该法不仅能有效去除样品中的干扰杂质从而保护色谱柱,而且使检测限大大降低,适用于测定水产干制品中土霉素、四环素、金霉素含量,也为制定虾仁的质控标准提供了参考依据。
1 仪器与试药 1.1 仪器2 0 1 0 A H T型高效液相色谱仪(日本岛津公司),TDL-50B离心机(北京亚泰科隆公司),LV型自动蒸发浓缩仪(美国,TurboV ap),AS3120B型超声波清洗器(天津,奥特赛恩斯仪器有限公司),MS2型迷你振荡器(德国IKA公司)。
1.2 试药标准物质:土霉素批号130487-200703、四环素批号130303-201419、金霉素批号130489-200202,购自中国食品药品检定研究院。5批样品分别为日本对虾(标示产地山东乳山)、凡纳滨对虾(标示产地山东乳山)、中国对虾(标示产地山东乳山)、北极虾(标示产地山东烟台)和脊尾白虾(标示产地山东乳山),均购自山西省太原市水产品市场,经山西省农业科学院植物保护研究所动物专家鉴定。
试剂:乙腈、甲醇(进口色谱纯)购自迪马公司。
自配:乙二胺四乙酸二钠(EDTA)-Mcllvaine缓冲液,配置方法:[取乙二胺四乙酸二钠37.2 g,加Mcllvaine缓冲溶液(pH 4)溶解至1000 mL。Mcllvaine缓冲溶液(pH 4)配置方法:称取磷酸氢二钠(Na2HPO4·12H2O)276 g、柠檬酸(C6H8O7·H2O)129 g,用水溶解后稀释并定容至1000 mL]。三氯乙酸-水(1:1)
色谱柱为Inertsil ODS-3液相色谱柱C18(填料十八烷基硅胶250 mm×4.6 mm,5μm; 日本岛津);液固萃取柱(Waters Oasis HLB 6cc/200 mg固相萃取柱WAT106202;美国waters公司);0.45 μm微孔滤膜(美国agela公司)13 mm。
2 方法与结果 2.1 色谱条件色谱柱:C18色谱柱(250 mm×4.6 mm,5μm);柱温:30 ℃; 流动相:甲醇-乙腈-10 mmol·L-1三氟乙酸,梯度洗脱程序见表 1。检测波长:350 nm;进样量:20 μL。
|
|
表 1 梯度洗脱中流动相组分比率变化与时间对应表 |
精密称取本品粉末(过4号筛)5. 0 g,置50 mL离心管中,加入25 mL EDTA-Mcllvaine缓冲液[Mcllvaine缓冲溶液(pH 4):称取磷酸氢二钠(Na2HPO4·12H2O)276 g、柠檬酸(C6H8O7·H2O)129 g、乙二胺四乙酸二钠372 g,用水溶解后稀释并定容至1000 mL],冰水浴振荡10 min后,加入5mL三氯乙酸-水(1:1),以2000 r·min-1的速度离心2 min,等静置分层后,5000 r·min-1离心20 min,取上清液,向残渣中再加入10 mL缓冲液,2 mL三氯乙酸-水(1:1),经冰水浴超声波振荡提取10 min,5000 r·min-1离心10 min,重复上述操作,合并上清液。
取新的固相萃取小柱(重复使用的小柱用甲醇、5% EDTA-2Na溶液交替冲洗,甲醇浸泡保存),用3 mL甲醇清洗小柱,再用10 mL 5%EDTA-M cllvaine溶液、10 mL蒸馏水依次淋洗,然后将上述滤液分次通过固相萃取小柱(流速2 mL·min-1),再用20 mL 5%甲醇溶液冲洗除去杂质,最后用50 mL甲醇洗脱,收集洗脱液,于自动蒸发浓缩仪上45℃氮吹浓缩至0.2 mL,用0.01 mol·L-1柠檬酸溶液定容至1 mL,经0.45 μm微孔滤膜过滤,供HPLC分析。
2.3 对照品溶液的制备准确称取适量土霉素、四环素、金霉素标准物质,用甲醇溶解,使成为1.0 mg·mL-1的标准储备液, 于0~4 ℃避光保存。
分别吸取上述土霉素、四环素、金霉素储备液各0.50 mL,于50 mL容量瓶中用甲醇定容至刻度,混合对照品溶液含土霉素、四环素、金霉素各10.0μg ·mL-1。
2.4 精密度试验取对照品溶液,按上述方法进行重复测定(n=6),计算精密度,其相对标准偏差(RSD)分别为土霉素1. 4 2 %,四环素1. 3 7 %,金霉素2.10%。
2.5 方法的检出限以3倍信噪比计算检出限, 四环素、土霉素为5 μg·kg-1,金霉素为20 μg·kg-1;四环素、土霉素比国标方法[3]降低10倍,金霉素降低2.5倍。
2.6 线性关系考察准确吸取上述混合对照品溶液0.5、1.0、2.0、5.0、10.0、20.0、40.0 mL分别置于100 mL容量瓶中,加甲醇2 mL,用0.01 mol·L-1柠檬酸溶液定容至刻度,得到含土霉素、四环素、金霉素0.05、0.10、0.20、0.50、1.00、2.00、4.00 μg·mL-1,的标准系列溶液。在上述色谱条件下测定,以峰面积为纵坐标,浓度为横坐标绘制标准曲线。
土霉素、四环素在0.05~1.00 μg·mL-1浓度范围内呈线性关系,金霉素在0.20~4.00 μg·mL-1浓度范围内呈线性关系,其线性方程和相关系数见表 2。
|
|
表 2 土霉素、四环素、金霉素的线性方程和线性相关系数 |
在不含3种四环素类抗生素的虾仁样品中,加入不同浓度范围的土霉素、四环素和金霉素标准品,再按样品提取和测定方法,测定3种抗生素含量,计算加标回收率。结果见表 3、图 1~2。
|
|
表 3 回收率试验结果 |
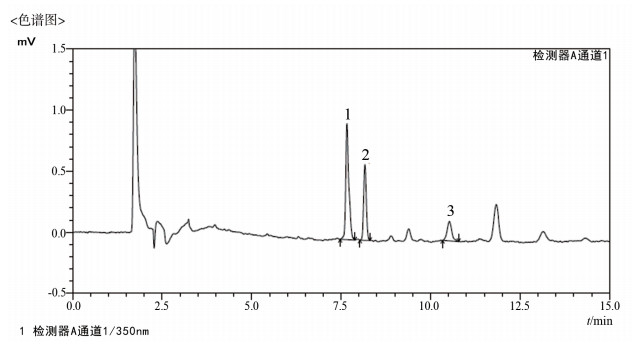
|
图 1 加样回收样品HPLC色谱图 1.土霉素;2.四环素;3.金霉素。 |

|
图 2 对照品HPLC色谱图 1.土霉素;2.四环素;3.金霉素。 |
对市场上购得的5批样品进行检测,由于样品代表性问题,5批样品中土霉素、四环素、金霉素均未检出。
3 讨论 3.1 流动相的选择国标方法[3]中使用乙腈-0.01 mol·L-1磷酸二氢钠溶液(pH 2.5)(35:65),经试验分离效果不理想;采用梯度洗脱,能使3种抗生素各峰分离完全,且峰形良好,保留时间稳定。
3.2 固相萃取条件的选择固相萃取条件的选择主要是洗脱液的选择。根据文献资料报道[4],分别用5%、20%、50%、100%甲醇溶液作洗脱液,进行HPLC测定,所选定的最佳洗脱液为5%甲醇溶液(用纯甲醇配置)。
3.3 提取液的选择经比较,在相同的条件下,Mcllvaine缓冲液的提取效率优于其他缓冲液,因为四环素类抗生素易与二价金属离子形成配合物,且四环素类抗生素的性质属于酸碱两性物质,易与蛋白质发生缔合作用,需用强酸或酸性蛋白提取,但是酸性过强(pH<2),四环素类药物又易发生降解,并且可以结合生物样品中的蛋白质,形成不溶性、难吸收的络合物;在碱性条件下则易生成分子异构体;而通常在弱酸性溶液中比较稳定,所以应该选择含金属络合剂的弱酸性提取液。
3.4 样品前处理方法的选择比较不经固相萃取及经固相萃取的样品HPLC谱图发现,经过固相萃取柱纯化并浓缩的样品,杂质峰较少,土霉素峰、四环素峰清晰,并可看到金霉素峰;而未经固相萃取的样品土霉素峰、四环素峰很低,杂质峰多,检测不到金霉素。故本方法具有选择性强、分离时间短、使用有机溶剂少、不发生乳化现象等优点。
3.5 检测波长的选择据报道[6],四环素类化合物含有苯环、酮基和烯醇组成的共轭体系,具有两个发色团,在近可见光区(350 nm附近)具有强的紫外吸收。土霉素、四环素、金霉素3种抗生素在260和350 nm两个波长附近都有吸收峰,在260 nm附近的吸收最大,但因为杂质在短波长吸收较大,因此选择了350 nm为3种抗生素共同的检测波长。
采用本方法对样品前处理方法进行改进, 与国标方法相比较,在取样量没有增加的情况下对样品进行浓缩处理,并调整流动相比例,采用梯度洗脱,能使各色谱峰避免受杂质峰的干扰,得到良好的分离,保留时间稳定,线性范围好,精密度和准确度均获得满意的结果,能满足水产干制品的分析要求,具有实际应用价值。
| [1] |
山东省中药材标准: 2012年版[S]. 2012: 187
|
| [2] |
徐熔泽, 赵凤利. 浅谈兽药残留的危害[J]. 中国畜牧兽医文摘, 2012(5): 194-196. |
| [3] |
GB/T5009, 116-2003食品卫生检验方法, 理化部分(二)[S]. 2003.
|
| [4] |
罗晓燕, 林玉娜, 刘莉治. SPE-HPLC法同时测定水产品中四种抗生素残留的研究[J]. 现代预防医学, 2005, 32(3): 198-220. |
| [5] |
许韡, 吴于. HPLC法同时检测水产品中残留氯霉素、四环素、金霉素和土霉素[J]. 中国卫生检验杂质, 2013, 23(4): 819-823. |
| [6] |
吉彩霓, 岳振峰, 谢丽琪, 等. 高效液相色谱法同时检测水产品中7种四环素类抗生素残留的研究[J]. 中国兽医科技, 2005, 35(10): 820-826. DOI:10.3969/j.issn.1673-4696.2005.10.015 |
 2017, Vol. 31
2017, Vol. 31