奥硝唑为目前常用的抗厌氧菌药物,作为继甲硝唑和替硝唑后的第三代抗厌氧菌感染药物,疗效稳定,副作用小[1-2]。左奥硝唑作为奥硝唑的单一对映体,与现有的奥硝唑相比,其副反应更小[3]。但临床上使用的奥硝唑、左奥硝唑水溶性极差,做成输液制剂时pH值在3.5左右(人体耐受pH为4.0~9.0),患者用药时易产生静脉炎[4-5],且输液高温灭菌时会产生较高的毒性降解产物2-甲基-5硝基咪唑[6],临床用药安全性较差。磷酸左奥硝唑酯二钠是对左奥硝唑进行化学结构修饰形成的新的化合物[7-8],药代动力学研究表明磷酸左奥硝唑酯二钠在体内可以迅速分解为左奥硝唑[9]。磷酸左奥硝唑酯二钠制备成静脉给药制剂时提高了药物的水溶性,pH值为5.5左右,动物实验表明不会产生静脉炎[10-11],且杂质研究发现不会产生毒性降解产物2-甲基-5硝基咪唑[12]。磷酸左奥硝唑酯二钠为注射用磷酸左奥硝唑酯二钠的原料药,现根据《中华人民共和国药典》(以下简称《中国药典》)2015年版通则1143[13]对磷酸左奥硝唑酯二钠进行细菌内毒素检查法的研究,为建立该品种的细菌内毒素检查法提供科学依据。
1 材料 1.1 仪器TAL-40D型干式恒温器(湛江安度斯生物有限公司);IKA MS3型自动漩涡混合器(广州仪科实验室技术有限公司);FED400型干燥箱(德国宾德公司);XSE205DU型电子天平(梅特勒-托利多公司);其他器皿包括试管、微量移液器及微量移液器配套的枪头(无热原)等。
1.2 药品与试剂磷酸左奥硝唑酯二钠(扬子江药业集团江苏海慈生物药业有限公司,批号18011001、18011101、18011201);鲎试剂(湛江安度斯生物有限公司,0.25 EU·mL-1,批号1901161;0.125 EU·mL-1,批号1901212。福州新北生化工业有限公司,0.25 EU·mL-1,批号18040712;0.125 EU·mL-1,批号18090512;规格0.1 mL/支);细菌内毒素工作标准品(中国食品药品检定研究院,批号150601-201885,规格80 EU/支);细菌内毒素检查用水(BET水,湛江安度斯生物有限公司,批号1812210,规格50 mL/瓶)。
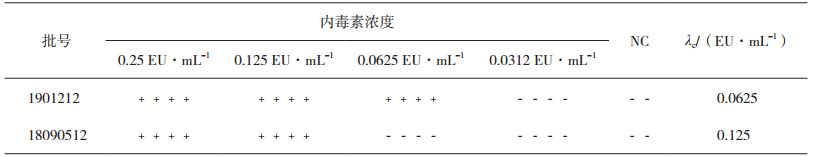
2 方法与结果 2.1 鲎试剂灵敏度复核试验根据4批鲎试剂灵敏度的标示值(λ),将细菌内毒素工作标准品用BET水溶解,置漩涡混合器上混匀15 min,然后制成浓度为2 λ、1λ、0.5 λ和0.25 λ 4个浓度的内毒素标准溶液,每稀释一步均应在漩涡混合器上混合30 s,按《中国药典》2015年版通则1143细菌内毒素检查法[5]复核本试验所用鲎试剂的灵敏度,结果4批鲎试剂灵敏度的测定值(λc)均在0.5 ~ 2.0 λ范围内,符合《中国药典》规定,可用于细菌内毒素检查,详见表 1和表 2。
|
|
表 1 鲎试剂灵敏度复核结果(0.25 EU·mL-1) |
|
|
表 2 鲎试剂灵敏度复核结果(0.125 EU·mL-1) |
根据细菌内毒素检查法(《中国药典》2015年版二部附录Ⅺ E),L=K/M,K为人每千克体重每小时最大可接受的内毒素剂量,M为人用每千克体重每小时的最大供试品剂量。本品制成注射剂规格为0.2 g/支,临床用药量为每日8支,使用方式为静脉滴注,给药时间为1~2 h,故拟使用日剂量为1600 mg·h-1。则K=5 EU/(kg·h),供试品每平方米体表面积剂量乘以0.027即可转换为每千克体质量(M),人体表面积按1.62 m2计算,L=0.19 EU·mg-1。为保证用药安全,本企业对细菌内毒素限值严格控制,至计算值的1/5,确定磷酸左奥硝唑酯二钠的细菌内毒素限值为每1 mg中含有内毒素的量应小于0.04 EU。
称取供试品适量,加BET水溶解,配成初始浓度c=50 mg·mL-1的供试品溶液,按《中国药典》2015年版通则1143细菌内毒素检查法[5]的规定,MVD=cL/λ,计算各灵敏度鲎试剂对应的样品最大有效稀释倍数:MVD0.25=8(6.25 mg·mL-1)、MVD0.125=16(3.125 mg·mL-1)、MVD0.06=32(1.562 mg·mL-1)、MVD0.03=64(0.781 mg·mL-1);在不超过对应MVD的稀释倍数下进行细菌内毒素检查。
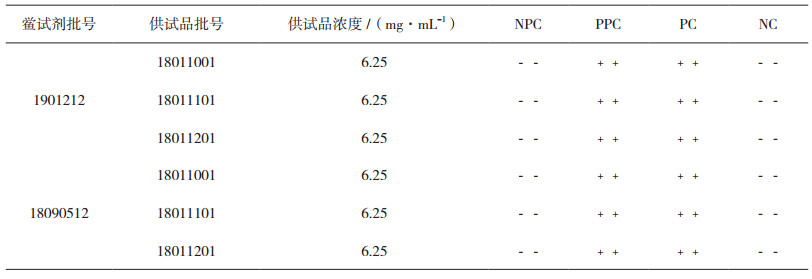
2.3 预干扰试验用灵敏度为0.25 EU·mL-1的鲎试剂,对不超过64倍稀释(即不低0.781 mg·mL-1)的不同浓度的供试品溶液进行干扰预试验,以确定样品的不干扰浓度。称取磷酸左奥硝唑酯二钠242.30 mg,批号:18011001,加4.85 mL BET水溶解,配成初始浓度c=50 mg·mL-1的供试品溶液,再将供试品溶液稀释至不超过MVD的一系列稀释倍数,分别为8倍、16倍、32倍、64倍,得一系列稀释浓度:c1=6.25 mg·mL-1,c2=3.125 mg·mL-1,c3=1.562 mg· mL-1,c4=0.781 mg·mL-1。对这些浓度的供试品溶液进行细菌内毒素检测预干扰试验,将供试品溶液记作NPC,供试品阳性对照溶液记作PPC,同时做2支阳性对照管PC及2支阴性对照管NC,结果见表 3。
|
|
表 3 样品预干扰试验结果 |
由表 3结果可知,供试品溶液(原液)的稀释浓度在0.781~6.25 mg·mL-1时,对鲎试剂与细菌内毒素反应无干扰作用,且试验结果有效。则可选用灵敏度不低于0.25 EU·mL-1的鲎试剂进行正式干扰试验。
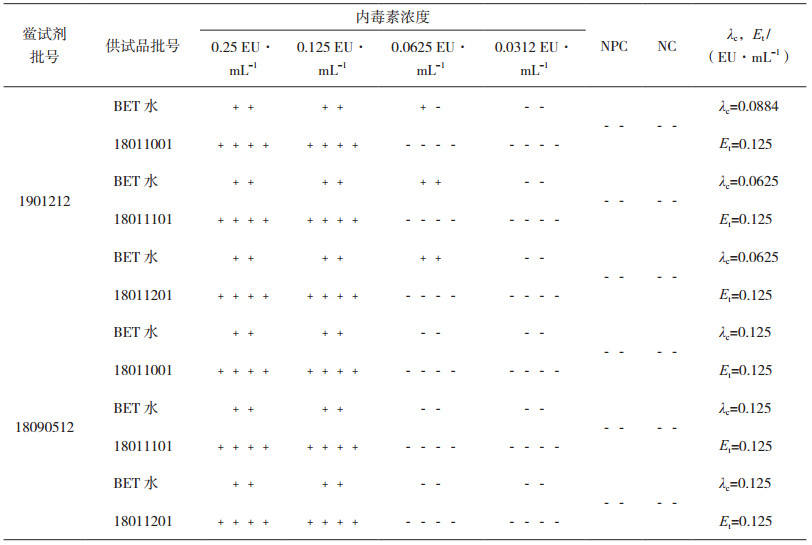
2.4 干扰试验根据预干扰试验结果,选用灵敏度为0.125 EU·mL-1的鲎试剂进行正式干扰试验。称取3个批号的磷酸左奥硝唑酯二钠,加BET水溶解得初始浓度c=50 mg·mL-1的供试品溶液,再用BET水稀释至对内毒素检测无干扰浓度的供试品溶液c=6.25 mg·mL-1。将细菌内毒素标准品用BET水逐步配制成5个浓度的标准品溶液,即4 λ(0.5 EU·mL-1)、2 λ(0.25 EU·mL-1)、λ(0.125 EU·mL-1)、0.5 λ(0.0625 EU·mL-1)、0.25λ(0.0312 EU·mL-1)。按细菌内毒素检查法进行干扰试验,结果见表 4。
|
|
表 4 样品干扰试验结果 |
由表 4结果可知,平行3批次干扰试验中,阴性对照溶液NC、供试品溶液NPC的所有平行管均为阴性;两个厂家鲎试剂标示灵敏度对照系列的结果λc在0.5 λ~2 λ之间(包括0.5 λ和2 λ),符合鲎试剂灵敏度复核实验要求,试验有效。两个厂家鲎试剂干扰试验系列的结果Et在0.5 λ~2 λ之间(包括0.5 λ和2 λ),符合规定。说明供试品溶液稀释至6.25 mg·mL-1时,采用灵敏度λ为0.125 EU·mL-1的鲎试剂进行试验无干扰,可用于细菌内毒素检查。
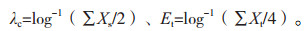
|
其中:Xs,Xt分别为鲎试剂标示灵敏度对照溶液和干扰试验溶液的反应终点浓度的对数值。
2.5 样品细菌内毒素检查称取3个批号的供试品,加BET水溶解,配成50 mg·mL-1的供试品溶液。分别再用BET水稀释8倍,使用λ为0.125 EU·mL-1的鲎试剂(湛江安度斯生物有限公司),按所建立方法进行细菌内毒素检查,结果见表 5。
|
|
表 5 样品细菌内毒素检查结果 |
由表 5结果可知,阴性对照溶液NC的平行管都为阴性,阳性对照溶液PC的平行管都为阳性,供试品阳性溶液PPC的平行管都为阳性时,试验有效。供试品溶液NPC的平行管都为阴性,供试品符合规定。
3 讨论细菌内毒素检查法作为替代热原检查法的一种检测方法,具有简便、灵敏、快速、准确等优点[14-15]。通过预干扰试验可以分析不同样品质量浓度对鲎试剂与细菌内毒素凝集反应的干扰程度,初步筛选出对内毒素反应无干扰作用的浓度范围[16]。而后通过干扰试验,对筛选出的无干扰质量浓度进行进一步确认[17-18]。为了证实该浓度下,不同厂家的鲎试剂均能对本样品进行检测,本试验采用两个不同厂家的鲎试剂(λ=0.125 EU·mL-1)对3个批次的样品进行试验[19-20]。本次试验结果表明,磷酸左奥硝唑酯二钠制备成供试品溶液并稀释至6.25 mg·mL-1及以下浓度后,用灵敏度为0.125 EU·mL-1的鲎试剂进行检查,无干扰作用。因此,磷酸左奥硝唑酯二钠用凝胶法进行细菌内毒素检查,方法可行。
| [1] |
杨晓东, 毛晖. 磷酸左奥硝唑酯二钠微生物限度检查方法的适用性研究[J]. 华西药学杂志, 2019, 34(1): 104-106. |
| [2] |
赵亚男, 吴佩, 孙华, 等. 左奥硝唑剂量递增志愿者耐受性及药动力学研究[J]. 中国药学杂志, 2011, 46(6): 454-457. |
| [3] |
郝玉凤, 王茜, 袁晓洁, 等. 左奥硝唑、奥硝唑、替硝唑治疗盆腔炎临床对比研究[J]. 中国性科学, 2012, 21(8): 3839. |
| [4] |
曹江, 梅和坤, 江学维, 等.注射用磷酸左奥硝唑酯二钠的Ⅰ期临床耐受性试验[J].中国临床药理学杂志, 31(23): 2311-2313.
|
| [5] |
高燕. 滴虫性阴道炎应用替硝唑与奥硝唑治疗的临床疗效探究[J]. 中国处方药, 2017, 15(4): 67-68. DOI:10.3969/j.issn.1671-945X.2017.04.044 |
| [6] |
何学军, 徐樱珠, 丁亚军, 等. 注射用左旋奥硝唑磷酸酯二钠对小鼠神经系统的影响[J]. 华西药学杂志, 2016, 31(3): 259-261. |
| [7] |
赵芊, 李丽丽, 胡蓓, 等. 磷酸左奥硝唑酯二钠在食蟹猴体内的药代动力学研究[J]. 药学学报, 2018, 53(1): 90-96. |
| [8] |
赵婉珍, 贾东岗, 雷招宝. 奥硝唑的不良反应及预防与处理[J]. 药学与临床研究, 2011, 19(1): 72-75. |
| [9] |
田怀平, 王美纳. 奥硝唑的药理作用和临床应用[J]. 中国医院用药评价与分析, 2002, 2(5): 303-304. DOI:10.3969/j.issn.1672-2124.2002.05.024 |
| [10] |
邹东娜, 许珂, 侯宁, 等. 左奥硝唑治疗腹部厌氧菌感染临床观察[J]. 中国医院用药评价与分析, 2015, 15(4): 460-463. |
| [11] |
刘学红, 郭瑞臣, 黄明慧. 抗菌药物的药动学和药效学参数对临床用药的意义[J]. 中国医院药学杂志, 2005, 25(2): 154-155. DOI:10.3321/j.issn:1001-5213.2005.02.030 |
| [12] |
钟诗龙, 黄民, 赵香兰. 药代动力学/药效动力学参数对临床用药的意义[J]. 中国抗感染化疗杂志, 2003, 3(3): 177-181. DOI:10.3321/j.issn:1009-7708.2003.03.020 |
| [13] |
中华人民共和国药典: 四部[S]. 2015: 154-156.
|
| [14] |
周筱莉. 我国细菌内毒素检查法的应用进展[J]. 中国医药导报, 2010, 7(23): 14-16. DOI:10.3969/j.issn.1673-7210.2010.23.007 |
| [15] |
肖贵南, 孙清萍, 盛英美. 如何建立新药的细菌内毒素检查方法[J]. 中国医药导报, 2011, 8(32): 159-162. DOI:10.3969/j.issn.1673-7210.2011.32.073 |
| [16] |
段鹏, 陈海棠, 范彪, 等. 亚叶酸钠注射液细菌内毒素检测方法验证[J]. 中国药事, 2016, 30(4): 397-400. |
| [17] |
肖贵南, 孙清萍, 盛英美, 等. 如何建立新药的细菌内毒素检查方法[J]. 中国医药导报, 2011, 8(32): 159-160. DOI:10.3969/j.issn.1673-7210.2011.32.073 |
| [18] |
中国药品检验标准操作规程[S]. 2010.
|
| [19] |
唐先明, 何志一, 刘建辉, 等. 热原检查用兔细菌内毒素敏感性研究[J]. 黑龙江医药, 2014, 27(1): 1052-1055. |
| [20] |
孙哲. 细菌内毒素检验[J]. 世界最新医学信息文摘(电子版), 2012(9): 128. |
 2019, Vol. 33
2019, Vol. 33