氨基糖苷类抗菌药物(Aminoglycoside Antibiotics)具有相似的化学结构,都是以碱性环己多元醇为苷元,与氨基糖缩合而成的苷,可用于治疗革兰氏阴性杆菌严重感染,是临床应用较早的一类广谱抗菌药物[1]。品种主要有链霉素、庆大霉素、妥布霉素、阿米卡星、大观霉素、巴龙霉素、卡那霉素、奈替米星、依替米星、新霉素、核糖霉素等,它们的抗菌谱及理化性质都存在共同之处。本文对氨基糖苷类抗菌药物的结构组成、发展历程、测定方法等进行概述,并在此基础上对各国药典中离子色谱法控制该类抗菌药物的质量标准进行综述。
1 氨基糖苷类抗菌药物的发展历程根据氨基糖苷类的结构特点及抗菌特性,其发展可分为3个阶段[2]。第1阶段以卡那霉素为代表,其结构特点为完全羟基化的氨基糖与氨基环醇相结合,不抗绿脓杆菌,主要品种还有新霉素、巴龙霉素、链霉素及核糖霉素等;第2阶段以庆大霉素为代表,其结构中均含有脱氧氨基糖,抗绿脓杆菌,主要品种还有妥布霉素、西索米星及小诺霉素等;第3阶段为氨基环醇上1-N位取代的半合成衍生物,特点是保留了母体的抗菌活性,耳肾毒性较小,抗耐药性等,主要品种有阿米卡星、阿贝卡星、奈替米星及我国创新的一类新药依替米星等。
根据来源分类,氨基糖苷类抗菌药物分为发酵的和半合成的2种,其中发酵来源主要为链霉菌和小单孢菌[3]。来源于链霉菌的有链霉素、新霉素、卡那霉素、巴龙霉素、妥布霉素、核糖霉素及大观霉素等;来源于小单孢菌的有庆大霉素、西索米星等。半合成的氨基糖苷类抗菌药物是以发酵来源的抗菌药物为前体,再进行结构改造而得到[4]。首个半合成的该类抗菌药物阿米卡星是卡那霉素A的1-N-4-氨基-2-羟丁酸的衍生物,其活性更强、酶稳定性更好。此外,由西索米星结构修饰得到的奈替米星、庆大霉素B的1-N-HABA衍生物异帕米星及我国自主研发的新药依替米星等均为半合成类氨基糖苷类抗菌药物,具有更强的抗菌活性、低耐药性、更小的毒副作用及良好的抗菌药物后效应。
1970年之前,各国药典主要采用微生物检定法控制氨基糖苷类抗菌药物的含量,随后各国药典采用半定量法控制组分及杂质限度,如薄层色谱法(TLC)。1990年之后,高效液相色谱(HPLC)衍生化方法成为了该类药物组分及有关物质的主要控制手段。2002年后,离子色谱脉冲安培检测新技术开始用于新霉素中有关物质的测定,随后该方法陆续用于妥布霉素、庆大霉素、卡那霉素、大观霉素及阿米卡星等,至今离子色谱仍是氨基糖苷类抗菌药物的主要检测技术。
2 离子色谱概述离子色谱(Ion Chromatography)是高效液相色谱的一种,目前已成为分析化学领域中发展最快的分析方法之一,它已被广泛地用于无机阴离子、无机阳离子、有机酸、糖醇类、氨基糖类、氨基酸、蛋白质、糖蛋白等物质的测定。它具有快速、方便、灵敏度高、选择性好、可同时分析多种化合物、分离柱的稳定性好、容量高、样品用量少和易实现自动化等优点,已在能源、环境、地质、食品等领域得到了广泛的应用。
离子色谱由流动相传送部分、分离柱、检测器和数据处理4个部分组成。主要特别之处是其所有与流动相及供试品接触的管道、阀门、泵、接头等器件均宜使用能耐酸碱腐蚀及在与水互溶的有机溶剂中不溶胀的惰性材料,如聚醚醚酮(PEEK)等。分离柱是离子色谱的关键部件之一,新型的有机聚合物离子交换柱填料一般为苯乙烯-二乙烯基苯共聚物、乙基乙烯基苯-二乙烯基苯共聚物等,可在pH 0~14酸碱范围及与水互溶的有机溶剂中稳定,可用强酸或强碱作为流动相,还可在流动相中加入有机溶剂以改善分离的选择性、缩短分析时间及改善峰形,试验结束后可用有机溶剂清洗色谱柱以除去有机污染物等[5]。当然,在采用离子色谱-安培检测器分析氨糖类等有机化合物时,也可用HPLC常规使用的C8或C18色谱柱。
离子色谱的检测器分为电化学检测器和光学检测器。电化学检测器主要有电导和安培检测器,而光学检测器主要是紫外检测器、荧光检测器等。电导检测器主要用于测定无机阴离子、无机阳离子及部分极性有机物如羧酸等;安培检测器又分为直流安培和积分安培(包括脉冲安培),直流安培主要用于测量在外加电压下能在工作电极上发生氧化还原反应的物质如碘离子(I-)、硫氰酸根离子(SCN-)和各种酚类化合物等;积分安培和脉冲安培检测器则主要用于测量糖类和氨基酸类有机化合物。
氨基糖苷类抗菌药物结构中含有多个氨基(-NH2)、羟基(-OH),在强碱性溶液中易解离成阴离子,在一定电压下,可在金电极表面发生氧化反应,从而实现该类抗菌药物脉冲安培检测。脉冲安培检测器有3种电极,分别是工作电极、参比电极及对电极。工作电极通常为金电极;参比电极一般为Ag/AgCl电极,主要用于反馈溶液的电位信息;对电极通常为钛或不锈钢材料,具有保持电位稳定的作用,同时,还可防止大电流对参比电极的破坏。当在工作电极和参比电极之间施加工作电位时,该类抗菌药物在氧化过程中产生的电子即转移到工作电极表面,使工作电极和对电极之间产生电流,可通过一段时间的积分来测量,检测信号的单位为纳库(nC),离子色谱脉冲安培检测器已成为氨基糖苷类抗菌药物比较理想的质量控制方法[6]。
3 各国药典中离子色谱法分析氨基糖苷类抗菌药物的进展氨基糖苷类抗菌药物极性大、无特征紫外吸收,难以直接用常规的高效液相色谱法紫外检测器或荧光检测器检测。早期的各国药典多采用TLC控制其有关物质,如新霉素中新霉胺的控制[7],链霉素中链霉素B的控制[8-9],但薄层色谱法灵敏度低、专属性差、定量较困难而无法有效控制其有关物质。
随后,一些药典开始采用HPLC衍生化法测定此类抗菌药物的有关物质及组分,如庆大霉素C组分测定[10]、阿米卡星有关物质的测定[11-12]。衍生化技术虽然能部分解决质量分析中的难题,但衍生化方法的试验结果受反应温度、反应时间、反应完全性、衍生化试剂引入额外杂质峰、衍生化试剂的质量等因素影响,无法明确判断该法检测到的杂质来源,且衍生化产物间紫外吸收系数的差异,影响了多组分药物测定结果的准确性。
高效液相色谱蒸发光散射检测器(HPLCELSD)也常被用于测定氨基糖苷类抗菌药物的有关物质及组分,《中华人民共和国药典》(以下简称《中国药典》)2010年版[13]收载的氨基糖苷类抗菌药物中,有9个品种采用HPLC-ELSD法测定有关物质,2个品种采用其测定含量。ELSD为通用型质量检测器,不同的物质在ELSD中响应因子几乎一致,但灵敏度较低、漂移管易被污染,且该检测器的响应值与待测样品的浓度呈对数关系,测定时需制备随行标准曲线,计算过程相对复杂。
氨基糖苷类抗菌药物的含量测定大部分都采用微生物检定法。微生物检定法虽然灵敏度高、测定原理与临床应用的要求一致,但该法测定的是总效价,不能分别测定主成分与有关物质的含量,且操作烦琐、误差较大等。
离子色谱技术的快速发展使离子色谱法成为氨基糖苷类抗菌药物较理想的检测方法,其适合检测能溶于水、有一定解离度、无特征紫外吸收的有机化合物,可直接测定其有关物质、组分及含量。氨基糖苷类抗菌药物含有多个醇羟基,能在强碱性溶液中离子化,因此,可在强碱条件下采用阴离子交换色谱柱进行分离;此外,还可通过加入离子对试剂如辛烷磺酸钠等与氨基糖苷类化合物形成离子对,增强其在反相色谱中的保留而进行分析,也可加入适量的有机改性剂,用于减少保留时间、改进分离的选择性及增加有机化合物的溶解度。使用电化学检测器时,在外加电压下,氨基糖苷类抗菌药物可在金电极上发生氧化反应,产生电流而被检测。安培检测器为选择性检测器,对于被测物质有特定的氧化还原电位,而许多干扰物质可能不是电活性物质,在电极上不发生氧化还原反应,具有良好的选择性,且该方法准确、灵敏度高、重现性好、线性范围宽及淋洗液配制简单等,为氨基糖苷类抗菌药物的质量控制提供了较好的方法。下面对各国药典中离子色谱法控制氨基糖苷类抗菌药物的发展进行分析综述。
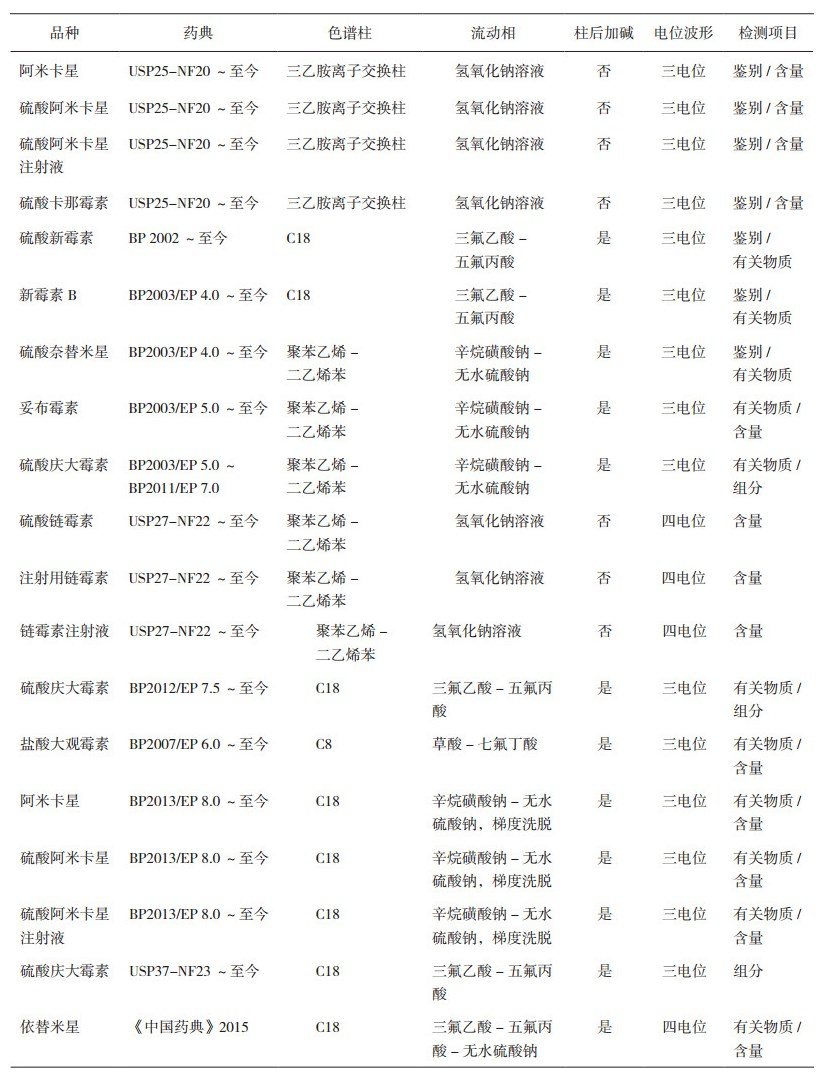
各国药典中采用离子色谱法控制氨基糖苷类抗菌药物的收载情况见表 1。早期的国外药典如美国药典USP25-NF20[14]采用高容量的三乙胺阴离子交换色谱柱,以氢氧化钠为淋洗液测定阿米卡星及卡那霉素的含量。高容量的离子交换色谱柱必须使用高离子强度的淋洗液才可以将被测物质完全洗脱下来,而高离子强度的氢氧化钠淋洗液容易吸收空气中的二氧化碳且无法使用淋洗液在线发生器制备,方法重复性、分离度及灵敏度均不佳,这在一定程度上限制了其应用。之后,各国药典采用耐强酸、强碱和高浓度盐的苯乙烯-二乙烯基苯共聚物填料色谱柱代替传统的阴离子交换柱,流动相换成不同链长的烷基磺酸盐离子对试剂以增加待测物的色谱保留,及较高浓度的硫酸盐以缩短分析时间,柱后加碱以适应脉冲安培检测器检测,测定了妥布霉素、庆大霉素、奈替米星、阿米卡星及大观霉素。方法虽然较之前的方法重复性好,但这类色谱柱的柱效较低,色谱峰形状及分离效果均欠佳,特别是高浓度的硫酸盐易析出结晶导致检测信号不稳定、仪器泄露等情况,需要经常清理系统。
|
|
表 1 各国药典中离子色谱法分析氨基糖苷类抗菌药物的收载情况 |
随着离子色谱技术的不断进步与发展,各国药典的离子色谱方法也在不断改善。近期的各国药典采用广泛应用的十八烷基键合硅胶色谱柱代替了苯乙烯-二乙烯基苯共聚物色谱柱,流动相采用烷基化有机酸如三氟乙酸、五氟丙酸或七氟丁酸等作为离子对试剂,对庆大霉素及阿米卡星进行了测定。改进后的方法,色谱柱可缩短分析时间,具有较高灵敏度,流动相配制较简单,最主要的是流动相不易析出结晶,增加了工作电极的稳定性,提高了方法的重复性、分离度、响应信号及检测灵敏度,更适合该类抗菌药物的分析。
目前,离子色谱仪器因价格昂贵而未普及,实验影响因素较多而限制其广泛应用,如使用的所有容器及管路应用去离子水冲洗干净,流动相应用去离子水配制且需超声脱气、流动相过滤时应使用尼龙膜,柱后碱液配制时应先加入高浓度碱液再在氮气或氦气保护下混匀,洗针剂、洗泵溶液需每天更换,工作电极在适用前后均需拆下用去离子水冲洗干净,如被污染响应降低则需要打磨电极,参比电极使用前需校正,使用后需取下保存于氯化钾溶液中,仪器使用后应用去离子水冲洗整个管路并保存于80%乙腈中等。若实验操作过程中不注意则会导致检测器信号不稳定、重现性降低、背景噪音增加等问题而影响检测。但随着时间的推移,离子色谱技术的不断普及,将会有更多的检测及研究机构使用离子色谱仪并不断解决出现的各种问题,相信不久的将来,离子色谱技术将会被大规模应用并成为氨基糖苷类抗菌药物质量控制的主要工具。
《中国药典》2015年版[15]在吸取各国药典经验的基础上,首次将离子色谱引入正文中,采用三氟乙酸及五氟丙酸体系测定依替米星及其制剂的含量及有关物质,四电位波形。该方法专属性强、重复性好、信号响应稳定、分离度好及灵敏度高[16]。
3.1 英国药典与欧洲药典中离子色谱分析氨基糖苷类抗菌药物英国药典2002年版[8]最先采用离子色谱测定的品种为硫酸新霉素。新霉素是从新霉素链霉菌代谢产物中分离得到的水溶性复合物,主要成分为新霉素B和新霉素C。英国药典从2002年版开始、欧洲药典从4.0版[9]开始均采用离子色谱法脉冲安培检测器测定硫酸新霉素原料的有关物质。方法为采用碱处理过的C18色谱柱,柱温25 ℃,流动相为1000 mL无二氧化碳的去离子水中加入20.0 mL三氟乙酸及6.0 mL氢氧化钠溶液,流速为0.7 mL·min-1;柱后加碱(50%氢氧化钠溶液1→25),柱后流速为0.5 mL·min-1,三电位波形检测;方法规定杂质C峰与新霉素B峰分离度不得小于2.0,控制了杂质A、杂质C、其他单个杂质及其他总杂质限度。
新霉素B也称弗式菌丝素,是新霉素复合物中含量最高、活性最强的成分。英国药典2003年版[17]及欧洲药典4.0版[9]起均采用与硫酸新霉素同样的方法控制其有关物质。
随后,英国药典2003年版、欧洲药典5.0版及之后的版本陆续将离子色谱柱后加碱方法应用于奈替米星、妥布霉素、庆大霉素、大观霉素及阿米卡星等品种。方法的共同特点为使用的色谱柱为耐强酸碱的聚苯乙烯-二乙烯基苯柱或耐酸的C18柱,流动相中多采用烷基磺酸钠作为离子对试剂,与在酸性条件下解离的氨基糖苷类抗菌药物形成离子对,增强其在色谱柱中的保留,再加入较高浓度的硫酸钠盐以缩短分析时间,最后加入少量的有机改进剂改善分离;脉冲安培检测器,检测电位均为三电位波形。
奈替米星又称乙基西索米星,是西索米星1-N-乙基化产物,为半合成的氨基糖苷类抗菌药物,抗菌谱广、毒性较低、对钝化酶较稳定。英国药典2003年版[17]至目前版本[18]及欧洲药典4.0版[9]至目前版本[19]均采用离子色谱法测定了硫酸奈替米星原料的有关物质,方法均一致。色谱柱为聚苯乙烯-二乙烯基苯,柱温50 ℃,流动相为无二氧化碳的去离子水中含有35 g·L-1无水硫酸钠,0.5 g·L-1辛烷磺酸钠、10 mL·L-1四氢呋喃及50 mL·L-1浓度为0.2 mol·L -1的磷酸二氢钾溶液(预先用22.5 g·L -1的磷酸调节pH为3.0),流速为1.0 mL·min-1;柱后溶液为20 g·L-1的氢氧化钠,柱后流速为0.3 mL·min-1;系统适用性规定杂质A峰与杂质B峰分离度不得小于2.0、奈替米星峰与杂质A峰分离度不得小于3.0,方法分别对奈替米星的杂质A、杂质B、其他单个杂质及其他总杂质限度进行控制。
妥布霉素为黑暗链霉菌产生的氨基糖苷类抗菌药物,主要对革兰氏阴性菌特别是绿脓杆菌有效,但具有一定的耳肾毒性。英国药典2003年版[17]至目前版本[18]及欧洲药典5.0版[20]至目前版本[19]均采用离子色谱法测定其有关物质及含量。色谱柱为聚苯乙烯-二乙烯基苯,柱温55 ℃,流动相为无二氧化碳的去离子水中含有52 g·L-1无水硫酸钠,1.5 g·L-1辛烷磺酸钠、3 mL·L-1四氢呋喃及50 mL·L-1浓度为0.2 mol·L-1的磷酸二氢钾溶液(预先用稀磷酸调节pH值为3.0),流速为1.0 mL·min-1;柱后加碱(50%氢氧化钠溶液1→25),柱后流速为0.3 mL·min-1;脉冲安培检测器,检测电位为三电位波形。标准规定杂质A峰与妥布霉素峰分离度不得小于3.0,方法对单个杂质及总杂质限度进行控制。
庆大霉素是由绛红小单孢菌属、棘孢小单孢菌属等发酵产生的一组结构相近的多组分氨基糖苷类抗菌药物,并以C族复合物为主,包括C1a、C2、C2a、C1等,为杀菌力较强的广谱抗生素,尤其对于金葡菌、多数革兰氏阴性杆菌包括一般抗菌药物不易控制的变形杆菌、沙雷氏菌及绿脓杆菌均具良好作用[21]。英国药典从2003年版[17]、欧洲药典从5.0版[20]开始采用离子色谱法对硫酸庆大霉素原料进行有关物质及组分的测定。方法采用聚苯乙烯-二乙烯基苯色谱柱,柱温55 ℃,流动相为无二氧化碳的去离子水中含有60 g·L-1无水硫酸钠,1.75 g·L-1辛烷磺酸钠、8 mL·L-1四氢呋喃及50 mL·L-1浓度为0.2 mol·L-1的磷酸二氢钾溶液(预先用稀磷酸调节pH值为3.0),流速为1.0 mL·min-1;柱后加碱(50%氢氧化钠溶液1→25),柱后流速为0.3 mL·min-1;脉冲安培检测器,三电位波形。有关物质采用主成分自身对照法,对任何单个杂质及总杂限度进行控制。组分项下规定庆大霉素C1含量范围为20.0%~40.0%,庆大霉素C1a为10.0%~30.0%,庆大霉素C2+C2a+C2b为40.0%~60.0%。该方法虽然采用有机聚合物色谱柱,离子对试剂流动相及柱后加碱检测模式,但该方法有关物质的分离度与灵敏度不理想。
上述方法持续至英国药典2011年版[22]及欧洲药典7.0版[12],之后的英国药典2012年版[11]至目前版本[18]及欧洲药典7.5版[23]至目前版本[19]对上述方法进行了修订,采用更为普及的十八烷基键合硅胶色谱柱及常规柱温,用易挥发的酸代替原流动相中的盐,减少了盐在电极表面沉积并使检测信号更稳定;有关物质增加了杂质A、B的限度控制,组分方面庆大霉素C1及庆大霉素C2+C2a+C2b含量范围均有变化。具体方法:C18色谱柱,柱温35℃,900 mL无二氧化碳的去离子水中加7 mL三氟乙酸,加250 μL五氟丙酸,加4 mL的12.5 mol·L-1氢氧化钠,混匀后用0.5 mol·L -1的氢氧化钠调pH2.6,加乙腈37 mL,最后加无二氧化碳的去离子水至1000 mL作为流动相,流速1.0 mL·min-1;柱后加碱(50%氢氧化钠溶液1→25),柱后流速为0.3 mL·min-1;脉冲安培检测器,检测电位为三电位波形。方法要求杂质A峰(西索米星)与庆大霉素C1a峰分离度应不小于1.2,庆大霉素C2峰与庆大霉素C2b峰分离度应不小于1.5;有关物质测定中,以西索米星对照品溶液为对照溶液,对杂质A(西索米星)、杂质B(小诺霉素)限度进行单独控制,对其他单个杂质及总杂质限度也分别进行控制;组分测定中,规定庆大霉素C1含量范围为25.0%~45.0%,庆大霉素C1a为10.0%~30.0%,庆大霉素C2、C2a、C2b之和为35.0%~55.0%。该方法采用三氟乙酸和五氟丙酸混合离子对试剂,增加了庆大霉素各组分在色谱柱上的保留,提高了分离度及检测灵敏度,可分离出30多种有关物质,对有关物质的测定更为准确。但该方法仍然采用三电位波形,电极容易被氧化产物污染需要经常打磨以维持其响应稳定性。
大观霉素是从链霉菌Streptomycts spectabilis NRRL2792的发酵液中分离出的抗菌药物,对革兰氏阳性菌和阴性菌均有作用,尤其对奈瑟氏淋球菌作用最强。大观霉素可形成硫酸盐或盐酸盐,但盐酸盐溶解性更好,目前药用的为盐酸盐[24]。英国药典从2007年版[25]、欧洲药典从6.0版[26]开始运用离子色谱测定盐酸/硫酸大观霉素原料的有关物质及含量。色谱柱为C8柱,柱温为室温,流动相为1000 mL无二氧化碳的去离子水中加入4.2 g草酸及2.0 mL的七氟丁酸,用氢氧化钠溶液调节pH值为3.2,最后加入105 mL的乙腈,混匀,过滤后脱气,流速为1.0 mL·min-1;21 g·L-1的氢氧化钠溶液为柱后溶液,柱后流速为0.5 mL·min-1;脉冲安培检测器,检测电位为三电位波形。系统适用性规定杂质E峰与大观霉素峰分离度不得小于1.5,方法对杂质A、C、D、E、F、G、其他单个杂质及总杂质限度分别进行控制,另外规定在测定杂质A含量时,采用加校正因子的主成分自身对照法,将杂质A峰面积乘以校正因子0.4后计算其含量。
阿米卡星是卡那霉素的半合成衍生物,对许多肠道革兰阴性杆菌所产生的氨基糖苷类钝化酶稳定,适用于治疗革兰阴性杆菌对卡那霉素、庆大霉素或妥布霉素耐药菌株所致的严重感染[27]。英国药典从2013年版[28]、欧洲药典从8.0版[29]开始采用离子色谱法测定阿米卡星、硫酸阿米卡星原料的有关物质及含量,并首次使用了梯度洗脱程序(改变流动相中无水硫酸钠盐的浓度),提高了分离效率。色谱柱为C18柱,柱温40 ℃,流动相A为无二氧化碳的去离子水中含有20 g·L-1无水硫酸钠、1.8 g·L-1辛烷磺酸钠、1.4%(V/V)四氢呋喃及5%(V/V)浓度为0.2 mol·L-1的磷酸二氢钾溶液(预先用稀磷酸调节pH值为3.0),流动相B为无二氧化碳的去离子水中含有28 g·L-1无水硫酸钠、1.8 g·L-1辛烷磺酸钠、1.4%(V/V)四氢呋喃及5%(V/V)浓度为0.2 mol·L-1的磷酸二氢钾溶液(预先用稀磷酸调节pH值为3.0),流速为1.0 mL·min-1;柱后加碱(50%氢氧化钠溶液1→25),柱后流速为0.3 mL·min-1;脉冲安培检测器,检测电位为三电位波形。有关物质采用梯度洗脱,除杂质I采用杂质I对照品溶液外标法定量外,其余杂质均采用主成分自身对照法定量,规定杂质A、B、F、H、I不得过0.5%,其他单个杂质不得过0.5%,总杂不得过1.5%;含量测定仅用流动相A等度运行,采用外标法测定。
3.2 美国药典中离子色谱分析氨基糖苷类抗菌药物美国药典USP25-NF20[14]首次采用离子色谱法脉冲安培检测器测定了阿米卡星(包括硫酸阿米卡星及阿米卡星注射液)、卡那霉素(包括硫酸卡那霉素、卡那霉素注射液及硫酸卡那霉素胶囊)的含量,方法均一样。色谱柱为高容量三乙胺离子交换柱(4.0 mm×250 mm,7.5 μm),淋洗液为0.115 mol·L-1的氢氧化钠溶液,流速为0.5 mL·min-1,工作电极金电极,pH/Ag/AgCl复核参比电极,三电位波形。该方法采用单一的氢氧化钠溶液作为淋洗液,不需要柱后加碱,简单易操作,但氢氧化钠淋洗液在配制和使用过程中易吸收二氧化碳,使淋洗液的强度改变基线漂移,影响方法的重复性,且该方法未对有关物质进行控制。
随后,USP27-NF22[30]及之后的版本采用聚苯乙烯-二乙烯基苯色谱柱(4.0 mm×250 mm),70 mmol·L-1氢氧化钠溶液为淋洗液,流速为0.5 mL·min-1,积分安培检测器检测,并首次使用四电位波形测定了硫酸链霉素原料、硫酸链霉素注射液及注射用硫酸链霉素的含量。
目前,用于氨基糖苷类抗菌药物的电位波形主要为三电位波形及四电位波形,波形的不同可影响检测灵敏度、重复性、背景噪声、信号响应及信号稳定性。三电位波形采用3种不同的工作电位即E1、E2及E3,其中E1为工作电位,E2为清洗正电位,E3为清洗负电位。氨基糖苷类抗菌药物因在工作电极表面发生氧化反应而产生电流变化可被检测,但其反应产物会沉淀于电极的表面从而抑制被测物质进一步氧化以干扰测定。三电位波形最初是为避免氧化反应的产物毒化电极表面而使用的,各国药典中大多采用该波形,但该波形中使用较高的正电位来氧化清洗电极,过度的清洗降低了电极的使用寿命,同时更容易污染及腐蚀电极,因此,使用三电位波形时为获得较高的灵敏度需要经常打磨电极[31]。四电位波形是后期发展的,其还原清洗电位清除了工作电极表面的氧化物及污染物,可减少电极的损耗,延长电极的使用寿命,增加电极的稳定性,具有较高的灵敏度及耐用性,四电位波形将会逐渐取代三电位波形,成为分析氨基糖苷类抗菌药物的主要检测波形[32]。
美国药典运用离子色谱法测定此类抗菌药物多采用离子交换柱,以氢氧化钠作为淋洗液进行分析。氨基糖苷类抗菌药物在强碱性条件下可解离成阴离子,使用阴离子交换柱进行分析;同时,该类药物中含有较多的脂肪氨基(-NH2)和羟基(-OH),在高pH值的淋洗液中可在金电极上发生氧化还原反应,不需要柱后加碱就能采用安培检测器检测。采用氢氧化钠作为淋洗液可降低背景噪音,增加灵敏度,但氢氧化钠配制及使用过程中极易吸收空气中的二氧化碳,产生洗脱能力较强的CO32-,会导致淋洗液的组成和浓度改变而引起基线不稳、保留时间改变、重现性不佳等,还会由于CO32-的强洗脱能力将强保留组分洗脱下来而出现鬼峰[6]。虽然目前在线淋洗液发生器运用普遍,可改善基线漂移及提高重现性,但在线淋洗液发生器无法产生浓度高于100 mmol·L-1的淋洗液,除非采用毛细管离子色谱。
为改善方法的分离效率,USP37-NF32 [33]及之后的版本采用与阿米卡星等不同的离子色谱柱后加碱方法测定了庆大霉素原料的组分。方法为以900 mL无二氧化碳的去离子水中加7 mL三氟乙酸,加250 μL五氟丙酸,加4 mL的12.5 mol·L-1氢氧化钠,混匀后用0.5 mol·L -1的氢氧化钠调pH2.6,加乙腈37 mL,最后加无二氧化碳的去离子水至1000 mL作为流动相,流速1.0 mL·min-1;20 g·L-1的氢氧化钠溶液为柱后溶液,柱后流速为0.3mL·min-1,脉冲安培电化学检测器,三电位波形检测。方法要求庆大霉素C2峰与庆大霉素C2b峰分离度应不小于1.5;并规定庆大霉素C1a含量范围为10%~35%,庆大霉素C2+C2a为25%~55%,庆大霉素C2b+C1为25%~50%。方法采用柱后加碱的模式,操作较单一淋洗液模式复杂,但该方法受空气中二氧化碳影响较小,整个分析系统较稳定,分离度较高,灵敏度较好,更适合此类抗菌药物的检测。
3.3 中国药典中离子色谱分析氨基糖苷类抗菌药物《中国药典》2005年版[34]在附录V D高效液相色谱法检测器项下提到了电化学检测器,从2010年版开始在附录中单独列出了离子色谱法,对离子色谱的色谱柱、洗脱液、检测器、测定法均进行了详细说明,但直到2015年版[15]才首次将该法收录至正文中,测定的品种为硫酸依替米星,采用了稳定性及灵敏度均更好的四电位波形,并采用了加校正因子的主成分自身对照法测定奈替米星杂质的含量。
硫酸依替米星是我国自主研发的一种半合成氨基糖苷类抗菌药物,抗菌谱广,毒性较低,对革兰氏阴性菌及革兰氏阳性菌均有效。该药是以庆大霉素C1a为原料,通过络合催化保护氨基、硅烷化保护羟基、缩合还原型N-乙基化等一系列反应,在庆大霉素C1a的1-N位上引入乙基而得。方法采用C18色谱柱(4.6 mm×250 mm,5 μm),以0.2 mol·L-1三氟醋酸溶液[含0.05%五氟丙酸、1.5g·L-1无水硫酸钠、0.8%(V/V)的50%氢氧化钠溶液、用50%氢氧化钠溶液调节pH值至3.5-乙腈(96:4)为流动相,流速为1.0 mL·min-1;脉冲安培检测器检测,工作电极为金电极,参比电极为Ag/AgCl复核电极,四电位,柱后加碱(50%氢氧化钠溶液1→25),柱后流速为0.5 mL·min-1;系统适用性要求依替米星峰与杂质奈替米星峰分离度应大于4.0,有关物质标准规定杂质奈替米星含量不得大于2.5%,其他单个杂质含量不得大于2.5%,总杂质含量不得大于5.0%。方法测定了硫酸依替米星原料的有关物质及含量,这也是中国药典唯一一个采用离子色谱法控制的品种。
4 展望分析各国药典收载的氨基糖苷类抗菌药物质量标准变迁,氨基糖苷类抗菌药物的测定方法正逐渐从经典的TLC法、HPLC衍生化法、HPLC-ELSD法向灵敏度更高、选择性更强的离子色谱方法发展。近年来,离子色谱法已在抗菌药物分析领域得到了日益广泛的应用,其能解决气相色谱及高效液相色谱难以分析的问题,适合检测一些能溶于水,并有一定离解度的化合物,特别对不易挥发,又无紫外吸收的药物,是比较理想的分析方法。但实际运用中离子色谱电化学检测器有时难以满足需要,如难以进行痕量分析,但随着仪器与色谱技术的发展,与灵敏度更高的检测器联用将成为未来发展的趋势。
质谱作为一种理想的结构分析与痕量分析手段,与离子色谱联用后,可以在药物及其杂质分析方面发挥重要作用。氨基糖苷类抗菌药物在结构和理化性质上非常相似,均含有多个伯胺或仲胺基团显弱碱性,采用常规的检测手段进行鉴别及杂质分析存在一定困难。但此类抗菌药物在质谱上具有较强的正离子响应,运用质谱可快速准确地获得其组分或杂质的多级质谱信息,通过归纳裂解规律可推测组分及杂质的结构,为氨基糖苷类抗菌药物的定性定量分析及有关物质检测提供可靠的理论依据。目前,质谱已成功运用于庆大霉素、小诺霉素、依替米星、奈替米星、阿米卡星、妥布霉素、巴龙霉素等氨基糖苷类抗菌药物的检测。周茂金等[35]采用电喷雾离子阱质谱对庆大霉素、小诺霉素、依替米星、奈替米星等8种氨基糖苷类抗菌药物进行多级质谱分析,获得了丰富的结构信息。杨利红等[36]运用质谱法分析了阿米卡星、妥布霉素、新霉素、巴龙霉素等14种氨基糖苷类抗菌药物的裂解规律并获得了结构信息。袁耀佐等[37]以水-氨水-冰醋酸-甲醇为流动相采用HPLC-ESI-MS推定了硫酸小诺霉素中14个杂质的结构并进行归属,解决了过去该品种流动相中的全氟酸(三氟乙酸、五氟丙酸、七氟丁酸等)对质谱仪的污染问题。随后,袁耀佐等[38-40]又采用同样的方法分别解析了硫酸依替米星中13个杂质结构、硫酸奈替米星中7个杂质结构及硫酸西索米星中14个杂质结构。于敏等[41]采用HPLC-MS以甲酸-甲醇为流动相体系测定了庆大霉素C组分含量及各组分响应因子。
虽然运用质谱分析氨基糖苷类抗菌药物及其杂质的结构方法比较成熟,但离子色谱-质谱联用测定此类药物却才刚刚起步。ZoltanSzabo[42]等报道了离子色谱-脉冲安培检测器-轨道阱高分辨率质谱联用技术应用于糖及糖蛋白中释放的原生聚糖的分析。该方法的流动相中含有无机盐、一定比例的有机相及强碱,其在离子色谱与质谱的雾化器间加入抑制器来实现在线除盐,消除流动相中盐及强碱对质谱离子源的影响及质谱部件的损害,并通过柱后分流装置,降低进入质谱中流动相的流速,以适合于质谱分析。此外,离子色谱-质谱联用仪原理比较复杂、操作技术要求较高、价格昂贵、日常维护保养成本高,一定程度上限制了其在各国药典领域的普及应用。
目前,一些机构正在研究离子色谱-质谱联用测定氨基糖苷类抗菌药物,相信随着这项技术的不断发展及研究人员的不懈努力,不久将会有这方面的研究成果,该技术将会对我国的药物分析研究起着较大的推动作用。
| [1] |
杭太俊, 于治国, 范国荣. 药物分析[M]. 第8版. 北京: 人民卫生出版社, 2016: 394-396.
|
| [2] |
吴燕, 郭成明, 袁雯玮. 氨基糖苷类抗生素分析方法进展[J]. 天津药学, 2005, 17(1): 46-48. DOI:10.3969/j.issn.1006-5687.2005.01.025 |
| [3] |
王舒, 高永良. 氨基糖苷类药物研究新进展[J]. 解放军药学学报, 2009, 25(4): 329-333. |
| [4] |
诸玲玲, 孟现民, 张永信. 氨基糖苷类药物的发展历程[J]. 上海医药, 2011, 32(7): 322-326. DOI:10.3969/j.issn.1006-1533.2011.07.004 |
| [5] |
牟世芬, 刘克钠, 丁晓静. 离子色谱方法及应用[M]. 第2版. 北京: 化学工业出版社, 2005: 8-15.
|
| [6] |
牟世芬, 朱岩, 刘克钠. 离子色谱方法及应用[M]. 第3版. 北京: 化学工业出版社, 2018: 38-39, 186-196.
|
| [7] |
袁耀佐, 张玫, 胡昌勤, 等. 氨基糖苷类抗生素组分控制进展[J]. 中国药学杂志, 2017, 52(20): 1772-1779. |
| [8] |
British Pharmacopoeia Commission. The British Pharmacopoeia[S]. 2002(Ⅱ): 1305-1307, 1967-1968.
|
| [9] |
European Directorate for the Quality of Medicines. European Pharmacopoeia 4.0[S]. 2002(Ⅱ): 1223-1224, 1620-1621, 1623-1624, 1967-1968.
|
| [10] |
The United States Pharmacopoeial Convention. United Stated Pharmacopoeia[S]. 36th Edition, 2013(2): 3720-3721.
|
| [11] |
British Pharmacopoeia Commission. The British Pharmacopoeia[S]. 2012(Ⅰ): 124-127, 994-996.
|
| [12] |
European Directorate for the Quality of Medicines. European Pharmacopoeia 7.0[S]. 2011(2): 1367-1369, 2091-2092.
|
| [13] |
国家药典委员会.中华人民共和国药典: 二部[S].北京: 中国医药科技出版社, 2010.
|
| [14] |
The United States Pharmacopoeial Convention. United Stated Pharmacopoeia[S]. 25th Edition, 2002: 106-107, 973-974.
|
| [15] |
国家药典委员会.中华人民共和国药典: 二部[S].北京: 中国医药科技出版社, 2015: 1343-1346.
|
| [16] |
WU Y N, ZHAO W, ZHU X Y, et al. Improved Liquid Chromatography Combined with Pulsed Electrochemical Detection for the Analysis of EtimicinSulfate[J]. J Sep Sci, 2015, 39(8): 1471-1479. |
| [17] |
British Pharmacopoeia Commission. The British Pharmacopoeia[S]. 2003(Ⅰ): 848-849, 863-865, 1308-1310, 1847-1848.
|
| [18] |
British Pharmacopoeia Commission. The British Pharmacopoeia[S]. 2017(Ⅱ): 365-366, 1092-1094, 1098-1100.
|
| [19] |
European Directorate for the Quality of Medicines. European Pharmacopoeia 9.0[S]. 2017(3): 2573-2574, 3136-3138, 3799-3800.
|
| [20] |
European Directorate for the Quality of Medicines. European Pharmacopoeia 5.0[S]. 2005(2): 1653-1654, 2588-2590.
|
| [21] |
刘英, 王立萍. 庆大霉素质量标准变迁对庆大霉素质量的影响[J]. 药物分析杂志, 2014, 34(2): 207-214. |
| [22] |
British Pharmacopoeia Commission. The British Pharmacopoeia[S]. 2011(Ⅰ): 992-993.
|
| [23] |
European Directorate for the Quality of Medicines. European Pharmacopoeia 7.5[S]. 2012: 4639-4640.
|
| [24] |
王立萍, 李少杰, 刘英. 注射用盐酸大观霉素有关物质两种测定方法的比较[J]. 中国药学杂志, 2017, 32(20): 1786-1791. |
| [25] |
British Pharmacopoeia Commission. The British Pharmacopoeia[S]. 2007(Ⅱ): 1933-1935.
|
| [26] |
European Directorate for the Quality of Medicines. European Pharmacopoeia 6.0[S]. 2008(2): 2947-2951.
|
| [27] |
汪复. 氨基糖苷类抗生素的研究进展[J]. 中国临床药理学杂志, 1991, 7(3): 148. |
| [28] |
British Pharmacopoeia Commission. The British Pharmacopoeia[S]. 2013(Ⅰ): 128-133.
|
| [29] |
European Directorate for the Quality of Medicines. European Pharmacopoeia 8.0[S]. 2014(Ⅱ): 1535-1537.
|
| [30] |
The United States Pharmacopoeial Convention. United Stated Pharmacopoeia[S]. 27th Edition. 2004: 1725-1726.
|
| [31] |
XI L L, WU G F, ZHU Y. Analysis of Etimicin Sulfate by Liquid Chromatography with Pulsed Amperometric Detection[J]. J Chromatogr A, 2006, 1115(1-2): 202-207. DOI:10.1016/j.chroma.2006.02.093 |
| [32] |
Shruti C, Geert V, Jos H, et al. Comparative Study on the Analytical Performance of Different Detectors for the Liquid Chromatographic Analysis of Tobramycin[J]. J Pharm Biomed Anal, 2010, 53: 151-157. DOI:10.1016/j.jpba.2010.02.032 |
| [33] |
The United States Pharmacopoeial Convention. United Stated Pharmacopoeia[S]. 37th Edition. 2014(2): 3138-3139.
|
| [34] |
国家药典委员会.中华人民共和国药典: 二部[S].北京: 中国医药科技出版社, 2005: 28-30.
|
| [35] |
周茂金, 钟大放, 孙玉明, 等. 8种氨基糖苷类抗生素的电喷雾离子阱质谱[J]. 药学学报, 2004, 39(10): 826-830. DOI:10.3321/j.issn:0513-4870.2004.10.013 |
| [36] |
杨利红, 胡昌勤, 刘文英. 14种氨基糖苷类抗生素质谱分析[J]. 药物分析杂志, 2006, 26(8): 1050-1057. |
| [37] |
袁耀佐, 谭力, 张玫, 等. HPLC-ESI-IT-MSn法快速推定硫酸小诺霉素中有关物质的结构[J]. 药学与临床研究, 2010, 18(1): 31-37. DOI:10.3969/j.issn.1673-7806.2010.01.008 |
| [38] |
袁耀佐, 张玫, 钱文, 等. 高效液相色谱电喷雾离子阱质谱法推定硫酸依替米星中有关物质的结构[J]. 分析化学, 2010, 38(6): 817-822. |
| [39] |
袁耀佐, 张玫, 钱文, 等. 高效液相色谱电喷雾离子阱质谱法快速推定硫酸奈替米星中有关物质的结构[J]. 中国药学杂志, 2010, 45(18): 1428-1433. |
| [40] |
袁耀佐, 赵恂, 张玫, 等. 应用HPLC-ESI-IT-MSn法推定硫酸西索米星中有关物质的结构[J]. 药物分析杂志, 2011, 31(7): 1288-1295. |
| [41] |
于敏, 张双庆, 李佐刚, 等. 高效液相色谱-串联质谱测定庆大霉素C组分含量及各组分响应因子[J]. 中国抗生素杂志, 2014, 39(2): 122-127. DOI:10.3969/j.issn.1001-8689.2014.02.011 |
| [42] |
Zoltan S, Janes R T, Yury A, et al. In-depth Analyses of Native N-linked Glycans Facilitated by High-performance Anion Exchange Chromatography-pulsed Amperometric Detection Coupled to Mass Spectrometry[J]. Anal Bioanal Chem, 2017, 409(12): 3089-3101. DOI:10.1007/s00216-017-0248-3 |
 2019, Vol. 33
2019, Vol. 33