2018年6月10日,国务院办公厅正式印发了《关于进一步深化“互联网+政务服务”推进政务服务“一网、一门、一次”改革实施方案》的通知,将“互联网+政务服务”作为深化“放管服”改革的关键环节,专门印发文件,作出全面部署。同时,目前政务服务“一网通办”“只进一扇门”“最多跑一次”等改革已是民之所望,改革所向[1]。为积极贯彻“互联网+政务服务”的工作思路,药品审评中心提出了构建“申请人之窗”栏目的工作需求。在“申请人之窗”栏目建设过程中,采用“数字证书+实名认证”方法,保证信息安全和严格的权限管理,实现了注册申请、审评审批全链条的信息公开和双向沟通互动等功能,提升了审评工作的信息化水平,响应了国务院、发改委、国家药品监督管理局不同层级在信息化建设中提出的“互联网+监管”“放管服”的要求。
“申请人之窗”启用以来,共计建立“申报品种一览”“审评进度查询”“临床试验默示许可”“原料药、药用辅料和药包材登记与信息公示”“结论通知”“资料提交”“沟通交流”等共计15个子栏目。目前,基本使用情况如表 1所示。
|
|
表 1 注册申请人提交情况 |
目前,“申请人之窗”已经成为药品审评工作和注册申请人必不可少的应用平台。在国家药品监督管理局发布的公告中,明确了“申请人之窗”成为官方网络平台,明确提出申请人在提出新药首次药物临床试验申请之前,应向药品审评中心提出沟通交流会议申请,药品审评中心对沟通交流会议资料进行初步审评,沟通交流会议至少提前2日提出,通过“申请人之窗”将初步审评意见和对申请人所提出问题的解答意见告知申请人[2]。在业务的办理上,《技术审评发补通知》《临床试验默示许可的通知书》的发放等业务已经全面取代了纸面邮寄,节约申请人等待的时间,优化了过程管理。《原料药、药用辅料和药包材登记与信息公示》子栏目已经实现在线填写品种基本信息[3],成功将原有的申报、受理、审评的监管模式转为备案与制剂关联审评的模式,促进了监管方式的转换。在沟通交流方面,“申请人之窗”已很好地构建了注册申请人和药品审评中心之间的信息互动平台,有效实现了惠及民生并提升申请人获得感的目标,同时维护了监管系统的良好形象。
2 在审评过程中发挥的作用和特点 2.1 系统采用实名制,保证系统用户的真实与可信在互联网环境下的信息系统建设中,对用户身份信息进行真实性认证是国家法规的要求。可靠的电子签名与手写签名或者盖章具有同等的法律效力[4]。本系统将实名身份认证作为用户注册的首要条件,全部账号都必须通过实名制审核。注册申请人必须提供有效的单位证明文件,才能激活账号,使用本系统。实名后规范了注册申请行为,使点对点的信息交互更加准确。
2.2 运用电子签名技术,确保系统信息的安全与行为合规在日益复杂的互联网环境下,依靠账号和密码的简单组合已经难以识别注册申请人登录系统时的唯一性。本系统应用了数字证书技术,注册申请人登录系统时,使用带有电子签名的Ukey进行身份识别,保证了系统用户的高度安全和真实可靠[5]。同时,明确了申请人提交的数据电文视为满足法律、法规规定的原件形式要求,从而对用户操作进行了约束和不可抵赖的认证。
2.3 加大信息公开,提升注册申请人的知情体验正是有了信息安全和加密技术的保障,“申请人之窗”栏目除了提供审评进度办理查询服务外,还增加显示了包括已登记资料查询、补充通知下载、不批准审评信息和送局结论等公示信息。注册申请人可以在第一时间通过登录“申请人之窗”获知审评状态和关键信息,摆脱了以前只能等待纸面资料寄送的被动局面,保护了注册申请人的知情权,极大地提升了用户使用体验,将监管服务落到了实处[6]。
2.4 实现申报资料电子提交,提高审评审批质量和效率为加大审评审批过程中电子资料的利用,减轻注册申请人提交资料的负担,“申请人之窗”栏目已实现了技术审评过程中所需要的大部分资料的电子化提交,包括质量标准、说明书、包装标签、综述资料、临床试验登记、优先审评审批申请和关联原料、辅料和包装材料备案等。电子化提交模块的设置充分发挥了信息管理电子化的优势,使注册申请人无需再频繁递交各种纸面资料,缩短了资料提交的时间,也方便了审评人员电子资料的利用,大幅提高了药品审评中心的工作效率[7]。
2.5 通过实名制,实现对药品注册申请人的大数据分析通过申请人的申报情况、药品审评中心的审评进度、双方的沟通交流及审评审批情况,可分析企业的研发能力;通过企业访问“申请人之窗”栏目的情况,分析申请人对药品审评中心业务的关注度;通过企业访问“申请人之窗”的频率、人数,分析企业的活跃度等。
3 应用情况 3.1 概述目前,美国FDA、欧盟EMA和日本厚生省等国外先进监管机构的信息化发展都早于我国,并且都有着完善的信息共享、电子申报的举措[8]。比如美国药品审评和研究中心就在其网站上积极披露药品正式审批结论信息,包括已批准药品的监管记录、含某特定活性成分的药品、某品牌药的仿制药或替代治疗药品信息等[9]。但受监管制度和管理模式的影响,目前,各个监管机构尚未建立像我国这样的集中信息化平台,药品审评中心正是充分吸取国外先进监管机构的经验,结合国内药品监管特点,设计出了适合我国国情的“申请人之窗”应用[10]。
“申请人之窗”的访问地址为https://wbca.cde.org.cn/wbca/,或通过药品审评中心网站http://www.cde.org.cn/,从右侧登录窗口登录后进入,如图 1所示。
|
图 1 申请人之窗 |
1)用户实名注册的流程如下。
2)注册申请人填写信息进行账号注册;系统将申请人所填写的内容自动生成注册账号申请表,注册申请人须打印注册账号申请表并准备申请表中要求的其他证明材料。纸质资料需要每页加盖单位公章,授权委托书须法定代表人签字或加盖法定代表人个人印章,并加盖单位公章。
3)申请人提交纸质资料至药品审评中心;“申请人之窗”栏目的工作人员对材料进行审核,对正确无误的账号进行激活操作。
4)用户注册时需要填写的信息,如图 2所示。
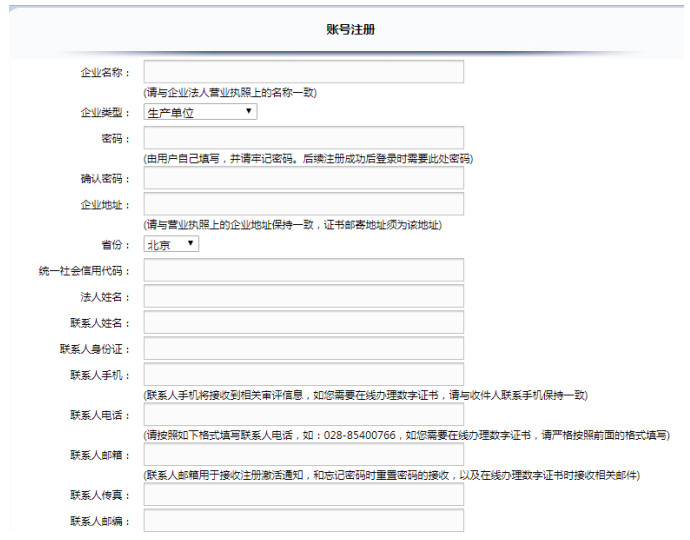
|
图 2 用户注册需要填写信息 |
为满足注册申请人的需求,系统设置了子账号管理功能,子账号在公司账号权限之下,由公司账号对其进行权限二次分配。注册申请人可以自行增加子账号并对其进行管理。子账号维护界面如图 3所示。

|
图 3 子账户维护界面 |
品种信息查询以直观的图形化方式对审评进度进行展示,并将和该注册品种相关联的任务调整、已提交资料、电子提交、发布通知、审评结论和评价信息等按标签集中在同一个界面,便于注册申请人直观地掌握审评进度。
3.4 品种信息查询品种信息查询如图 4所示。
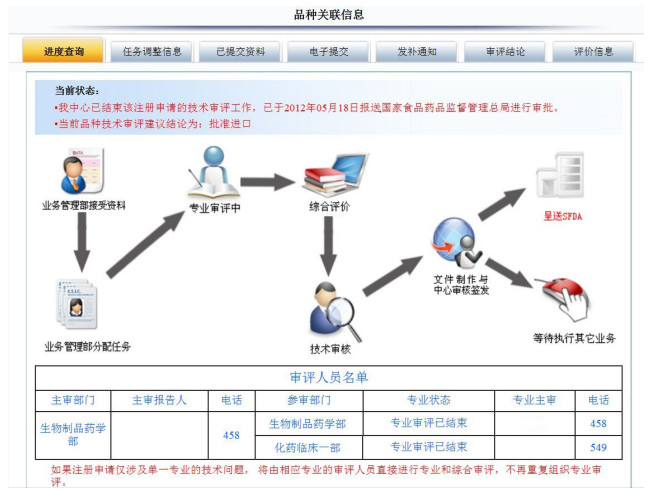
|
图 4 品种信息查询 |
注册申请人可对在审品种进行电子资料提交,格式为word文件(2003版),包括各类综述资料、工艺信息、质量标准说明书等。电子提交部分界面示意说明,如图 5所示。
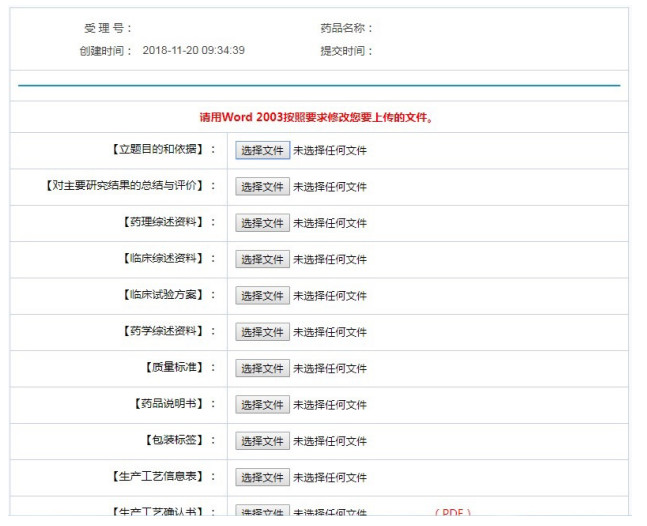
|
图 5 电子提交部分界面示意说明 |
注册申请人可以在“申请人之窗”中进行优先审评审批申请、原辅包关联审评申请和药物警戒XML/CIOMS表的提交等。优先审评审批申请表样式如图 6所示。

|
图 6 优先审评审批申请表模板 |
为便于注册申请人与审评人员进行沟通交流,药品审评中心在“申请人之窗”设置了沟通交流功能,内容包括提出沟通交流会议申请、提出一般性咨询问题和问询式沟通交流。同时,药品审评中心工作人员也可以利用此功能对申请人提出的沟通交流会议申请进行查询[11]。注册申请人提出的沟通交流预约咨询申请表样式,如图 7所示。
|
图 7 注册申请人提出的沟通交流预约咨询申请表模板 |
保证信息系统的安全,是开展各项政务服务的基础。想要达成信息系统安全,要求有关部门战略上高度重视,技术上敢于创新,运行中严格执行安全规范。在当今互联网复杂环境下,首先,应采用各种专业安全手段,严格杜绝“网络黑客”的非法攻击;其次,在信息系统技术选型及构建时,一定要把用户实名制以及信息安全作为首要前提;再次,为保障信息的长效安全,还需要定期对网络、主机、应用等方面进行安全性测评,针对可能存在的安全隐患进行预防性和针对性检查,及时消除系统信息的安全隐患,夯实“互联网+政务服务”的基础[12]。
4.2 进一步加强信息化技术的利用,促进审评工作效率提升药品审评中心通过“申请人之窗”栏目的运行,不仅优化了注册申请人的使用体验,缩短了审评周期,也大幅提升了技术审评的工作效率,增加了注册申请审评完成的数量,为各类注册申请按照规定时限审评提供了必要的支撑[13]。“申请人之窗”利用先进信息化技术,实现了审评资料的电子化提交,审评流程的规范化展示,以及沟通交流信息的电子化预约和记录存储。药品审评中心未来将进一步创新信息技术的应用,对海量的审评数据进行分析、整理和挖掘,努力实现智能化审评的宏伟目标[14]。
4.3 通过加大信息公开的力度,降低廉政风险通过“申请人之窗”的进度查询栏目,注册申请人可以随时获知申报产品的审评状态,包括各个专业的审评进度、审评结论以及对应的审评人员[15]。在对申报产品做出不批准结论时,也同时公示相应的审评报告,阐明不批准理由,并同时开通注册申请人申述的渠道。注册申请人通过沟通交流栏目和相应审评员之间沟通的全部内容,也都留底备查。通过以上信息公开的手段,充分减少了信息不对称带来的误解,加大了信息公开带来的外部监督,将审评过程置于“阳光”之下,约束了自由裁量权,降低了廉政风险。
| [1] |
国务院.国办发〔2018〕45号国务院办公厅关于印发进一步深化"互联网+政务服务"推进政务服务"一网、一门、一次"改革实施方案的通知[S]. 2018.
|
| [2] |
国家食品药品监督管理总局2018年第50号关于调整药物临床试验审评审批程序的公告[S]. 2018.
|
| [3] |
国家食品药品监督管理总局2017年第146号总局关于调整原料药、药用辅料和药包材审评审批事项的公告[S]. 2017.
|
| [4] |
中华人民共和国主席令第十八号中华人民共和国电子签名法[S]. 2004.
|
| [5] |
陈为, 李健. 药品检验机构质量管理工作的信息化建设[J]. 中国药事, 2013, 27(8): 807-811. DOI:10.3969/j.issn.1002-7777.2013.08.008 |
| [6] |
董江萍, 孙利华, 马坤, 等. 美国食品药品监督管理局药品审评和研究中心公共共享信息披露的分析和启示[J]. 中国药事, 2007, 21(8): 645-646. |
| [7] |
新华网.国家食品药品监督管理局政府网站全新改版一信息更丰富、查询更便捷[EB/OL].(2013-01-07)[2019-01-15]. http://news.xinhuanet.com/p01ilics/2013-0I/07/c-124199335.htm.
|
| [8] |
廖淑雯, 陈永法, 邵蓉. 中美药品监管信息公开制度比较[J]. 中国执业药师, 2010(5): 38-39. DOI:10.3969/j.issn.1672-5433.2010.05.013 |
| [9] |
宋华琳. 美国FDA药品信息公开的评介与思考[J]. 中国处方药, 2007(63): 35-36. |
| [10] |
黄瀚博, 杨世民. 中美药监部门政务网站信息化建设比较研究[J]. 中国药事, 2017(10): 1113-1122. |
| [11] |
张欢之. 发挥政府网站对药品安全性信息沟通的作用:以美国FDA网站为例[J]. 中国处方药, 2008(8): 48. |
| [12] |
陆颖, 补世明, 陈峰. 美国FDA医疗器械监管信息化情况及启示[J]. 中国医药导刊, 2017(11): 1250-1252. DOI:10.3969/j.issn.1009-0959.2017.11.044 |
| [13] |
USFDA.Createa Medical Device Certificate Application(CFG) Step-by-Step Instructions[EB/OL]. (2016-04-11)[2019-01-15]. HTTPs://www.access.fda.gov/cecals/help/CreateApplecation.html.
|
| [14] |
USFDA. Medical Device Dalabases[EB/OL].(2017-09-19)[2019-01-15]. HTTPS://www.fda.gov/medicaldevices/deviceregulation-andguidance/databases/default.htm.
|
| [15] |
国家食品药品监督管理总局.局令第28号药品注册管理办法[S]. 2017.
|
 2019, Vol. 33
2019, Vol. 33 
