2. 河南省口岸食品检验检测所, 郑州 450018;
3. 国家药品监督管理局食品药品审核查验中心, 北京 100044
2. Food Inspection and Testing Institute of Henan Province, Zhengzhou 450018, China;
3. Center for Food and Drug Inspection of NMPA, Beijing 100044, China
血液制品是高风险管理产品,我国在《中华人民共和国药品管理法》(以下简称《药品管理法》)、《药品生产监督管理办法》的基础上,为强化血液制品的监管,相继出台了《血液制品管理条例》《生物制品批签发管理制度》《单采血浆站管理条例》等法律法规。《药品生产质量管理规范》(GMP)2010年版针对血液制品制定了血液制品附录,按照原国家食品药品监督管理总局的要求,血液制品生产企业应当于2013年12月31日前通过新修订的GMP,如逾期未通过认证,自2014年1月1日起,所有血液制品生产企业均不得生产[1]。
本文就2015-2018年笔者参与的37家(次)血液制品生产企业跟踪、认证检查中发现的缺陷情况进行分析评价,并提出相应对策建议。
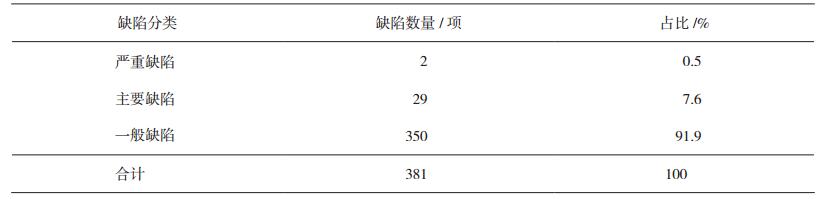
1 2015-2018年部分血液制品企业GMP现场检查缺陷汇总分析 1.1 缺陷项汇总37家次企业共发现缺陷381项,按照风险等级分:严重缺陷2项,占比0.5%;主要缺陷29条,占比7.6%;一般缺陷350项,占比91.9%。见表 1。
|
|
表 1 缺陷等级分类表 |
从表 1可以看出,在通过GMP认证的企业中,严重缺陷及主要缺陷依然占有一定的比例,说明企业在实施GMP过程中依然存在较大的管理漏洞或者缺陷。
按缺陷类别分,381项检查缺陷中,共涉及GMP正文13个章节中的10个章节,具体情况见表 2。
|
|
表 2 GMP各章节缺陷数量分部表 |
由表 1可以看出,近几年来血液制品生产企业药品GMP检查中,虽然大部分缺陷为一般缺陷(占91.9%),但是严重缺陷及主要缺陷依然占有一定的比例(占8.1%);严重缺陷及主要缺陷主要集中在生产质量管理数据不可靠性、不可追溯及验证管理不规范等几个方面的问题。数据不可靠的情形主要包括:批生产记录不真实,检验数据、原始图谱不可追溯等,如“批生产记录不真实,不具可追溯性。在检查组进入某企业生产车间时,现场正在生产某批次的人纤维蛋白原,生产现场未能提供该批批生产记录;包装岗位存在两套记录台账,手工台账与批生产记录显示的两者数据不完全一致。”验证不规范的情形主要包括:未按照要求进行定期验证,验证方案设计不合理,验证内容不完整、验证方报告不完善等,如“巴氏病毒灭活验证系统性能确认方案(PQP-SIA-FLCJ-034-0)缺少病毒灭活罐的温度分布和温度控制系统的确认内容;部分检验仪器性能确认不完整,如未对HPLC(Waters1525型)及其所连接的示差折光检测器及紫外检测器验证用的色谱柱进行性能确认;未对个别检验方法进行验证,如人血白蛋白纯度测定用电泳测定仪(意大利Interlab)为琼脂糖介质,未与《中华人民共和国药典》醋酸纤维膜法进行一致性评价。”这些问题的存在,表明企业在这些系统方面存在较大漏洞,可能会引起较大的产品质量风险。
由表 2可以看出,按照GMP章节来分,缺陷比较集中的章节主要有质量控制与质量保证、文件管理、生产管理、设备等,均占总缺陷数量的10%以上,说明企业在实施GMP过程中,质量体系运行不够完善,生产设备不符合要求,文件体系不够健全,生产管理不严格等诸多问题。如生产现场操作不够规范,标识不清晰,设备未及时维护保养,批生产记录未及时记录,文件未及时更新等。
上述问题存在的原因有多种情况,大致有以下3种情形:一是企业对药品GMP理解不到位,学习不深入,执行有偏差,导致企业实施GMP的水平大打折扣;二是企业考虑实施GMP的成本过高,而采取降低标准实施的情形,存在在检查过程中应付、敷衍了事,甚至企图蒙混过关的情形;三是企业主动采取措施规避GMP的要求,主观故意抵制。
2 我国血液制品生产企业实施GMP现状 2.1 实施GMP主动意识不强我国GMP颁布30多年来,药品生产企业的生产质量管理体系已经基本建立,但是部分企业实施GMP仍停留在被动实施阶段。如果仅依靠国家强制的法律法规及高压政策,使药品生产企业不得不按照GMP要求规范生产行为是不稳定的,企业实施GMP的状况会有较大波动。
部分企业主动学习法律法规意识不强,国家监管部门推出的法规及相关政策,部分企业没有积极主动学习,监管部门来进行监督检查时,提出相应缺陷后,企业才开始去学习,继而进行整改,这种方式在大多数企业普遍存在。例如原国家食品药品监督管理总局颁布的GMP计算机化系统、确认与验证、生化药品等附录,部分企业尚未开始相关的学习和培训工作。
2.2 GMP的精髓尚未渗透到药品生产企业中从现场检查的缺陷可以看出,部分药品生产企业依然存在应付检查的情况。每次认证检查以通过检查为最终目标。认证检查之前突击学习、充电,不惜重金聘请专业人员现场指导、培训、建立文件体系、完善相关记录、按照GMP的要求逐条核对,以确保顺利通过。部分企业抵触实施GMP的原因是实施GMP会提高成本,例如建立质量保证体系需要增加人力资源成本;新建厂房、购置符合要求的设备、添置足够满足生产需要的冷库等,都会增加企业成本,故而不愿意严格按照GMP的要求开展生产。
2.3 GMP法律地位不高,企业违反GMP成本低我国现行的《药品管理法》第九条规定:“药品生产企业必须按照国务院药品监督管理部门依据本法制定的《药品生产质量管理规范》组织生产” [2],对于违反GMP的罚则规定不明确。对于违反GMP的处罚,目前,国内大多数采用暂扣GMP证书的形式,企业整改后提交整改报告,监督管理部门返还其GMP证书,很少有立即吊销其GMP证书或者吊销药品生产许可证甚至药品批准文号等严厉的措施,也鲜有对药品生产关键人员实施资格罚的情形。而在美国的GMP中明确规定“凡是在药品生产、加工、包装或贮存过程中存在任何不符合本部分及21CFR 211—226部分中陈述的法规的药品,依据联邦食品、药品及化妆品法501(a)(2)-(B),该药应被视为劣药,同时导致该事故发生的负责人应受相应的法规的制裁。” [3]
3 关于血液制品企业监管思路建议血液制品不同于其他药品,其原料为血浆,血浆中有潜在的病毒感染风险[4],可能会污染到产品,所以生产过程中就要求企业严格按照批准的工艺组织生产;同时,原料血浆中有丰富的营养,很适宜微生物的生长,生产过程中产品极易被微生物污染,所以血液制品生产企业更应当严格实施GMP。
3.1 严格落实企业主体责任,加强法律法规培训,增强员工守法意识药品不同于普通商品,药品能够诊断、治疗、预防疾病,但是如果药品本身质量出现问题,不但不能治疗疾病,还能导致病人出现其他疾病甚至危及生命,所以药品是否安全有效,关系到老百姓的切身利益。由于公众对食品药品安全的零容忍态度,保证药品安全有效也是重大民生。
新修订GMP中明确规定,药品生产企业应“坚持诚实守信,禁止任何虚假、欺骗行为”,对于企业不诚信,在生产质量管理过程中涉嫌造假的,应依法从重处理。随着新修订GMP的逐步推进,企业诚信水平及质量管理理念均有大幅度提升。但是在现场检查中,发现依然有个别企业不够诚信,向检查组提供的检验数据或批生产记录不真实,涉嫌伪造数据。所以,药品监管部门应加大法律法规的培训,强化药品生产企业是质量第一责任人的责任意识,提高药品生产企业风险意识,增强法制观念,使药品质量从生产源头得到有效保证;同时也应当加大违法违规案件的处理,从而督促生产企业保证产品质量。
3.2 取消GMP认证制度,加大检查力度我国目前现行的GMP认证检查制度规定每5年认证一次,企业在证书效期前6个月提出申请,上报GMP认证资料,现场检查合格后,发给GMP证书[5]。这种认证方式的弊端是企业过多注重认证前的准备,认证之后企业管理水平大幅度下降,GMP管理没有与实际生产有机结合。企业为了应付检查而实施GMP,现场检查时的情况不能代表企业的真实水平,在实际监管中经常出现企业刚刚通过GMP认证,便在飞行检查中被发现存在严重违反GMP的情况而被收回证书。因此,这种强制的周期性认证检查模式不能反映出企业的真实水平,也不便于监管部门发现问题,给药品质量的安全带来潜在风险。建议国家药品监管部门尽快完善相关法规,取消现有的认证检查模式,采取GMP认证和《药品生产许可证》检查合并进行;同时加大跟踪检查、飞行检查及日常监督检查力度,及时发现企业存在的问题,防止药品质量安全事故的发生,从而提高企业实施GMP水平,保证药品安全有效。
3.3 完善GMP的法律地位,加大违法的处罚力度我国现行的《药品管理法》规定“药品生产企业必须按照国务院药品监督管理部门依据本法制定的《药品生产质量管理规范》组织生产。药品监督管理部门按照规定对药品生产企业是否符合《药品生产质量管理规范》的要求进行认证;对认证合格的,发给认证证书。”但是,法规中未明确规定药品生产企业违反GMP,应当按照假药或者劣药进行处罚,对未按照GMP实施的企业采取的行政处罚力度不够,导致对违法的打击力度不足。同时,执行GMP检查的检查员法律定位也未明确。GMP认证是一项行政许可事项,属于行政执法的范畴,所以,GMP检查员应当是行政执法人员。由于检查员的法律地位不明确,也弱化了GMP的实际执行效果。因此,应当加快修订相关法规,明确GMP的法律地位,加大日常监督的执法力度,从而督促企业严格按照GMP要求组织生产和质量管理活动,提高产品质量,保证药品安全有效。
| [1] |
国家食品药品监督管理总局.国食药监安[2011]101号关于贯彻实施〈药品生产质量管理规范(2010年修订)〉的通知[S]. 2011.
|
| [2] |
中华人民共和国主席令第45号中华人民共和国药品管理法[S]. 2001.
|
| [3] |
21 CFR 210/211-Drug GMPs-The Complete Regulations for Drug Products[S]. 2018.
|
| [4] |
国家食品药品监督管理总局.局令第39号生物制品批签发管理办法[S]. 2017.
|
| [5] |
国家食品药品监督管理局.国食药监安[2011]365号药品生产质量管理规范认证管理办法[S]. 2011.
|
 2019, Vol. 33
2019, Vol. 33