欧洲官方药品质量控制实验室联盟(Official Medicines Control Laboratories,OMCL)由欧盟委员会和欧洲理事会于1994年5月26日发起成立。该联盟旨在建立一种人用药和兽用药质量控制的新型合作模式。1995年,联盟的秘书处开始设在欧洲药品质量管理局(European Directorate for the Quality of Medicines,EDQM)。在秘书处的统一协调下,每个成员实验室,按照不同的职责和分工,在实验室质量管理体系、能力验证、打击假药、上市后药品质量监督检验等方面开展工作和合作交流。
OMCL联盟的主要职责是开展欧盟各成员国官方实验室检验机构的互认,通过网络、工具书和信息技术的手段加强交流,协调各官方实验室之间的活动,通过执行统一的质量管理体系来统一工作方法(如:加强能力验证项目和同行评估),开展工作项目信息交换来优化专家资源、实验室资源和分析数据的使用,组织分析方法验证的合作研究,促进信息和工作成果共享和建立标准物质。
1 联盟的成员联盟的成员分为三类,分别是正式成员(full members)、准成员(associated member)和有限制条件的成员(limited members)。
1.1 正式成员正式成员有三个前提条件:一是必须是欧洲委员会成员国;二是必须是欧洲药典成员国,三是符合联盟规定的特定“资质和条件”中的相关要求。满足以上三个条件的国家官方药品质量控制实验室在理论上都有资格成为正式成员。在提交申请后,最终由联盟顾问小组来审批成员资质。
1.2 准成员欧洲委员会成员国中是欧洲药典观察员国的,并且符合“资质和条件”中的相关要求的国家的官方药品质量控制实验室都有资格成为准成员。在提交申请后,最终由联盟顾问小组来审批成员资质。
在某些特殊情况下,对于所有签署了欧洲药典协议的欧洲委员会成员国的国家实验室,如果没有满足“资质和条件”中的某些特定条件(比如国家相应的监管机构不负责公众健康和动物健康事务等情况),联盟顾问小组根据具体情况来判断该实验室是否能够成为准成员。
1.3 有限制条件的成员如果某个正式成员或者准成员由于没有遵守第四章中有关资质保持的要求,那么这个正式成员或者准成员就降格为有限制条件的成员。
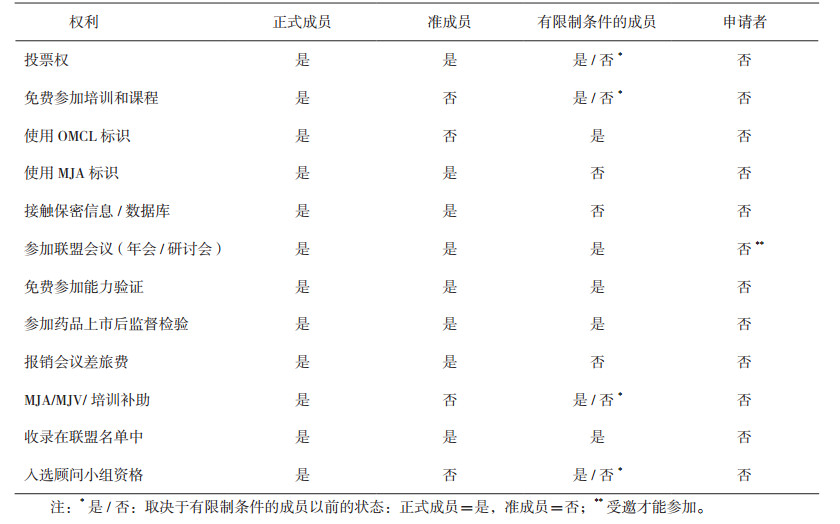
2 成员享有的权利联盟中,不同级别的成员实验室享有不同的权利,见表 1。
|
|
表 1 不同级别成员享有的权利 |
联盟进行的业务工作主要分为三大部分:一是基础工作,二是工作组工作,三是专项工作(见图 1)。
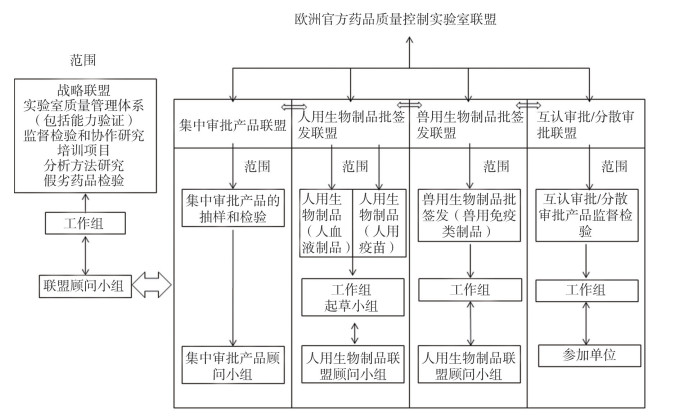
|
图 1 欧洲官方药品质量控制实验室联盟职能 |
联盟基础工作包括:实验室质量管理、理化和生物检测能力验证、上市后药品监督抽验等。
3.1.1 实验室质量管理[1]早在1997年,联盟就开始进行实验室质量管理工作。由于各实验室之间越来越多的进行检验结果的交流和共享,包括生物制品批签发的检验结果和特殊药品(管控药品)的检验结果,当时工作目的是在联盟所有成员实验中建立统一的实验室质量管理体系,起草共同的实验室质量管理文件和指导原则。从1999年以后,这项工作进一步加强,联盟决定制定工作机制和采取特定的方式方法,保证全联盟质量管理体系的协调一致、正常运行和维持。后来,联盟的质量管理体系与ISO 17025的标准进行了接轨。
联盟在实验室质量管理体系方面的工作机制和方式主要有以下几种:
1)实验室间相互技术支持(Mutual Joint Visit,MJVs)
这项工作由EDQM组织,目的是给成员实验室提供技术支持,帮助他们提高实验室质量管理水平和落实实验室质量管理要求。
2)实验室间相互评审(Mutual Joint Audits,MJAs)
实验室间相互评审由联盟内部成员实验室中经过实验室质量管理体系专门培训的专家来承担。他们主要检查成员实验室是否符合ISO 17025、联盟实验室质量管理体系指导原则以及欧洲药典的要求。实验室间相互评审定期进行。
3)培训
对成员实验室检验人员进行现场培训和课堂培训,培训的内容主要是检验检测技术能力和实验室质量管理体系。
4)质量管理指导原则
成员实验室的专家起草了联盟实验室质量管理指导原则。主要目的是帮助成员实验室在药品检验检测领域贯彻落实ISO 17025对质量管理体系的要求。原则上讲,联盟推荐成员实验室采纳使用这些指导原则,但没有法律约束力。
自1997年以来,全联盟一共起草发布了39个技术指导原则,涵盖人员培训、仪器设备验证、方法学确认、检验结果评估与风险、数据真实性等各个质量管理体系环节,这些技术文件在实际工作中发挥了极其重要的作用,不但为全联盟实验室建立统一可靠并持续改进的质量管理体系提供了文件基础和指导意见,而且为全世界药品质量控制实验室提供了借鉴和技术指导。
过去20年,联盟在实验室质量管理方面开展了很多具体工作并取得了很多实质性成效。2018年,全联盟组织了18次MJA和3次MJV,EDQM组织召开了计算机化系统和数据真实性培训班,并且增修订了原子吸收分光光度计验证指导原则、气相色谱仪验证指导原则、文件管理和记录指导原则、样品管理指导原则等共8个技术指导原则。
1997年以来,全联盟一共组织了145次MJA和25次MJV,以及22次现场/课堂培训,这些质量检查和培训活动为保证全联盟质量管理体系的统一一致和持续改进发挥了重要作用。
另外一个重要事件是联盟与欧洲认可合作组织(the European co-operation for Accreditation,EA)的关系与合作近年来取得突破性进展。2013年,EA承认联盟在实验室质量管理体系建设中发挥的作用的现实地位,联盟被EA接受为“认可的伙伴(recognised stakeholder)” [2],这一决定旨在为今后双方进一步合作、信息共享和互相接受实验室评审结果铺平道路。2017年,EA在其官方网站上发布了EA和EDQM的一份共同文件:EA-EDQM关于在欧洲官方药品质控实验室开展联合审评的意见[3]。该文件具有里程碑意义,标志着EA同意双方联合开展药品质控实验室评审、认可联盟的质量管理体系文件和认可联盟的检查结果。
3.1.2 理化和生物检测能力验证[4]除了进行实验室质量管理体系建设和起草技术指导文件外,联盟还在秘书处的牵头组织下,开展能力验证活动,包括理化检测能力和生物检测能力。最初设立能力验证工作的目的是考察联盟内部成员实验室能够正确实施欧洲药典收载的理化和生物检测方法并保证检验结果准确可靠的能力。后来这个项目扩展到全球各地的药检实验室都可以申请参加,联盟内部实验室免费参加,非联盟实验室需要付费参加。EDQM按照ISO/IEC 17043:2010的标准每年定期组织开展实验室能力验证活动,涵盖的范围包括药典收载的基本检验能力,包括溶出度、紫外、高效液相色谱、气相色谱、滴定法等。
2017年,EDQM组织了5项理化检测能力验证活动,每项能力验证全球范围内平均有98家药品检验实验室参加,除了联盟实验室外,还包括生产企业质控实验室、大学实验室、医药行业协会实验室等。另外,还组织了5项生物检测能力验证,平均有18家实验室参加。
3.1.3 上市后药品监督抽验[5]在EDQM的协调下,联盟实验室每年还承担上市后药品监督抽验的工作。重点对原料药、膳食补充剂中非法添加增强性功能化学药和药品中非法添加违禁物进行监督抽验。
4 联盟成员申请申请时,每个申请实验室需要填写一个标准化的实验室信息调查表[6-7],然后由申请实验室的上级主管部门提出正式申请。填写完毕的表格和正式申请提交给联盟的秘书处,也就是EDQM。对于新申请的国家,其申请的OMCL实验室个数不得超过三个,分别涵盖化学药品实验室、生物制品实验室和兽用药品实验室。
联盟顾问小组和秘书处对递交的申请材料进行审核,判断实验室的条件是否满足要求。在审核完成之后,EDQM会告知申请实验室审核结果。如果实验室的条件满足要求,还要通知实验室授予的资质是正式成员还是准成员。
联盟采用不同方式对成员资质进行定期监督检查[8]。这些方式包括:OMCL状态调查表、实验室质量管理体系监督检查、OMCL年度工作报告和OMCL基础信息数据库更新。如果发现有不符合要求的OMCL,将会暂停其成员资质或者降级为有限制条件的成员。
5 参加联盟活动资格 5.1 联盟成员参加联盟普通活动的资格联盟成员有资格参加与其相关的任何联盟普通活动。
5.2 联盟成员参加联盟有关欧盟法定检验活动的资格联盟中有关欧盟法定检验的活动仅限于联盟中欧盟成员国或者与欧盟签署有相关协议/合作谅解备忘录的国家参与。
5.3 联盟以外的实验室参加欧洲药品监督检验的资格在欧洲委员会成员国中,有些国家的药品监管机构的实验室有可能不在联盟成员范围之内,但这些实验室也参与了欧洲药品监督检验的工作,对于这种情况,成员国应该向EDQM保证这些实验室的质量管理体系都符合ISO 17025的标准,这些实验室在进行药品监督检验时必须要和本国的药品监管机构签署保密协议,同时要声明不存在和检验活动所涉及的利益冲突,本国的药品监管机构承担与联盟相互交流和联系的责任。
5.4 联盟以外的实验室参加联盟其他活动的资格联盟的非监督检验活动向OMCL以外的官方药品质量控制实验室开放。这些活动包括实验室质量管理体系等(比如培训和审查)。参加这些活动要缴纳一定的费用。EDQM组织的能力验证向官方实验室和私人实验室开放。OMCL以外的官方实验室和私人实验室参加能力验证活动需要缴纳费用。
6 联盟会议以下成员或单位可以注册参加联盟的会议:
1)正式成员、准成员和有限制条件成员的代表;
2)特邀专家;
3)申请加入联盟单位代表;
4)其他单位或机构的代表(比如世界卫生组织的代表),联盟有可能邀请这些单位的代表参加会议的某个特定部分以提供他们的专业知识,或者向他们通报联盟在这方面开展的有关工作。
除此之外,欧盟委员会和欧洲药品管理局(EMA)也有可能参加会议。
2)、3)、4)的参会,将由联盟顾问小组讨论决定,并正式书面通知EDQM。申请者在申请参加会议时,需要提供详细的工作总结以及对联盟的贡献。
EDQM代表欧洲委员会参加联盟的会议并承担会议秘书处的工作。联盟的工作会议一般每年召开一次。特殊情况下,秘书处可以提出需要召集会议,或者成员国三分之二的成员通过后可以召集会议。会议地点轮流在各个成员国举办。会议主席团由会议主办OMCL代表、联盟顾问小组主席和成员以及秘书处(EDQM)代表组成。每次召开会议之前,秘书处和联盟顾问小组准备会议日程和会议文件初稿并发给每个OMCL征求意见,秘书处汇总整理反馈的意见,形成讨论稿,开会之前将电子版发给每个参会人员,开会时大家对文件进行讨论通过。当对重要的议题有相反的意见时,联盟顾问小组在征求秘书处意见之后做出最终决定。一般来说,如果在会议上有人口头表达对文件有不同的意见,除非会议主席有别的想法,这个意见也只会在将来文件改版时进行考虑。
在每次召开会议时,首先应该通过会议日程。联盟的每个成员应该根据本单位的工作内容,按照OMCL非批签发工作年度工作报告模板以及OMCL批签发年度工作报告模板准备好本单位的年度工作报告,在会议开始至少2周之前将报告发给别的成员机构;会议结束后四周之内,在所有参会人员之间传阅会议报告征求意见,并按照相关程序通过报告。对于征求到的意见,将在顾问小组的下一次会议上进行讨论。
所有最终定稿的文件都要在联盟每个成员之间进行传阅,并存放在相应的网络平台上,如果有必要,将放在公开的网络上。
7 运行机制联盟工作任务由联盟顾问小组提出,在年会上讨论通过。必要时,任何成员机构也可以书面形式提议额外的工作任务。只有参会的代表超过半数时,联盟年会做出的决定才有效。任何时候,年会做出的决定只有在参会人员代表一致通过后才有效。所谓的一致通过就是说联盟内大家都达成了共识,没有任何一个成员国反对。如果某个议题大家没有达成一致协议,那么该议题就要重新进行讨论。
联盟根据文件《EDQM管理OMCL联盟文件和记录》的有关规定,在年会时对联盟的规章制度进行修订和讨论通过。联盟在年会时通过选举产生顾问小组(参见“顾问小组和其他委员会成员选举办法”)。顾问小组根据联盟的提议制定本年度联盟的工作计划,在年会上,顾问小组向大会报告本年度联盟的工作完成情况。
在联盟范围之内,根据从事的工作分工不同,有些成员还可以归类为某个特定的小组。比如欧盟集中审批许可的药品检验、审批许可互认/分散审批许可的药品的检验和人用及兽用生物制品批签发检验。这些特定小组对成员的加入有一些特定的要求,比如要求必须是欧盟成员国等。这些特定的小组在每年的年会上确定他们的工作领域和范围,在此基础上,制定下一年度的工作方案和计划。如果有需要,可以为每个特定的小组设立一个顾问小组。这些特定的小组连同他们相应的顾问小组一起制定本组的规章制度。如果没有特殊的理由,这些特定小组的年会都应在斯特拉斯堡召开,而且必须是闭门会议。
当需要起草和特定小组有关的技术文件时,需要成立一个文件起草小组,这个起草小组的成员由相关的特定小组代表和本领域相关的专家组成。文件起草好后,首先需要经过相应的顾问小组审核通过,然后再提交到特定小组年会或者全体联盟年会讨论通过。
某些情况下,对于一些所有顾问小组和联盟感兴趣的一般话题,可以在顾问小组的层面上进行讨论交流,形成一致意见后再扩大到联盟整个范围内征求意见和进一步讨论。
| [1] |
Quality Management(QM)Programme[EB/OL].[2018-10-05]https://www.edqm.eu/en/quality-management-19.html.
|
| [2] |
Complementary Mutual Joint Audits in OMCLs Accredited against ISO/IEC 17025 PA/PH/OMCL(12)1157R[EB/OL].(2014-01)[2018-10-05]https://www.edqm.eu/medias/fichiers/complementary_mutual_joint_audits_in_omcls_accredited_against_isoiec_17025.pdf.
|
| [3] |
Joint EA-EDQM Communication Regarding Cooperation when Carrying out(Joint)Audits/assessments in Official Medicines Control Laboratories[EB/OL].[2018-10-05] http://www.european-accreditation.org/publication/ea-inf-15-april--2017.
|
| [4] |
Physico-chemical and Biological PTS[EB/OL].[2018-10-05]https://www.edqm.eu/en/physico-chemical-andbiological-pts.
|
| [5] |
Market Surveillance Studies(MSS)[EB/OL].[2018-10-05]https://www.edqm.eu/en/market-surveillancestudies-48.html.
|
| [6] |
Application for New Membership to the GEON PA/PH/OMCL(09)838R[EB/OL].(2015-12)[2018-10-05]https://www.edqm.eu/sites/default/files/annex_6_geon_terms_of_reference_application_for_new_membership_november_2015.pdf.
|
| [7] |
Questionnaire to Query the OMCL Status of Present and Future Members of the GEON, PA/PH/OMCL (08) 04 R21[EB/OL].(2017-07)[2018-10-05]https://www.edqm.eu/sites/default/files/paphomcl_08_04_r21_-_annex_4_to_general_european_omcl_network_geon_terms_of_reference.pdf.
|
| [8] |
Maintenance of Membership to the GEON PA/PH/OMCL (10)93 R9[EB/OL].(2017-07)[2018-10-05] https://www.edqm.eu/sites/default/files/paphomcl_10_93_r9_-_annex_5_to_the_geon_terms_of_reference_maintenance_of_membership.pdf.
|
 2019, Vol. 33
2019, Vol. 33