在欧洲,每个国家都有本国的国家药品质量控制实验室,负责为本国政府药品监管机构提供检验检测服务和技术支撑。为了更好地进行协同和合作,发挥优势互补的作用,欧盟委员会和欧洲理事会于1994年5月26日发起成立欧洲官方药品质量控制实验室联盟(Official Medicines Control Laboratories,OMCL),将欧盟各国的官方药品质量控制实验室形成一个合作组织。1995年,联盟的秘书处开始设在欧洲药品健康管理局(European Directorate for the Quality of Medicines,EDQM)。在秘书处的统一协调下,每个成员实验室,按照不同的职责和分工,在实验室质量管理体系、能力验证、打击假药、上市后药品质量监督检验等方面开展工作和合作交流。
一个药品检验实验室想要成为OMCL成员,该实验室必须隶属于国家部委或者国家药品监管机构,或者是独立的政府实验室。如果是其他外部实验室,那么该实验室的运行经费必须由国家药品监管机构提供,而且该实验室只为政府监管机构提供检验服务。
20多年来,欧洲OMCL联盟在EDQM的组织协调下,通过联合开展能力验证、实验室质量管理体系互查互认、欧洲药典标准物质协作标定、上市后监督抽验、风险监测,以及年会和以学科为中心的各种学术研讨会等多种工作形式,实现了检验资源优化、协同加强、优势互补的全方位合作局面,为保证欧洲各国人民用药安全有效发挥了巨大作用。我国药检系统的局面结构和工作内容与欧洲OMCL联盟有很多相似之处,本文通过对欧洲OMCL联盟的管理机制进行全面的研究和介绍,以期为我国药检系统的管理和能力建设提供借鉴。
1 成为联盟成员的资质和条件为了保证每个实验室在利益冲突、公正性和保密性符合要求,欧洲各国国家药品监管机构必须保证本国的OMCL满足以下要求[1],这些要求也是成为联盟成员的必要条件:
1)实验室必须是独立的药品检验检测机构;
2)实验室的检验经费来源必须是由国家经费支持,从而保证实验室检验结果的公正性和准确性不会受到经费来源的影响;
3)每个实验对所有实验室工作人员可能的利益冲突都要进行详细的评估和说明;
4)如果实验室所在的国家属于欧盟成员,那么这个实验室在进行药品检验检测时需要遵循欧洲药典标准;
5)国家药品监管机构除了规定国家药品监管实验室在本国药品监管系统中的职责和定位外,还需要明确授权该实验室在联盟成员内部的职责和责任;
6)任何关于分包的检验检测活动,都要签署关于技术、公正性和保密性方面的协议,并且经过有关部门的批准;
7)所有实验室的质量管理体系均需要执行ISO 17025标准;
8)如果实验室不隶属于国家药品监管机构,那么该实验室的主要工作应该和联盟的主要活动相关,而且要满足OMCL主要工作职责规定。
一旦实验室被授予联盟成员资格,该实验室就要遵守联盟的各项规章制度。
2 联盟资质的保持和评估联盟包含三种成员,前两种是完全遵守联盟规章制度的正式成员和准成员,第三种是有限制条件的成员。新的申请机构在申请时需要证明其符合联盟的相关要求,现任的联盟成员有义务证明他们能够持续地保持检验检测能力,以及不存在违反联盟规章制度的情况。另外一个特别需要强调的是,各成员要定期书面说明他们的独立性和公平性[2]。
秘书处承担监督联盟成员是否严格遵守联盟规章制度并履行相关职责,以及检验检测能力和技术参数的保持情况,负责把不符合要求的成员报告给顾问小组。
2.1 联盟成员标准就维持联盟资格来说,联盟资格标准分为两个级别,即基本标准和二级标准。
2.1.1 基本标准基本标准有两个核心要素,一个是检验的公正性,另一个是检验质量和技术能力。
实验室首先必须保证检验工作的公正、没有利益冲突以及数据的保密性。另外,实验室必须要建立符合ISO 17025标准的实验室质量管理体系,并且要保证实验室具备联盟要求的检验检测能力。
以上两个标准也是保证联盟成员之间检验结果实现互认的基本条件。
2.1.2 二级标准二级标准包括:定期确认OMCL的运行状态;定期维护OMCL基本信息数据库中关于本实验室的相关信息;定期提交实验室年度工作报告;定期参加联盟的活动,比如检验工作学术交流会、派人参加专家工作组、参加联盟年会等;规定使用联盟的标识或者质量管理体系互认标识等。
2.2 不符合标准的后果不符合基本标准的结果比不符合二级标准的结果更为严重。
2.2.1 不符合基本标准的后果如果联盟成员出现了不符合独立性要求的情况,那么联盟将暂停其成员资格。在联盟年会时,大会将提出临时终止成员资格的实验室名单,并将其列入会议报告。
如果联盟成员的实验室质量管理体系或者检验检测能力不符合要求,并且在规定时间内没有完成整改,那么联盟将临时终止其成员资格。不符合标准的实验室成员身份将被降级为有限制条件的成员。在联盟年会时,大会将提出终止成员资格的实验室名单,并将其列入会议报告中。如果实验室在3年之内不能提供文件证据证明其符合ISO 17025的质量管理体系要求,那么联盟将会正式终止该实验室的联盟成员资格。
如果联盟做出了临时终止一个成员资格的决定,那么联盟规章中规定的所有权利也将同时被终止。如果联盟做出了降级一个成员为有限制条件成员的决定,那么联盟规章中规定的有关权利也将同时受到限制。
2.2.2 不符合二级标准的后果如果联盟成员出现了不符合二级标准的情况,且在规定的期限内没有完成整改,那么在联盟年会上,联盟会公布不符合的实验室和具体的不符合项。
3 监督措施 3.1 OMCL实验室信息调查表“现任成员和申请实验室信息调查表”,可以用于新的申请者提交实验室的全面信息,同时也是用于监督现任成员工作表现和状态的一个措施[3]。表中的信息包括:实验室名称、实验室代码、实验室负责人姓名和联系方式、实验室简介和基本工作介绍。对于新的申请者来说,在申请联盟成员资质时需要填写该表格,作为支持性文件的一部分。联盟的顾问小组和秘书处(EDQM)对支持性文件进行审核评估。另外,新的申请者还要提交一些材料作为这个表格的附件,包括:上年度的工作总结、实验室有资质进行的所有检验项目以及这些项目在本实验室检验的频率(每周、每月或每年)、实验室最新组织结构图、国家药品监管机构出具的书面证明(证明该实验室能够代表国家参加联盟的工作和有关活动)。最后,新申请实验室还需要填写实验室重点信息核查表(见表 1)、实验室检验工作类型调查表(见表 2)和实验室质量管理体系情况调查表(见表 3)。
|
|
表 1 实验室重点信息核查表 |
|
|
表 2 实验室检验工作类型调查表 |
|
|
表 3 实验室质量管理体系情况调查表 |
对于联盟现任的所有成员来说,至少每3年重新填写一次该表格,或者在实验室准备相关的实验室认可机构按照ISO 17025进行实验室质量管理体系检查之前,或者准备OMCL内部的互审/互查时,哪个先到按哪个进行。在此期间,如果实验室的信息没有发生变化,那么需要该实验室负责人签字确认;如果实验室的信息发生变化,则需要重新填写表格并提交;若实验室接受了OMCL互审/互查以外的外部实验室认证认可检查,那么在填写提交实验室信息表时,需要向EDQM提交本次实验室认证认可检查的结果和认可范围,以供联盟顾问小组和秘书处进行审核和评估。不论何时,如果一个OMCL的状态发生了变化(组织结构发生了根本性的变动),该实验室应该立即填写该信息表并提交。如果是联盟现任成员,那么该信息表中所填写的信息必须和联盟数据库中该实验室的信息保持一致。
如果在上次填写表格之后,实验室情况发生了变化,则还需要补充提交以下内容:实验室最新组织结构图;国家药品监管机构出具的书面证明,以证明实验室新的职责、任务和功能。
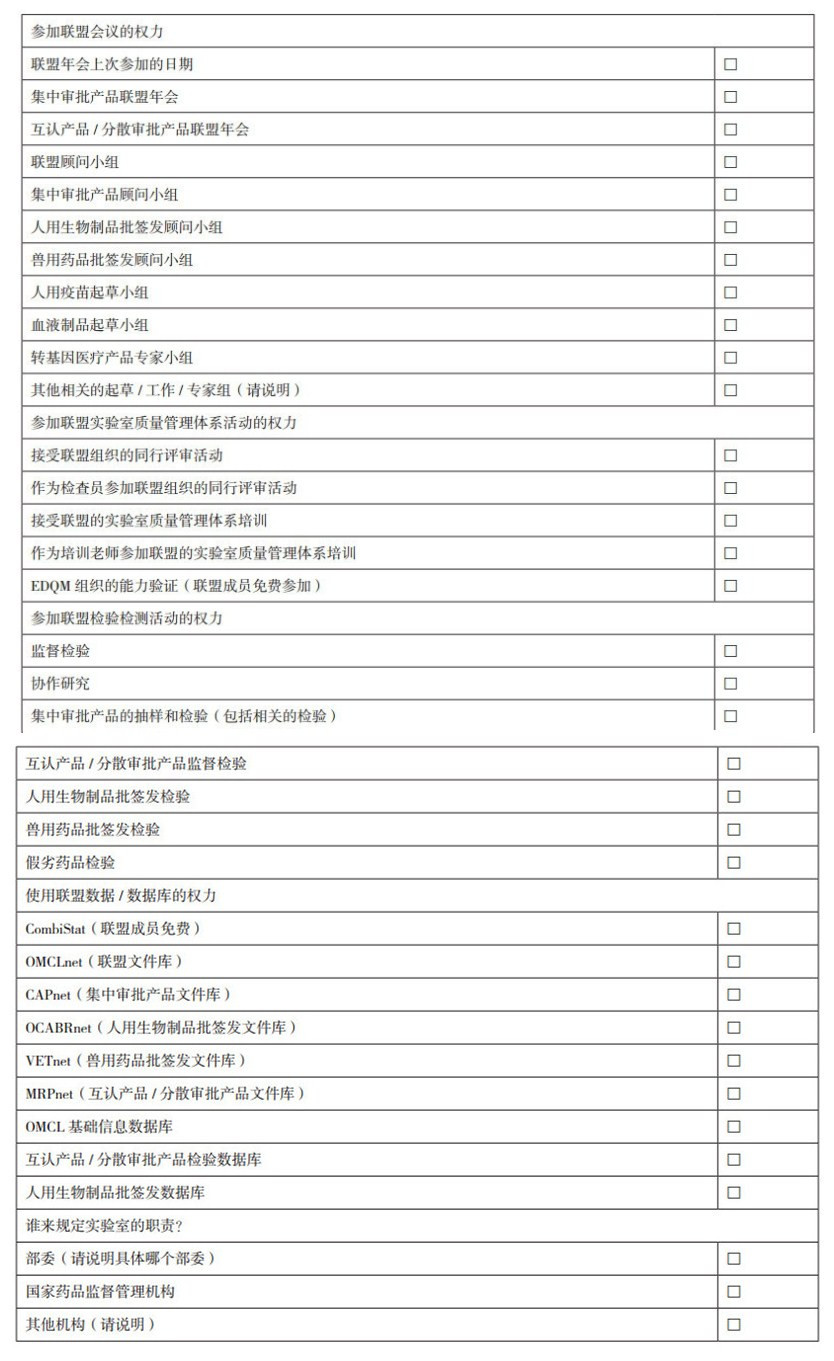
另外,联盟成员还需要每年填写一次EDQM组织的问卷调查,主要调查联盟各成员在联盟中享有的权利(见表 4)。
|
|
表 4 联盟成员享有权利调查表 |
联盟成员必须接受外部实验室质量管理体系检查。这些外部检查涵盖ISO 17025的所有要素和OMCL联盟特定的有关规定。检查内容包括对实验室管理水平和技术水平进行检查,还包括对所有内部和外包的检验检测活动的独立性、保密性,以及利益冲突进行审查。如果实验室的外部检查活动不属于OMCL的同行评审活动,那么该实验室必须向OMCL和秘书处告知本次检查的结果(结论、证书以及认证范围)。
秘书处跟踪所有联盟成员进行外部实验室质量管理体系检查的所有信息。OMCL可以通过电子邮件的方式向EDQM提交新信息,也可以在OMCL基础信息数据库中有关本实验室的板块中上传这些信息。
对于那些没有提交这些信息的实验室,形成一个名单,提交联盟顾问小组在下次工作会议时进行讨论。
3.3 OMCL基础信息数据库联盟明确规定成员的检验检测能力和认证范围应该保持公开透明,并及时更新(OMCL inventory database, http://www.edqum.eu/omcldb/)。因此,实验室有义务定期向秘书处提交确认,以证明数据库中的数据是最新的。
秘书处每年开展一次集中检查活动,规定提交信息确认的截止日期。秘书处跟踪收到的每份确认声明。
对于那些没有提交信息确认的实验室,形成一个名单,提交联盟顾问小组在下次工作会议时进行讨论。
3.4 年度报告在第二章联盟的规章制度中,联盟的每个成员都有义务向联盟提交年度报告。在每年的年度会议开始之前报告提交完毕。在EDQM的官方网站上年度表格的模板供各成员实验室参考。
秘书处跟踪每份提交的年度报告,对于那些没有提交年度报告的实验室,形成一个名单,提交联盟顾问小组在下次工作会议时进行讨论。对于那些涉及生物制品批签发工作的年度报告,在讨论的时候要有相关的专门顾问小组参加。
4 降级和取消资质的程序联盟顾问小组决定对那些没有履职尽责的实验室采取哪些措施。在做出任何决定之前,秘书处都要与当事实验室进行沟通,让他们提出解释。这些实验室应该就相关问题提交一个书面的说明,有时候也有可能邀请这些实验室参加会议,给出一个口头解释和说明。
如果秘书处向当事实验室提出要求60天之内没有收到充分的回答,该要求需要联盟顾问小组主席和秘书处共同签字,由联盟顾问小组决定采取有关措施。在任何情况下,都会以官方信件的方式正式通知当事实验室联盟顾问小组做出的决定。该信件由联盟顾问小组主席和秘书处共同签字。
5 恢复成员资质只要导致临时终止成员资质和降级为有限制条件成员的不符合项已经被消除,那么这两项措施可以解除。在这种情况下,当事实验室需要向联盟秘书处提交一份正式申请和书面的证据,以证明之前的不符合项已经被改正。在下一次联盟顾问小组上对恢复成员资质事宜进行讨论,并将讨论结果通知当事实验室,在下一次年会上公布。
6 与有关方面的沟通和报告在年度会议上,由联盟顾问小组主席报告联盟现任成员和申请者的实验室信息调查表以及年度报告。
同样,在年度会议上,由联盟顾问小组主席报告联盟成员接受外部实验室质量管理体系检查的情况,以及基本信息数据库信息确认的情况。
根据对联盟实验室工作和相关信息做出的决定,比如改变成员资质状态,也会在年度大会上进行报告。
7 加入联盟的申请与审批联盟欢迎任何符合要求的OMCL申请成为成员。对于新的申请,联盟顾问小组和秘书处会根据联盟规定的有关资质要求,来判断实验室是否达到要求。以下是申请成为联盟成员的程序步骤。
7.1 开始申请有意向的申请者可以通过非正式的途径联系秘书处,咨询相关的要求和信息。秘书处会提供相关信息以及实验室信息调查表,如果出现申请者达不到要求的条件时,比如申请者是私立实验室或者不是欧洲药典委员会成员/观察员等情况,秘书处会立即联系申请者,告知其不可能成为联盟成员。
当非正式的咨询完成并确认申请者符合相关的申请要求时,申请者就向秘书处正式提交书面申请,标志着申请程序的开始。此时,申请者需要向秘书处提交一封正式的由国家主管机关或者药品监管机构负责人签名并标有日期的申请信。同时还要提交以下材料:
1)填写完整的实验室信息调查表;
2)实验室信息调查表中要求的书面声明和其他申请材料。
7.2 审核和出具结论下一步就是秘书处对申请材料进行初审。在收到所有要求的申请材料30日之内审查完毕。如果资料不完整,申请者需要在规定时限内补充提交资料。秘书处同时也会将审查结果向联盟顾问小组通报。
资料初审完毕后,秘书处将申请信、填写完整的问卷表及其他文件提交给联盟顾问小组的成员,要求他们对资料进行详细审查并提出问题。联盟顾问小组在收到材料后60天之内审查完毕。秘书处根据顾问小组的审查结果,就审查中发现的问题和需要补充提交的文件形成一个列表并发给申请者。申请者在3个月内做出回答,如遇特殊情况,可以申请延长到6个月。秘书处会将申请者的回答和提交的补充材料递交给专家顾问小组。如果在规定期限内申请者没有做出回答,那么秘书处会通知申请者申请失败。
当所有问题都得到了回答而且要求的补充材料也都提交后,联盟顾问下周开始讨论授予申请者联盟成员资质。通常情况下,会在下一次最近的专家顾问小组会议上讨论。如果是紧急情况,也可以通过电话会议的形式来讨论。
如果联盟顾问小组认为提交的材料还有问题,那么就有可能要求申请实验室派出一名代表来参加一次顾问小组会议或者电话会议/视频会议来对有关问题做进一步解释。顾问小组也可以要求EDQM对申请实验室进行现场检查,检查重点是材料中有问题的方面,比如说利益冲突、检验公正性和保密性等。顾问小组所有成员必须在会议上或者电话会议上达成一致意见。
7.3 后续工作一旦做出最终决定,秘书处就会在30天内以书面的形式告知申请者结果。
如果申请被否决,则会告知申请者详细的原因。一次申请被否决并不意味着今后该实验室不能再申请,只要该实验室在相关问题上做出改进。
如果申请被批准,则会告知申请者批准的是何种成员资质(正式成员或准成员)以及相应的权力范围,比如能够加入专门的分联盟等。除此之外,该实验室会被列入联盟成员表中,该实验室代表也会被邀请参加下一届联盟年会。在每年的联盟年度会议上,顾问小组主席向联盟报告过去一年中所有受理的申请情况。
8 讨论欧洲OMCL联盟在欧洲理事会的领导和秘书处的统一组织协调下,建立了欧盟各国监管机构国家实验室既独立又联合的一种新型管理和合作模式,实现了检验资源优化、协同加强、优势互补的全方位合作局面,为欧洲各国和欧盟的整体药品监管提供了坚实的技术支撑和必要的实验室资源。同时也避免了实验室重复建设、仪器设备闲置等浪费资源的局面[4]。本文通过对欧洲OMCL联盟的管理机制进行全面的研究和介绍,为我国药检系统进一步增强系统凝聚力、发挥协同优势、加强管理和制度建设提供了一定的借鉴和参考。
| [1] |
Application for New Membership to the GEON PA/PH/OMCL(09)838R[EB/OL].(2010-07)[2018-09-20]. https://www.edqm.eu/sites/default/files/annex_6_geon_terms_of_reference_application_for_new_membership_november_2015.pdf.
|
| [2] |
Maintenance of Membership to the GEON PA/PH/OMCL (10) 93 R9[EB/OL].(2010-07)[2018-09-20]. https://www.edqm.eu/sites/default/files/paphomcl_10_93_r9_-_annex_5_to_the_geon_terms_of_reference_maintenance_of_membership.pdf.
|
| [3] |
Questionnaire to Query the OMCL Status of Present and Future Members of the GEON, PA/PH/OMCL(08)04 R21[EB/OL].(2010-07)[2018-09-20].https://www.edqm.eu/sites/default/files/paphomcl_08_04_r21_-_annex_4_to_general_european_omcl_network_geon_terms_of_reference.pdf.
|
| [4] |
陈亚飞, 张琪, 等. 欧洲官方药品质控实验室分析仪器验证介绍[J]. 中国药事, 2012, 26(8): 915-917. DOI:10.3969/j.issn.1002-7777.2012.08.034 |
 2019, Vol. 33
2019, Vol. 33