2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
对药品及其辅料污染微生物的监控是药品质量和安全性评价的重要指标[1]。胰酪大豆胨琼脂培养基(TSA)是需氧菌检测、环境监测的全能型培养基,具有良好的灵敏度和检出率,已广泛应用于微生物的监测和控制活动中[2-6]。TSA的质量直接影响微生物检测与控制结果的准确性。人用药物注册技术要求国际协调会(ICH)和《中华人民共和国药典》(以下简称《中国药典》)均采用金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉5株标准菌株对TSA进行质量评价。由于实际生产和产品中的污染菌可能与标准菌株不同;因此,《中国药典》四部9203提出,除采用药典规定的试验菌株之外,可增加生产环境及产品中常见的污染菌株用于培养基适用性检查或方法适用性检查,以保证培养基的质量或检验方法的粗放性[6]。
本文针对日常微生物监控中发现不同厂家TSA对某药用辅料污染微生物检出能力不同这一现象,通过对污染微生物的分离鉴定,发现人参土芽孢杆菌(Bacillus ginsengihumi)的生长受TSA的质量影响较大,将其用于培养基促生长能力检查,较药典中的标准菌株对培养基具有更好的筛分能力,可以提高现行培养基适用性试验结果的可靠性,保证检验结果的准确性。
1 材料与方法 1.1 主要仪器设备Riboprinter全自动微生物基因指纹鉴定系统;Biolog微生物自动分析系统;聚合酶链式反应(PCR)仪(Bio-Rad);培养箱(BINDER);QIAGEN基因组提取试剂盒;革兰氏染色液(BD)。
1.2 实验材料8个TSA样品(A、B、C、D、E、F、G、H)均满足《中国药典》2015年版四部通则1105“培养基适用性试验”的要求。其中A、B、C、D来自国内4个厂家,E、F、G、H来自国外4个厂家。TSA对照培养基(批号:135025-201603),购自中国食品药品检定研究院。某企业辅料。
1.3 实验菌株标准菌株:金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501];白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003],均购自中国食品药品检定研究院。
人参土芽孢杆菌(Bacillus ginsengihumi):分离自实验辅料。
1.4 实验方法 1.4.1 TSA对辅料污染菌的检出能力按照《中国药典》2015年版四部附录1105的要求,以pH 7.0无菌氯化钠-蛋白胨缓冲液制备1:10供试液;采用平皿法,平行测定3皿,30~35℃培养5 d,记录结果;按照公式1计算5株标准测试菌株的回收率;采用公式2比较8个厂家TSA和对照培养基对某企业污染辅料需氧菌总数检查结果的差异。
公式1:

|
公式2:

|
镜检:挑取新鲜培养的纯菌落,进行革兰氏染色,镜检观察染色结果。
Biolog鉴定:根据染色结果初步确定辅料污染菌的微生物类型,按GEN Ⅲ MicroPlate使用说明书操作,得出比对结果。
16S rDNA序列分析:使用DNA提取试剂盒提取辅料污染菌基因组DNA。采用细菌通用引物(正向引物27 F:AGAGTTTGATCCTGGCTCAG;反向引物1492 R:TACGGCTACCTTGTTACGACTT)对获得菌株的基因组DNA进行PCR扩增。PCR反应条件:95℃预变性4 min;95℃变性30 s,50℃引物退火45 s,72℃延伸1 min 30 s,35个循环;72℃延伸5 min。委托北京诺赛基因组研究中心有限公司测定PCR产物序列。将获得的基因序列在EzBioCloud数据库(www.ezbiocloud.net/identify)进行同源性比对。
核糖体分型分析:按照RiboPrinter系统程序操作说明进行操作,对待测菌株进行鉴定。
1.4.3 TSA对辅料污染菌的促生长能力8个厂家TSA培养基和TSA对照培养基,按说明书要求制备琼脂平板,分别接种辅料污染菌20~ 200 cfu/皿,平行测定3皿,30~35℃培养2~5 d,记录结果。按公式2计算TSA对辅料污染菌促生长能力的回收率。
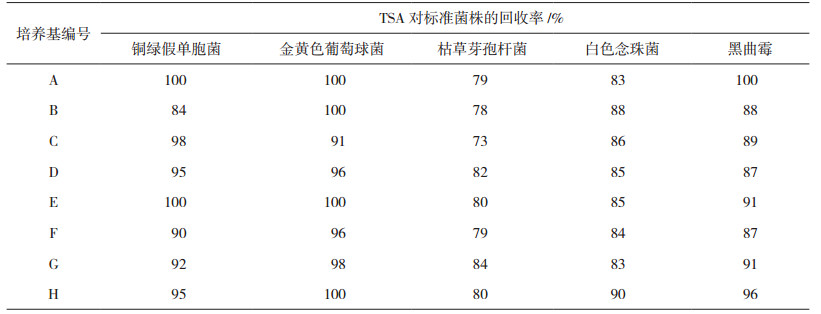
2 结果与讨论 2.1 TSA对辅料污染菌的检出能力实验中8个厂家TSA对标准菌株的回收率均大于70%(表 1),符合药典的一般要求。
|
|
表 1 实验用培养基的方法适用性试验结果 |
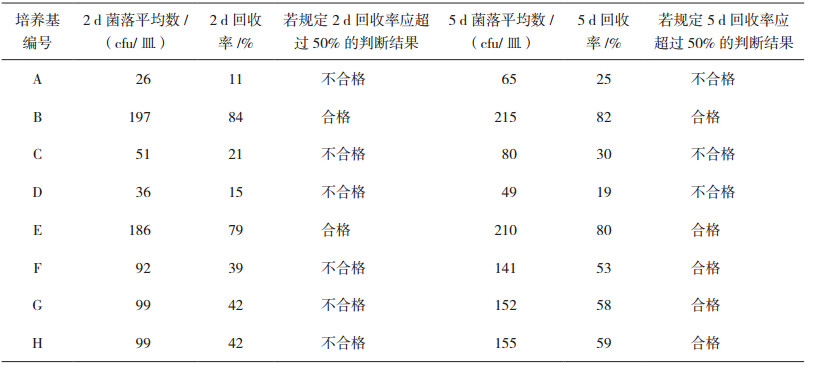
污染辅料在9种TSA琼脂平板上生长的污染菌均为相同的形态单一菌落,但需氧菌总数结果(表 2)差异较大,A、C、D、F、G培养基的检验结果介于100~300 cfu·g-1,H、E培养基的检验结果在800~1000 cfu·g-1,B和对照培养基的检验结果为1600~1700 cfu·g-1。以对照培养基作为参比系统,提示部分厂家的TSA对该污染菌的检出能力不足,即该污染菌对培养基的营养要求有其特殊性,导致需氧菌总数检查结果偏低。因此,有必要对该污染菌株进行鉴定。
|
|
表 2 辅料需氧菌总数检查结果 |
污染菌在TSA平板上培养24 h,其革兰氏染色结果为G+杆菌(见图 1)。

|
图 1 污染菌的革兰氏染色结果 |
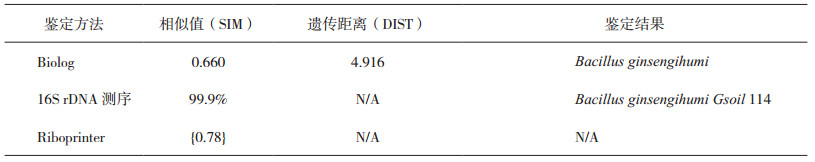
利用Biolog鉴定系统数据库(Version 2.8),确认污染菌与人参土芽孢杆菌(Bacillus ginsengihumi)的相似度较高,相似度值0.66(大于0.50),遗传距离4.916(小于5.00)[7],鉴定结果为人参土芽孢杆菌。污染菌的16S rDNA扩增序列与EzBioCloud数据库的比对结果亦鉴定其为人参土芽孢杆菌(Bacillus ginsengihumi),相似度为99.9%(表 3)。进一步采用RiboPrinter核糖体分型技术对污染菌进行分析,由于RiboPrinter系统数据库(DUP 2011)中没有收录人参土芽孢杆菌(Bacillus ginsengihumi),系统不能依据相似性(相似性<0.85)给出鉴定结果[6, 8-9],但可排除其不是数据库中的其他已知菌。
|
|
表 3 污染菌的鉴定结果 |
由于微生物染色、生化等表型分析结果受培养基、培养时间、传代次数等因素的影响,因此,选用多种不同机理的鉴定方法互相验证,弥补不同鉴定方法可能存在的局限性,可以避免做出不准确的结论[10-11]。综上,该辅料分离微生物鉴定结果为人参土芽孢杆菌(Bacillus ginsengihumi)。
人参土芽孢杆菌(Bacillus ginsengihumi)于2006年首次被韩国研究者从人参植物园土壤中用改良R2A分离获得,其在TSA和营养琼脂上可以生长,不能够在麦康凯琼脂上生长[12]。直到2015年,研究者才相继用植酸酶选择培养基(Phytase Screening Medium,PSM)从谷物根际土及用平板计数琼脂(PCA)培养基从巴拉圭茶中再次分离得到[13-14]。采用变性梯度凝胶电泳非培养的方法,从脱油麻风树发酵物和硫酸盐废水中的微生物种群中,也发现了人参土芽孢杆菌的存在[15-16]。2017年,有报道从绿茶中分离得到了具有耐受工业原位清洗的人参土芽孢杆菌[17]。至今尚未见人参土芽孢杆菌致病性的报道。
2.3 TSA对人参土芽孢杆菌的促生长能力8个厂家TSA对人参土芽孢杆菌的促生长能力(回收率)结果见表 4。B、E两个培养基对人参土芽孢杆菌的促生长能力最优;国外F、G、H 3个培养基的促生长能力次之;国内A、C、D 3个培养基的促生长能力相对最弱。尽管8个厂家TSA对药典要求的标准菌株均具有良好的促生长能力,但是,对人参土芽孢杆菌的促生长能力有明显差异(表 4)。即人参土芽孢杆菌对TSA培养基的质量有更好的筛选区分能力。因此,在满足药典要求的基础上,应增加人参土芽孢杆菌(Bacillus ginsengihumi)进行培养基适用性试验,避免由于培养基促生长能力不足而导致误判的风险。
|
|
表 4 TSA对人参土芽孢杆菌(Bacillus ginsengihumi)的促生长能力 |
辅料中的微生物受到环境因素的影响,其细胞处于代谢受损的状态,生长周期中的停滞期会延长,对温度、酸度、无机盐等因素也更为敏感[18-19]。本部分促生长能力实验所使用的菌株经过新鲜培养基的复苏,细胞得到了修复[20]。因此,表 4中对人参土芽孢杆菌的回收率结果与表 2的检出率结果相比略有差异。
3 结论培养基是微生物试验的最关键的要素,需要确定培养基在不同状况下的性能[21]。在ICH及《中国药典》要求的TSA培养基适用性检查法中,尽管5株标准菌株涵盖了自然环境中最为常见的微生物种类,包括革兰氏阳性球菌和杆菌、革兰氏阴性杆菌、产芽孢的杆菌以及真菌,但不能完全代表样品中部分较为特殊的菌群。此外,由于原始环境的污染菌远较复苏后菌株更难检测[22],美国食品药品监督管理局(FDA)发布的调查报告和警告信中明确提到,样品中少量受损微生物不容易被检测到,因此,要求在进行微生物促生长能力回收试验中应包括受损微生物的验证试验[19, 23]。本研究表明将人参土芽孢杆菌(Bacillus ginsengihumi)作为TSA质控菌株,较药典收载的5株常用试验菌株更能反映TSA对样品中污染微生物的促生长能力,避免微生物限度检查中出现“假阴性”结果而误判放行产品。
2010年版《中国药典》培养基适用性检查试验中引入了“对照培养基”为参比,便于培养基适用性的执行,并为检查结果的合理性评价提供了保障[24],为国内药品微生物质控实验室提供了培养基适用性评价的“标尺” [25-26]。本文结果可见,相较于大部分市售培养基,TSA对照培养基对该辅料污染微生物有更好的检出能力,对人参土芽孢杆菌表现出较好的促生长能力。
| [1] |
解慧, 路立京, 曹晓云. 市售《中国药典》2015年版非无菌产品微生物限度检查用培养基质量评价[J]. 天津药学, 2016, 28(5): 18-22. DOI:10.3969/j.issn.1006-5687.2016.05.006 |
| [2] |
王娟, 李兵兰, 许春, 等. 中国药典2010年版和2015年版微生物计数检查法比较[J]. 中国药师, 2017, 20(9): 1687-1689. DOI:10.3969/j.issn.1008-049X.2017.09.048 |
| [3] |
由亚宁, 陈雪芹, 周志云, 等. 2005年版《中国药典》和《欧洲药典》菌落计数培养基比较[J]. 中国药事, 2010, 24(6): 587-589. |
| [4] |
国家质量监督检验检疫总局. GB/T 16294-2010中华人民共和国国家标准: 医药工业洁净室(区)沉降菌的测试方法[S]. 2010.
|
| [5] |
国家质量监督检验检疫总局. GB/T 16293-2010中华人民共和国国家标准: 医药工业洁净室(区)浮游菌的测试方法[S]. 2010.
|
| [6] |
中华人民共和国药典: 四部[S]. 2015.
|
| [7] |
叶姜瑜, 窦建军. 利用常规鉴定方法和Biolog快速鉴定方法鉴定产脂肪酶菌株[J]. 重庆理工大学学报, 2012, 26(5): 24-27. DOI:10.3969/j.issn.1674-8425-B.2012.05.007 |
| [8] |
Inglis T J, O'Reilly L, Foster N, et al. Comparison of Rapid, Automated Rbotyping and DNA Macrorestriction Analysis of Burkholderia Pseudomallei[J]. Journal of Clinical Microbiology, 2002, 40(9): 3198-203. DOI:10.1128/JCM.40.9.3198-3203.2002 |
| [9] |
刘培, 彭杨思, 赵良娟, 等. 金黄色葡萄球菌分离株自动化核糖体分型的研究[J]. 食品研究与开发, 2016(1): 138-141. DOI:10.3969/j.issn.1005-6521.2016.01.032 |
| [10] |
USP39-NF34[S]. 2016.
|
| [11] |
刘鹏, 魏亚东, 崔铁军. Biolog系统和16SrDNA序列分析方法在植物病原细菌鉴定中的应用[J]. 植物检疫, 2006, 20(2): 86-87. DOI:10.3969/j.issn.1005-2755.2006.02.008 |
| [12] |
Ten L N, Im W T, Baek S H, et al. Bacillus Ginsengihumi sp. Nov. a Novel Species Isolated from Soil of a Ginseng Field in Pocheon Province, South Korea[J]. Antonie Van Leeuwenhoek, 2006, 16(10): 1554-1560. |
| [13] |
Akhmetova A A, Suleimanova A D, Toymentseva A A, et al. Heterologous Expression of Bacillus Ginsengihumi Phytase Gene[J]. Research Journal of Pharmaceutical Biological & Chemical Sciences, 2015, 6(4): 117-122. |
| [14] |
Albiero G, Valente da Silva P, Da Costa M. Sanitary Quality and Diversity of Culturable Bacteria and Yeasts in Processed and in Natura Yerba Mate (Ilex Paraguariensis A. St.-Hil.)[J]. R. Bras. Bioci., Porto Alegre, 2015, 13(2): 90-95. |
| [15] |
Kumar G, Sivagurunathan P, Kim S H, et al. Modeling and Optimization of Biohydrogen Production from De-oiled Jatropha Using the Response Surface Method[J]. Arabian Journal for Science & Engineering, 2015, 40(1): 15-22. |
| [16] |
张健.碱度和碳源对硫酸盐废水处理效能的影响及机制研究[D].青岛: 中国海洋大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011030501.htm
|
| [17] |
吴阿宝, 黄庭轩, 杨祖顺, 等. 绿茶饮料污染菌人参土芽孢杆菌的鉴定和分析[J]. 食品与发酵工业, 2017, 43(9): 124-129. |
| [18] |
Stephens P J, Mackey B M. Recovery of Stressed Microorganisms[M]//Progress in Industrial Microbiology. Elsevier, 2003, (37): 25-48.
|
| [19] |
FDA. Product Quality Microbiology Review[EB/OL].(2011-05-02)[2018-10-22].https://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/202245Orig1s000MicroR.pdf.
|
| [20] |
杨晓莉, 李辉, 马英英, 等. 《中国药典》2015年版非无菌产品微生物限度检查:控制菌检查法解读与对策[J]. 中国药师, 2016, 19(4): 748-752. DOI:10.3969/j.issn.1008-049X.2016.04.042 |
| [21] |
范文平, 赵宏大, 谢文, 等. 药品检验中微生物数据偏差的实验室调查[J]. 中国药师, 2015(11): 1974-1977. DOI:10.3969/j.issn.1008-049X.2015.11.047 |
| [22] |
Zani F, Minutello A, Maggi L, et al. Evaluation of Preservative Effectiveness in Pharmaceutical Products:The Use of a Wild Strain of Pseudomonas Cepacia[J]. Journal of Applied Microbiology, 2010, 8(3): 322-326. |
| [23] |
FDA. Warning Letter[EB/OL]. (2017-10-18)[2018-10-22]. https://www.fda.gov/ICECI/EnforcementActions/WarningLetters/2017/ucm581826.htm.
|
| [24] |
马仕洪, 杨美琴, 刘鹏, 等. 《中国药典》2010年版对照培养基的研制与应用[J]. 中国药事, 2012, 26(8): 847-851. DOI:10.3969/j.issn.1002-7777.2012.08.014 |
| [25] |
曹丽梅, 马双成, 马玲云, 等. 中检所药品、医疗器械标准物质管理新模式:从分散多头管理走向集中统一管理[J]. 药物分析杂志, 2010(10): 1993-1995. |
| [26] |
曹丽梅, 杨美琴, 马仕洪, 等. 对照培养基研制技术要求的介绍[J]. 中国药事, 2014, 28(2): 166-167. |
 2019, Vol. 33
2019, Vol. 33