2. 广州市品毅信息科技有限公司, 广州 510095;
3. 广东省药理学会, 广州 510080
2. Guangzhou Pinyi Information Technology Co., Ltd., Guangzhou 510095, China;
3. Guangdong Pharmacological Society, Guangzhou 510080, China
近年来,我国药品安全监管理念发生了深刻变化,逐渐从被动监管向主动监管转变。2016年,原国家食品药品监督管理总局启动了药品不良反应监测哨点建设试点工作,成立了国家药品不良反应监测哨点联盟。2017年2月,在国务院发布的《“十三五”国家药品安全规划》中,亦明确提出要“利用医疗机构电子数据,建立药品医疗器械安全性主动监测与评价系统。在综合医院设立300个药品不良反应和医疗器械不良事件监测哨点。”由此可见,我国已将药品不良反应监测哨点(联盟)的建立作为加强药品上市后安全性主动监管,提升药品不良反应监测能力的重要手段。在此背景下,本研究对我国药品不良反应监测哨点联盟建立的作用、意义及其运行情况等内容进行阐述和分析,这将对进一步加强我国政府部门、医院、制药企业、学界等相关人员对该联盟的认识和了解具有重要的实践指导意义。
1 相关概念界定本文涉及到“中国医院药物警戒系统”与“国家药品不良反应监测哨点联盟”两个核心概念,首先需要对它们进行界定。其一,中国医院药物警戒系统(Chinese Hospital Pharmacovigilance System,CHPS)是国家药品不良反应监测中心开发的辅助监测哨点发现、报告、评价药械不良反应/事件,开展重点监测、上市后研究,获取药械警戒信息的信息化系统。它被部署在各个监测哨点医疗机构,接入它们自身的信息化系统和医疗数据,及时获知医疗机构药品不良反应报告[1],实现监测哨点医疗机构药品不良反应(ADR)信息的线上生成、审核、上报、反馈和分析,从而可有效改变现有上报模式中所存在的漏报率高、报告随意性强、报告信息不完整等问题,且为监测哨点联盟的建立提供了技术上的准备[2];其二,国家药品不良反应监测哨点联盟是由国家药品不良反应监测中心认定通过的监测哨点所组成的联盟组织,致力于探索药品不良反应主动监测模式、开展重点监测等药品上市后研究,促进合理用药,保障公众用药安全[3]。国家药品不良反应监测中心规定每家监测哨点联盟成员单位都需部署实施CHPS系统。
2 建设监测哨点联盟的作用和意义我国建设国家药品不良反应监测哨点联盟将对国家药品监管部门、医院、制药企业等多方在开展药品安全主动监测和药品风险控制、ADR上报、药品上市后再评价研究等方面的工作发挥重要作用,从而有助于打造多方主体共生共赢的“生态圈”。
1)为我国药品监管部门提升药品安全监管能力提供技术支撑,创新我国药品不良反应监测体系
目前,我国ADR监测所采用的自发报告系统存在诸多缺陷,这在一定程度上制约了我国药品监管部门的药品安全监管能力,而借助基于CHPS的监测哨点联盟,一方面可探索建立我国药品安全主动监测模式和相关技术,使得主动、高效、全面、规范地获取“真实世界”药品安全性数据,及早发现、验证并控制药品风险成为可能;另一方面,可在国家层面对药品安全信息的收集途径、报告流程、报表填写和报告评价、随访调查、数据管理等方面建立规范的流程和标准,保证数据的质量(真实、准确和完整)和时效,创新我国智能化的药品不良反应监测体系。
2)为监测哨点医院开展ADR上报、安全合理用药及其相关科研工作提供平台
首先,监测哨点医院利用CHPS系统可有效提高ADR上报的效率、数量和质量。其次,监测哨点医院利用哨点联盟这一平台,一方面可及时共享由国家ADR监测中心提供的药品安全性监测大数据,开展药品上市后安全性、有效性、风险获益比的研究,为药品安全风险管理提供决策依据,提示医护人员安全合理用药;另一方面也可借助政府主导搭建和推进的药品上市后再评价平台,加强与其他哨点医院联盟成员的合作与交流,开展更多药品重点监测与上市后再评价等方面深入的科学研究。
3)为制药企业提供药物警戒与药品上市后再评价技术服务
当前,国内外制药企业或药品上市许可持有人在药物警戒、药品上市后再评价以及真实世界研究等方面的技术服务需求旺盛,制药企业可借助国家药品不良反应监测哨点(医疗机构)联盟这一平台以及CHPS等工具,与全国范围的哨点联盟医院成员合作,高效、全面、规范地获取本公司药品品种基于真实世界的安全性大数据,实现便捷的网络报送和重点监测研究[4],促进其高效率、低成本、高质量地开展药品上市后再评价研究工作,以弥补随机对照试验(RCT)工作在效率、成本和研究质量等方面存在的不足,逐步建立较为完善的药品上市后评价体系。
总而言之,基于CHPS所应用的真实世界大数据和人工智能等现代技术所建立的监测哨点联盟,将进一步实现政府相关部门对各地上市后药品进行的有效评价和科学监管[5],完善药品不良反应监测体系及药品上市后再评价体系,打造药品安全智能监管平台,提高药品监管工作的效率,实现“源头可溯、全程可控、风险可防、责任可究、绩效可评、公众可查” [6]。从而推动构建生物大数据、医疗健康大数据共享平台,搭建智能化信息预警的诊疗生态系统,促进医药企业健康发展。
3 中美两国药品不良反应监测哨点联盟监测方法对比美国的药物警戒哨点监测计划(Mini/Sentinel Initiative)的应用为美国FDA回答应对药品安全事件提供了重要的技术支持。截至目前,已建立的大数据仓库包括:6690万名有医疗和药物保险的成员数据,2.925亿份病人识别资料(2000-2017年的累计数据),144亿个药房配药记录,133亿个就医记录,4560万名至少有一项实验室检验结果的病患数据[7]。而我国的中国医院药物警戒系统(CHPS)利用真实世界大数据和人工智能也可以对药品安全事件提供重要的技术支撑,改变了以往我国使用的基于自发呈报的被动监测系统存在的报告效率低、报告质量差及漏报率高,难以全面满足政府药监部门、医疗机构及药品企业对药品不良反应监测管理的需求等问题。两国的联盟监测方法比较详见表 1。
|
|
表 1 中美两国药品不良反应监测哨点联盟的监测方法对比表 |
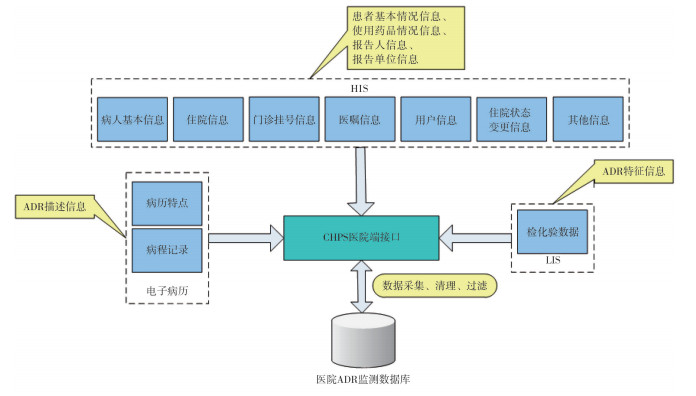
目前,较为完善的CHPS v1.0已经打通了医院内部各个独立的信息系统壁垒,改善了ADR监测数据院内数据采集方式,将传统的ADR监测模式由“被动监测”转为“主动监测” [9],并具备以下功能:①辅助报告,与医院HIS集成,提高药品不良反应报告效率和质量;②主动监测,利用搜索工具发现应报未报的ADR,减少漏报;③信息服务,反馈国家药品不良反应信息资源,服务医院合理用药。
|
图 1 CHPS v1.0数据采集结构图 |
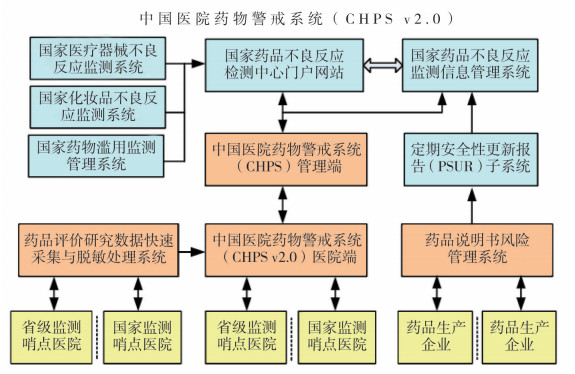
尚在研究完善的CHPS v2.0系统是在CHPS v1.0的基础上,新增药品评价数据的采集、清洗、脱敏、上报、分析及管理等功能,主要的结构框架如图 2所示。CHPS v2.0系统是一套可实现药品不良反应发生率的计算、药品再评价报告管理的药物评价分析系统,可为国家、省ADR中心及医疗机构开展药品上市后监测评价研究工作提供技术支持。
|
图 2 CHPS v2.0整体框架结构图 |
广东省药品不良反应监测中心及相关研究团队在药品不良反应监测系统、药品上市后的研究方面积累了超过10年的经验,共承担国家科技支撑计划、原国家食品药品监督管理总局、广东省科技计划等国家及省部级相关项目10多项,主持开发《泛珠三角区域药品不良反应监测共享信息系统》在内的药械不良反应监测信息系统20余个。此外,广东省药品不良反应监测中心还主持药品生产企业上市后药品再评价委托项目近30项,其中,完成样本量超过3万例的前瞻性药品再评价项目3项,样本量2万例1项。
5 监测哨点联盟的运行机制 5.1 监测哨点联盟组建的工作模式和程序我国基于CHPS的监测哨点联盟采取先由各省、自治区、直辖市的医疗机构自愿申报,然后由其所在地区的省级ADR监测中心推荐,再通过国家ADR监测中心审核,最终签订联盟合作协议的工作模式和程序,并进行联盟单位的筛选和联盟的组建。符合条件的监测哨点单位,会在其自身管理系统中部署实施CHPS,以便于联盟单位间相互或各自开展更加高效的ADR监测和药品上市后再评价等研究。
5.2 监测哨点联盟成员的利益、风险机制联盟的核心是通过监测哨点间的相互合作探索药品不良反应主动监测模式、开展重点监测等上市后研究,从而减少药物不良事件的发生,促进合理用药,保障公众用药安全。由于存在药品信息数据可能泄露的风险,各联盟单位在积极参与国家ADR中心及各省ADR中心组织的重点课题研究工作时,需要遵守有关的管理办法,并在国家ADR中心备案,从而及时、准确地共享国家药品安全监测研究所需数据。
5.3 监测哨点联盟的协调机制监测哨点联盟协调机制:一是为提高联盟运行效率,整合行业资源,促进高校、企业、科研机构及政府管理部门之间的合作与交流,编辑专业刊物和相关出版物,开展课题研究、培训、咨询等服务;二是本着优势互补、资源共享的原则,实现创新资源的有效分工与合理衔接,以调动联盟成员的积极性;三是加强联盟单位之间的技术结合、信息沟通,鼓励联盟成员实现双边和多边形式的合作,促进联盟单位之间的信息交互与业务合作,构建区域医疗体系。
5.4 监测哨点联盟的实际运行范例CHPS最初于2014年在广东省进行试运行上线,积极探索适合我国国情的药品ADR医院集中监测、处方事件监测与自发呈报监测等方法有机结合的创新模式,推进我国ADR向“主动监测”和“预防为主”的药械风险控制模式发展。
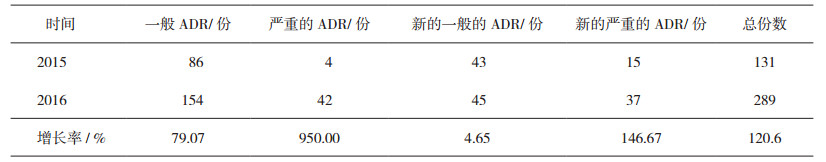
目前,全国范围内已有超过300家医疗机构申请报名成为监测哨点,其中已经陆续部署实施CHPS的有100多家,CHPS上线后各联盟单位通过该系统向国家药品不良反应监测中心上报ADR的效果显著。限于篇幅,本研究列出某一哨点联盟成员医院运用CHPS系统前、后,ADR的上报对比情况,如表 2所示。
|
|
表 2 某哨点联盟成员医院运用CHPS系统前、后ADR上报情况 |
由表 2可知,该哨点医院在CHPS系统上线前(2015年)与上线后(2016年),其ADR的上报数量呈现大幅增长,这反映出监测哨点联盟通过应用CHPS系统,提高了医疗机构ADR的上报和管理效率及医疗安全(不良)事件统一管理服务[10]。
随着CHPS v2.0未来在哨点联盟成员中的应用,我国将逐步完善药品安全监测网络与管理体系,为基于真实世界大数据的药品安全信息收集、数据处理及上市后再评价研究提供持续创新的技术支撑。
| [1] |
沈璐, 刘巍, 侯永芳, 等. 浅谈我国药品安全数据合作伙伴的构想[J]. 中国药物警戒, 2016, 13(12): 737-739, 744. DOI:10.3969/j.issn.1672-8629.2016.12.009 |
| [2] |
舒婷, 陈文戈, 侯永芳, 等. 基于HIS的哨点医院药物警戒系统的研究与应用[J]. 中国药房, 2017, 28(25): 3468-3471. DOI:10.6039/j.issn.1001-0408.2017.25.04 |
| [3] |
沈璐, 刘巍, 郭雪, 等. 我国药品不良反应监测模式的趋势探析[J]. 中国药物警戒, 2017, 14(5): 295-297, 308. DOI:10.3969/j.issn.1672-8629.2017.05.009 |
| [4] |
张力, 田文杨, 唐雪, 等. 国际药物警戒学会简介与启示[J]. 中国药物评价, 2017, 34(2): 141-146. DOI:10.3969/j.issn.2095-3593.2017.02.018 |
| [5] |
丰伟刚, 赵瑜, 赵宗阁, 等. 利用大数据推进食品药品"智慧监管"研究[J]. 食品安全质量检测学报, 2015, 6(1): 354-360. |
| [6] |
沈志凌. FDA官员为台州"智慧监管"点赞[J]. 中国食品药品监管, 2016(11): 42-44. |
| [7] |
Sentinel Coordinating Center. Snapshot of Database Statistics[EB/OL].[2018-06-25]. https://www.sentinelinitiative.org/sentinel/data/snapshot-database-statistics.
|
| [8] |
Sentinel Coordinating Center. Distributed Database and Common Data Model[EB/OL].[2018-06-25].https://www.sentinelinitiative.org/sentinel/data/distributed-databasecommon-data-model.
|
| [9] |
耿魁魁, 刘圣, 沈爱宗. 基于医院信息系统开展药物警戒的探索[J]. 中国药物警戒, 2012, 9(2): 77-80. DOI:10.3969/j.issn.1672-8629.2012.02.004 |
| [10] |
朱晓梅, 陈曙光, 秦晓斌, 等. 建立医疗安全(不良)事件报告系统促进医院管理信息化[J]. 泰州职业技术学院报, 2016, 16(2): 62-64. |
 2019, Vol. 33
2019, Vol. 33