2. 山东中医药大学附属医院, 济南 250011
2. Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250011, China
呼吸道合胞病毒(Respiratory Syncytial Viruses, RSV)属于副黏液病毒科, 是引起下呼吸道感染如婴幼儿的支气管炎、支气管哮喘、肺炎的主要病原体, 具有极高的发病率, 可在大范围内流行[1-3]。木芙蓉叶系锦葵科植物木芙蓉Hibiscus mutabilis L.的干燥叶, 性平, 味微辛, 归肺经、肝经。有凉血、解毒、消肿、止痛的疗效[4-5]。木芙蓉叶主要含有芸香苷、黄酮苷等成分[6-9], 诸多研究表明木芙蓉叶具有抑菌[10]、抗病毒[11]、抗炎[12]等作用。药物在体外能够发挥抗RSV作用, 在体内的效果需要得到验证, 开发新药物、研究活性物质必然会涉及到体内药物代谢动力学。本实验通过构建RSV感染小鼠肺炎模型, 设置木芙蓉叶有效部位高、中、低三个剂量组进行试验治疗, 观察多个指标, 探究木芙蓉叶有效组分的体内抗病毒效果及其作用机理。
1 材料 1.1 药物木芙蓉叶购于安徽亳州药材市场, 由山东中医药大学徐凌川教授鉴定为Hibiscus mutabilis L.。
阳性对照药物利巴韦林注射液(辰欣药业股份有限公司, 生产批号:1612246411), PBS稀释稀释到1 mg·mL-1, 用0.22 μm的滤器过滤除菌, 放置于4℃冰箱保存备用。
1.2 病毒RSV鼠肺分离株, 山东省医学科学院基础所微生物室保存。病毒用Hep-2细胞培养活化后, 经反复冻融, 离心取上清所得, 测其对该细胞的半数细胞感染量(TCID50)为1×10-5.6 ·mL-1。
1.3 实验动物昆明小鼠, SPF级, 6~8周龄, 购自济南朋悦实验动物繁育有限公司, 生产许可证号SCXK (鲁)20140007。
1.4 主要试剂D-101大孔吸附树脂(非极性大孔吸附树脂, 沧州宝恩化工有限公司); 苏木素染液套装(武汉谷歌生物科技有限公司); 小鼠IL-2 ELISA试剂盒(北京四正柏生物科技有限公司); 小鼠IFN-γELISA试剂盒(北京四正柏生物科技有限公司); 小鼠TNF-αELISA试剂盒(北京四正柏生物科技有限公司); 二甲苯、盐酸、氨水、中性树胶(均由国药集团化学试剂有限公司生产)。
1.5 主要仪器生物安全柜(济南鑫贝西生物技术有限公司公司); 超净工作台(济南隆宏公司); 酶标仪(芬兰雷勃公司); 低温高速离心机(贺立氏台式低温离心机); 倒置显微镜(Olympus公司); 高压灭菌锅(济南德强仪器有限公司MJ37600);纯水机(济南太平玛环保有限公司); CO2细胞恒温培养箱(日本三样公司); 脱水机(武汉俊杰电子有限公司); 包埋机(武汉俊杰电子有限公司); 冻台(武汉俊杰电子有限公司); 病理切片机(上海徕卡仪器有限公司); 组织摊片机(浙江省金华市科迪仪器设备有限公司); 烤箱(天津市莱玻瑞仪器设备有限公司); 成像系统(日本尼康); 实验室用膜分离设备(上海摩速科学器材有限公司); 卷式超滤膜(上海摩速科学器材有限公司)。
2 实验方法 2.1 样品的处理称取400 g木芙蓉叶置于圆底烧瓶中, 加8倍量水浸泡2 h, 回流提取4 h, 趁热过滤, 用旋转蒸发仪减压浓缩至相对密度为2:1, 向浓缩液中缓慢加入体积分数为95%的乙醇并用玻璃棒快速搅拌, 调节乙醇浓度至80%, 冷藏静置24 h、抽滤, 将醇沉上清液浓缩至浓度为1 g·mL-1的溶液; 将浓缩液用玻璃过滤器50 μM滤膜过滤, 分别过截留分子量为10000、5000、3000的超滤膜, 收集分子量5000~10000部位, 过D101型大孔树脂, 用蒸馏水、25%乙醇、50%乙醇、75%乙醇(洗脱流速为3 BV·h-1), 收集25%乙醇的洗脱液的第一个洗脱部位, 浓缩干燥, 备用, 为木芙蓉叶有效部位。
2.2 RSV病毒鼠LD50的测定随机将试验小鼠以每组10只, 雌雄各5只, 分成5组。将浓度为RSV原液从-40℃冰柜中取出融化, 加入细胞维持液做10倍比稀释5个不同浓度, 即1×10-3.6 ·mL-1、1×10-4.6 ·mL-1、1×10-5.6·mL-1、1×10-6.6 ·mL-1、1×10-7.6 ·mL-1。先用乙醚将小鼠麻醉后, 再进行滴鼻接种, 每组分别给予上述不同浓度的病毒液每只50 μL。观察并记录7 d内的发病与死亡情况, 并按照Reed-Muench两氏法计算LD50。公式:1)距离比例=(高于50%死亡率-50%)/(高于50%死亡率-低于50%死亡率); 2)LD50=Antilog(高于50%死亡率的稀释度的对数-距离比例)。
2.3 动物分组设计将试验动物随机分为6组, 每组10只, 雌雄各半; 分别设为空白对照组, 病毒对照组(模型组), 利巴韦林组(阳性药物组), 木芙蓉叶有效部位高、中、低剂量组。
2.4 建立小鼠感染模型及给药各组小鼠适应性饲养2 d后, 在乙醚轻微麻醉的情况下, 除空白对照组外每只小鼠给予50 μL稀释一百倍的TCID50(即1×10-3.6 ·mL-1)RSV滴鼻感染, 空白对照组滴鼻等量Hep-2细胞悬液。麻醉醒后进行灌胃处理, 每只小鼠灌胃剂量为0.2 mL, 每天固定时间灌胃给药, 连续5 d, 模型组和空白对照组灌胃等量的生理盐水。
2.5 检测指标 2.5.1 小鼠体重及活动情况感染后每天称量小鼠体重, 观察记录各试验小鼠活动状态、进食饮水及存活情况, 连续观察5 d。评分标准如下:1) 0分:健康, 活动正常; 2)1分:精神不振、活动减少; 3)2分:弓背、竖毛; 4)3分:消瘦, 活动困难; 5)4分:四肢麻痹, 无法正常活动; 6)5分:濒死或者死亡。
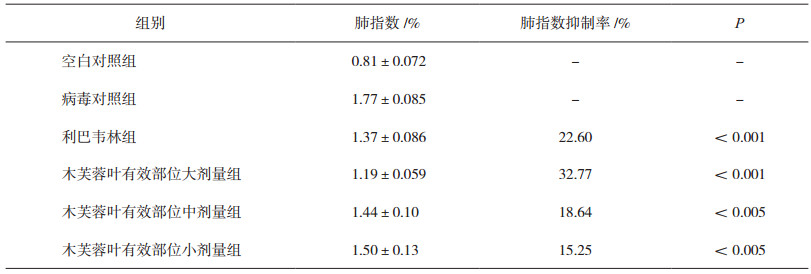
2.5.2 木芙蓉叶有效部位对RSV感染小鼠肺指数的影响于感染后的第5 d(最后一次灌胃后24 h内禁食不禁水), 对小鼠进行颈椎脱臼至昏死状态, 立即对小鼠进行眼球摘除, 无菌取血后处死(在超净工作台内操作, 使用无菌或高压灭菌后的针头、镊子、EP管等)。将血液于室温下自然冷却20 min, 4℃下在低温离心机中1000 rmp·min-1离心20 min, 仔细吸取血清, 每管40 μL, 按组分装, -20℃保存备用。无菌解剖各组小鼠, 取肺组织于PBS缓冲液的平皿中清洗2次, 用吸水纸吸干表面水分, 称其重量, 置于4%甲醛中保存, 在超净工作台进行解剖操作。计算肺指数和肺指数抑制率:1)肺指数=小鼠肺重(g)/小鼠体质量(g)×100%;2)肺指数抑制率=(病毒组平均肺指数-药物组平均肺指数)/病毒组平均肺指数。
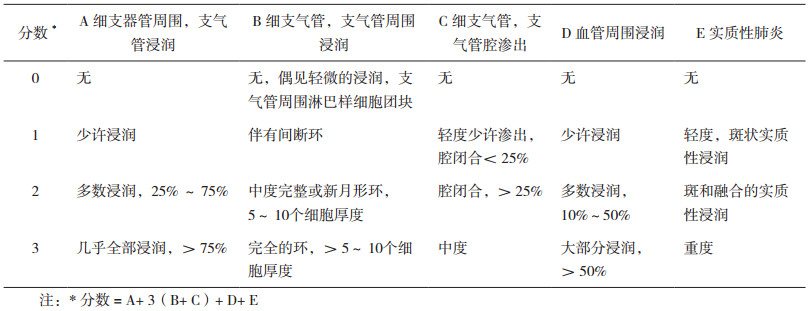
2.5.3 各组小鼠肺组织病理学检查取"2.5.2"节下的肺组织包埋、切片、染色, 显微镜下观察拍照, 并计算各组肺组织损伤评分。结果如表 1所示。
2.6 ELISA法检测RSV感染小鼠血清炎症因子 2.6.1 标准曲线的建立用EP管设7个标准浓度, 第1管至第7管中各加入样品稀释液500 μL, 第1管加标准品500 μL, 混匀后吸取500 μL移至第2管, 如此重复做对倍稀释至第7管, 形成标准曲线浓度梯度为500 ng·L-1、250 ng·L-1、125 ng·L-1、62.5 ng·L-1、31.25 ng·L-1、15.625 ng·L-1、7.8 ng·L-1。
2.6.2 样品的检测空白孔(加显色剂+终止液), 标准品孔[标准品100 μL+抗(IL-2、IFN-γ、TNF-α)抗体50 μL], 待测样品孔[样本100 μL+抗(IL-2、IFN-γ、TNF-α)抗体50 μL], 盖上封模板, 室温孵育120 min(空白对照孔除外); 每孔加入稀释好的洗涤液350 μL, 静置30 s后甩尽液体, 如此重复4次; 每孔加入酶结合工作液100 μL, 用封板胶纸封住反应孔, 室温孵育30 min(空白对照孔除外)。
2.6.3 显色每孔加入显色剂100 μL, 避光, 室温孵育15 min, 每孔加入终止液100 μL, 混匀后450 nm测定各孔吸光度。
2.6.4 测定根据绘制的标准曲线计算小鼠血清细胞因子IL-2、IFN-γ、TNF-α含量。
3 实验结果 3.1 RSV病毒鼠LD50的测定按照Reed-Muench两氏法计算, RSV对实验鼠的LD50为1×10-2.7/50 μL。将RSV原液稀释到1×10-2.7氏法, 除空白对照组外, 每只试验鼠给予50 μL, 50%的小鼠死亡。
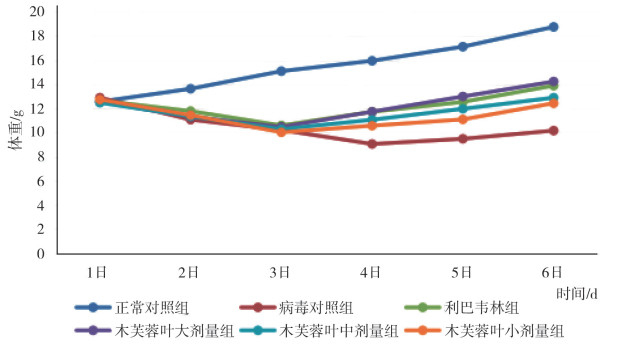
3.2 各组小鼠体重及活动情况 3.2.1 体重变化小鼠体重变化如图 1所示, 病毒对照组及用药组在感染后2~3 d内体重均出现不同程度的降低, 之后用药组体重有所回升, 病毒对照组第5 d才有所增加。
|
图 1 各组小鼠体重变化曲线图 |
空白对照组小鼠:6天内活动活跃, 饮食饮水正常, 体重不断增加, 毛色光亮顺滑, 全部健康, 评分为0。
病毒对照组:病毒感染第3天行动迟缓, 饮食饮水均减少, 体重有所下降, 毛发干枯, 呼吸短促, 第5天体重开始回升, 评分为5。
利巴韦林组:病毒感染第3天活动减少, 饮食减少, 体重下降, 在第四天开始增加, 评分为1。
木芙蓉叶大剂量组:病毒感染前2天体重降低, 活动减少, 饮食减少, 呼吸急促, 之后情况有所改善, 表现为饮食饮水量增加, 体重上升, 部分小鼠的呼吸好转, 评分为1。
木芙蓉叶中剂量组:病毒感染前2天体重明显降低, 行动迟缓, 饮食减少, 呼吸急促, 连续用药后症状减轻, 评分为2。
木芙蓉叶小剂量组:病毒感染前2天体重降低, 饮食活动减少, 皮毛暗淡, 呼吸急促, 用药后部分小鼠情况好转, 评分为3。
3.3 各组小鼠肺指数变化病毒组肺指数均值大于空白对照组, 两组比较具有显著性差异, 说明RSV感染小鼠后肺指数升高, 实验造模成功; 利巴韦林组与病毒对照组比较, 肺指数明显下降, 说明利巴韦林更能改善因RSV感染引起的肺损伤; 各实验组与病毒对照组相比(P < 0.05), 说明各实验组均降低肺指数, 大剂量组最为明显。从肺指数抑制率来看, 木芙蓉叶有效部位大剂量组抗RSV的作用最明显。如表 2所示。
|
|
表 2 木芙蓉叶有效部位对实验小鼠的肺指数(x±s, n=10) |
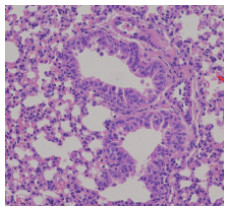
病毒对照组:在400倍显微镜下观察, 小鼠肺部出现实质性病变, 肺泡间隔增大变厚, 伴有斑和融合性的实质性浸润, 血管充血, 水肿严重, 支气管伴有细胞的变形、坏死, 淋巴细胞浸润严重。如图 2所示。
|
图 2 病毒对照组 |
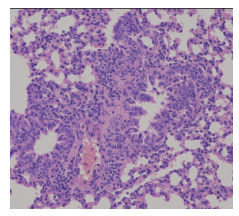
空白对照组:在400倍显微镜下观察, 多数小鼠支气管、细支气管及其周围未见异常, 肺间质无充血及浸润, 细胞排列整齐, 偶见肺组织细支气管出现少许浸润, 属于正常现象。如图 3所示。
|
图 3 空白对照组 |
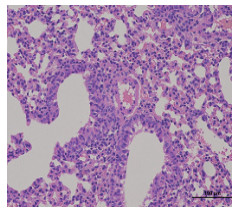
利巴韦林组:在400倍显微镜下观察, 多数较病毒组小鼠的炎症情况有了一定的改善, 表现为支气管浸润减少, 近一半小鼠出现细胞团块, 有出血性肺炎斑点。如图 4所示。
|
图 4 利巴韦林组 |
木芙蓉叶有效部位大剂量组:在400倍显微镜下观察, 小鼠部分肺组织有轻微浸润现象, 炎症细胞数量减少, 大多数支气管上皮细胞整齐排列, 有轻度出血性肺炎斑点。如图 5所示。

|
图 5 大剂量组 |
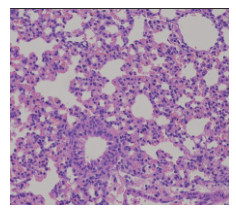
木芙蓉叶有效部位中剂量组:在400倍显微镜下观察, 部分小鼠肺间质性充血, 支气管浸润, 形成新月形环, 肺泡出现轻微病变。如图 6所示。
|
图 6 中剂量组 |
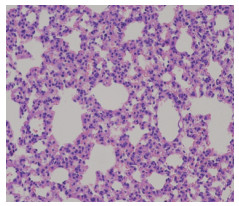
木芙蓉叶有效部位小剂量组:在400倍显微镜下观察, 小鼠部分区域有充血现象, 肺间质增厚, 支气管上皮细胞变形。如图 7所示。
|
图 7 小剂量组 |
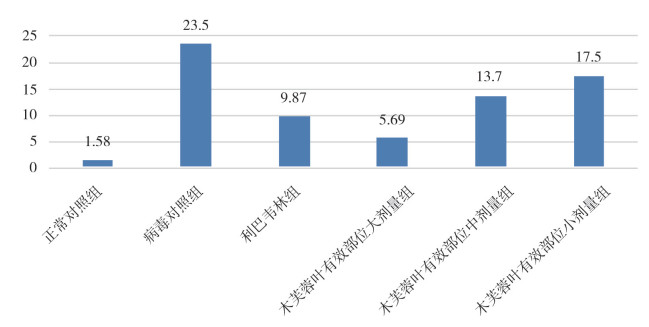
各组肺组织病理学损伤打分如图 8所示。
|
图 8 实验小鼠肺组织损伤评分 |
用统计软件SPSS 17.0进行数据统计, 组间比较用单因素方差分析, 实验所得计量资料均采用x±s表示。
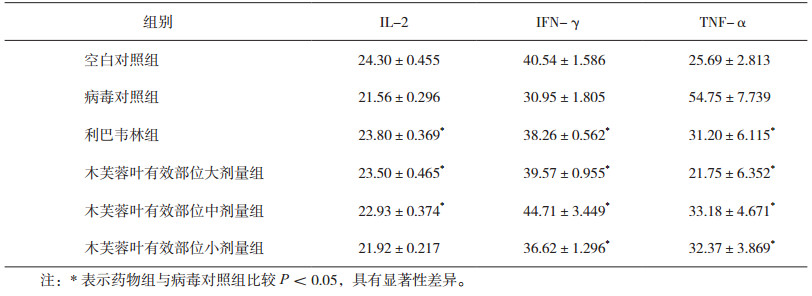
由表 3可以看出, 病毒组与正常组比较, IL-2含量降低, 说明建立的RSV感染小鼠模型可靠; 利巴韦林组较病毒组显著升高, 说明利巴韦林有较好的治疗效果; 与病毒对照组比较, 木芙蓉叶有效部位大、中剂量组均可显著提高RSV感染小鼠的IL-2含量, 说明治疗效果明显; 与病毒对照组比较, 木芙蓉叶有效部位小剂量组也可提高IL-2的含量, 效果一般; 木芙蓉叶各剂量组均可提高IL-2的含量, 效果不如利巴韦林明显。
|
|
表 3 各组小鼠IL-2、TNF-α、IFN-γ含量(n=10) |
病毒组与空白对照组比较, INF-γ含量降低, 说明建立的RSV感染小鼠模型可靠; 利巴韦林组较病毒组显著升高, 说明利巴韦林有较好的治疗效果; 与病毒对照组比较, 木芙蓉叶有效部位大、中、小剂量组均可显著提高RSV感染小鼠的INF-γ含量, 说明治疗效果明显; 与利巴韦林组比较, 木芙蓉叶有效部位中剂量与利巴韦林组有显著差异, 木芙蓉叶有效部位大、小剂量组与利巴韦林组无明显差异。
病毒组与空白对照组比较, TNF-α含量升高, 说明建立的RSV感染小鼠模型可靠; 利巴韦林组较病毒组显著降低, 说明利巴韦林有较好的治疗效果; 与病毒对照组比较, 木芙蓉叶有效部位大、中、小剂量组均可显著降低RSV感染小鼠的TNF-α含量, 说明治疗效果明显; 与利巴韦林组比较, 木芙蓉叶有效部位各剂量组与利巴韦林组无明显差异, 效果差别不大。
4 小结与讨论木芙蓉叶有效部位在体内具有一定的抗RSV作用, 通过检测小鼠血清炎症因子, 推测木芙蓉叶有效部位可能通过增加IL-2、IFN-γ浓度, 降低TNF-α含量方面的协同作用发挥抗RSV作用。但是, 木芙蓉叶有效部位对NK细胞、T细胞等如何调控细胞因子及影响RSV的哪个基因片段来发挥抗RSV作用, 需要进一步的研究。
| [1] |
李欢欢, 程伟, 刘社兰, 等. 呼吸道合胞病毒监测体系现状及展望[J]. 预防医学, 2019, 31(4): 359-362. |
| [2] |
邬科, 卢立琼. 木芙蓉叶的药理研究进展[J]. 海峡药学, 2010, 22(3): 37-38. |
| [3] |
张丽, 周长征. 木芙蓉叶的研究进展[J]. 中国医药指南, 2013, 11(1): 453-455. |
| [4] |
姚莉韵, 陆阳, 陈泽乃. 木芙蓉叶化学成分研究[J]. 中草药, 2003(3): 12-14. |
| [5] |
林振常, 陈启荣, 朱婉珍. 木芙蓉叶化学成分研究[J]. 浙江药学, 1985(1): 25. |
| [6] |
李军茂, 何明珍, 欧阳辉, 等. 超高效液相色谱与飞行时间质谱联用快速鉴别木芙蓉叶的化学成分[J]. 中国药学杂志, 2016, 51(14): 1162-1168. |
| [7] |
曾晓芳.木芙蓉根提取物抑菌及抗肿瘤作用的初步研究[D].福建医科大学, 2009.
|
| [8] |
李强, 张国宁, 张煊笛, 等. 呼吸道合胞病毒抑制剂的研究进展[J]. 中国医药生物技术, 2018, 13(6): 539-543. |
| [9] |
潘永刚, 刘晓志, 高健, 等. 呼吸道合胞病毒的治疗药物研发进展[J]. 现代药物与临床, 2018, 33(2): 433-438. |
| [10] |
孙运峰.木芙蓉叶总黄酮的提取纯化及其药效学的研究[D].山东中医药大学, 2011.
|
| [11] |
张丽.木芙蓉叶抗呼吸道合胞病毒的药效物质基础的研究[D].山东中医药大学, 2013.
|
| [12] |
付文彧, 罗仕华, 符诗聪, 等. 木芙蓉叶有效组分抗非特异性炎症的实验研究[J]. 中国骨伤, 2003(8): 31-33. |
| [13] |
刘晓红, 辛德莉, 侯安存, 等. 小鼠肺炎支原体肺炎模型的建立及组织病理学评分方法的应用[J]. 重庆医学, 2004(9): 1338-1340. |
| [14] |
Martin RJ, Chu HW, Honour JM. Airway Inflammation and Bronchial Hyperson Siveness after Mycoplasma Pneumoniaw Infection in a Murine Model[J]. Am J Reapir Cell MolBiol, 2001, 24: 577. DOI:10.1165/ajrcmb.24.5.4315 |
 2019, Vol. 33
2019, Vol. 33