能力验证是利用实验室间比对,按照预先制定的准则评价参加者的能力[1]。它是评价实验室技术能力的重要手段之一,是实验室内部质量控制方法的有效补充,也是维持机构间国际互认的基础之一[2-9]。
含量测定是中药质量标准中一个重要的检验项目,普遍采用高效液相色谱法。高效液相色谱法具有分离效率高、专属性强等特点,自1985年进入《中国药典》 [10]以来,已在中药质量控制中广泛应用。采用高效液相色谱法测定中药指标成分含量的影响因素较多,除人员、操作之外,样品前处理的填料[3]、色谱柱选择[11]等对测定结果的影响也不容忽视。中国食品药品检定研究院(以下简称“中检院”)在2013年、2015年分别组织了消炎利胆片和六味安消胶囊2个品种的含量测定能力验证活动,满意率均低于85%。
为了促进该项目检测能力的提高,国家食品药品监督管理总局于2017年再次组织了六味安消胶囊含量测定的能力验证项目,由中检院负责实施。本文总结了本次能力验证的相关工作,并对离群值进行技术分析,为参加实验室提高检验能力和质量管理水平提供参考。
1 能力验证方案 1.1 实验设计本次能力验证采用单一样品设计,供试品为六味安消胶囊,验证项目为含量测定,检测方法规定采用《中国药典》2015年版一部规定的高效液相色谱法,操作过程涉及对照品称量、对照溶液制备以及供试品回流提取、转移定容或补重等中药检测常用步骤,能够全面反映参加实验室在中药含量测定过程中的操作水平。
1.2 样品的制备及其均匀性和稳定性验证能力验证样品为自购市售样品,拆去包装,混匀,采用白色塑料瓶包装,20粒/瓶,共制备355瓶,标示,常温保存。
依据CNAS-GL03[12],能力验证样品在发样前应进行均匀性、稳定性考察。由于本次能力验证项目与2015年首次组织的六味安消胶囊含量测定能力验证的样品组成、包装、贮存条件均一致,根据2015年考察结果[11],认为样品满足稳定性要求。对样品的均匀性进行考察:随机抽取10瓶样品,每瓶重复检测2次,采用单因素分析法进行判断,结果表明样品的均匀性满足要求。
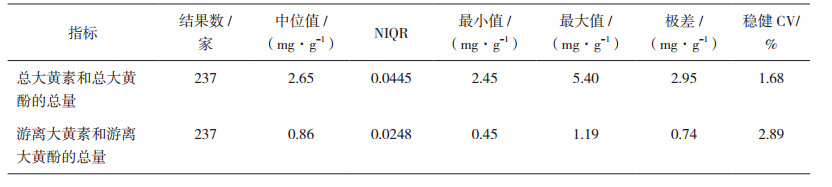
1.3 统计方法依据CNAS-GL02[13],采用稳健统计方法,以中位值为指定值,标准化四分位距为能力评定标准差,计算“总大黄素和总大黄酚的总量”以及“游离大黄素和游离大黄酚的总量” 2个指标的Z比分数,分别记为Z1、Z2。当|Z1| ≤2,且|Z2| ≤2时,为满意结果;当|Z1| ≤2,2<|Z2|<3或|Z2| ≤2,2<|Z1|<3时,为可疑结果;当|Z1|≥3或|Z2|≥3时,为不满意结果。
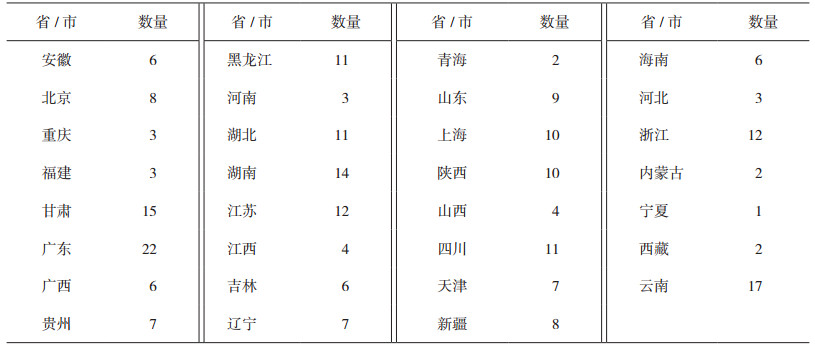
2 参加实验室情况全国31个省(市)、自治区共244家实验室报名参加本次能力验证计划,其中2家实验室由于自身原因中途退出,242家实验室反馈结果。实验室类型以各级食品药品检验机构为主(占87.2%),其中省级28家(占11.6%),地市级175家(占72.3%),县区级6家(占2.5%),部队药检机构2家(占0.8%);企业实验室27家(占11.2%);科研单位等其他实验室4家(占1.6%)。实验室所在地区的分布情况见表 1。
|
|
表 1 参加实验室的地域分布 |
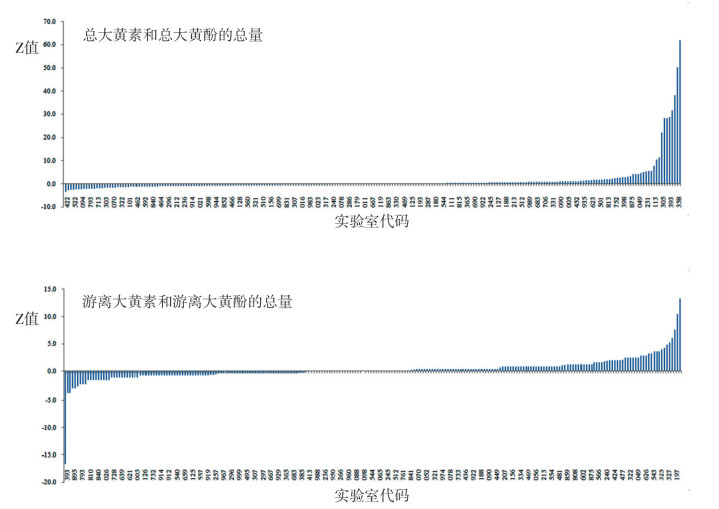
首先对242家实验室的反馈结果进行技术审阅,发现5家实验室存在计算错误,判为不满意结果,不再计入稳健统计分析。采用稳健统计方法处理剩余237家实验室的结果,统计结果见表 2,Z比分数柱状图见图 1。
|
图 1 能力验证结果的Z比分数柱状图 |
|
|
表 2 检验结果统计量汇总 |
全部反馈结果的242家实验室中,190家实验室的检测结果为“满意”,满意率为78.51%;18家实验室的结果为“可疑”,占全部结果的7.44%;34家实验室结果为“不满意”,不满意率为14.05%。
4 技术分析和建议 4.1 色谱柱选择高效液相色谱法具有灵敏、高效的特点,是各国药典普遍收录的常规分析方法,在含量测定、杂质分析等药品质控方面应用广泛。对于高效液相色谱法的建立与使用而言,色谱柱的选择非常重要。随着商品化色谱柱的快速发展,新的填料类型、粒径尺寸、结构类型不断涌现[14]。目前市场上的C18色谱柱已达到600余种。值得关注的是,不同品牌的C18色谱柱对待测成分的选择性可能不同,导致色谱峰保留时间、出峰顺序、分离度等出现较大差异[15-16]。在2015年首次组织的六味安消胶囊含量测定能力验证项目的实施中已经发现,色谱柱选择对测定结果影响很大[11]。进行“总大黄素和总大黄酚的总量”测定时,样品水解产生的杂质在某些色谱柱上会与目标成分大黄素共同流出,导致测定结果异常偏高。色谱柱选择依然是本次能力验证中导致不满意结果的最主要因素。在全部34家结果不满意实验室中,有10家存在此问题。
中国药典标准对色谱柱描述较为简单,实际工作中色谱柱的选择存在一定随意性,给药典方法的执行带来一定难度。如何对方法所使用的色谱柱进行描述也是各国药典面临的一个共同问题。具有借鉴意义的是美国药典、欧洲药典网站可为具体方法推荐色谱柱或提供方法开发时使用的色谱柱型号,给实验者提供参考。此外,美国药典网站上还提供色谱柱选择的USP数据库和PQRI数据库(http://apps.usp.org/app/USPNF/columnsDB.html),可对不同色谱柱进行比较,为替代色谱柱的选择提供依据。
中药成分多样、基质较为复杂,对色谱柱的分离能力要求较高。建议研究者在标准开发时加强色谱柱耐用性的考察,相关部门可考虑对复杂品种所需的色谱柱进行分类研究并建立列表,以指导色谱柱选择。各级药品检验部门也应高度重视色谱柱选择性对测定结果的影响,对重要的测定结果使用性质差异较大的色谱柱进行验证,减少假阳性或假阴性结果的产生。
4.2 对照品称定《中国药典》凡例[17]中明确规定,“精密称定系指称取重量应准确至所取重量的千分之一”。依据此项规定,如果采用十万分之一天平称取对照品,称样量应不得低于10 mg。在本次能力验证中发现,多个实验室在检测中使用十万分之一天平称定对照品,而称样量却远低于10 mg,其中最低仅为0.83 mg,不满足药典对精密称量的要求,引入较大的操作误差。建议检验人员加强对照品称定操作规范性的认识。
在本次能力验证中,部分实验室未严格按照精密称定的要求操作,但其测定结果仍在正常范围内。在称量精度不能满足需要时,会直接影响测量结果的不确定度,从而增加结果出现偏差的概率,但单次测定结果仍有一定的概率处于正常范围。不能因为单次结果未出现明显偏差而降低对操作的要求。这也应引起各检测单位的注意。
4.3 对照品溶液制备本项目使用每1 mL含大黄素8 g、大黄酚16 g的混合溶液作为对照品溶液,以甲醇为溶剂。实验中发现大黄素和大黄酚在甲醇中的溶解度有限,为了确保对照品溶解完全,宜选择体积较大的容量瓶(如100 mL)首先制备得到储备液,再经稀释得到所需浓度的对照品溶液。储备液制备过程中可以逐步加入溶剂,多次超声助溶。在定容前,应确保对照品完全溶解。可仿照注射剂可见异物的检测方法,先将溶液振摇,再于充分光照下观察是否存在下沉的细小固体颗粒,来判断溶解情况。
本项目部分不满意实验室存在对照品溶液初始制备浓度过高的情况,可能存在对照品溶解不完全而导致测定结果偏离。如果在标准执行过程中对指标成分的溶解性缺乏经验,建议以标准规定浓度为参照,避免出现溶解问题。
4.4 计算错误本项目中,5家实验室的不满意结果由计算错误导致,包括误将结果以“mg·粒-1”计(作业指导书要求以“mg·g-1计”)以及样品或对照品的稀释倍数错误。建议今后严格遵循作业指导书要求,加强检测结果的复核,避免此类失误发生。
4.5 其他个别实验室以量筒完成标准中的“精密量取”步骤,不符合药典凡例的要求;1家实验室在检测中未进行色谱峰定位,导致游离和水解样品大黄素、大黄酚含量结果完全错误。
5 总结本次能力验证项目242家实验室反馈了结果,其中190家实验室的结果满意,满意率达到78.51%,与2015年首次组织的六味安消胶囊含量测定能力验证67.10%的满意率相比,有了大幅提高,体现出能力验证活动对实验室检测技术水平的促进和提高作用。同时,14.05%的实验室结果不满意;本文对参加实验室可能存在的技术失误进行分析,建议不满意实验室结合自身情况,按照CNAS有关规定,查找偏离的原因,并在今后的检验中改正。
| [1] |
中华人民共和国国家标准GB/T 27043-2012/ISO/IEC17043: 2010合格评定能力验证的通用要求[S]. 2010.
|
| [2] |
魏京京, 宁保明, 何兰, 等. 水杨酸片溶出度测定能力验证的结果分析[J]. 中国药事, 2014, 28(12): 1327-1330. |
| [3] |
王明娟, 何风艳, 郑笑为, 等. 消炎利胆片中穿心莲内酯、脱水穿心莲内酯及其总量测定能力验证项目的结果分析[J]. 中国药事, 2014, 28(9): 981-985. |
| [4] |
高家敏, 李红霞, 项新华, 等. 化妆品中地塞米松检验能力验证研究[J]. 中国药事, 2017, 31(9): 1017-1020. |
| [5] |
王波林, 杨美成, 陈祝康, 等. 药物中有效成分含量测定能力验证项目研究[J]. 药学学报, 2012, 47(6): 769-772. |
| [6] |
陆明, 沈漪, 孙梦宇, 等. 药品中水分测定的实验室能力验证[J]. 药物分析杂志, 2014, 34(12): 2235-2239. |
| [7] |
庾莉菊, 魏京京, 黄海伟, 等. 浅谈药物溶出度测定能力验证项目的实施、作用及建议[J]. 中国药学杂志, 2016, 51(20): 1803-1806. |
| [9] |
张会亮, 黄传峰, 孙珊珊, 等. 米粉中六六六农药残留测定的能力验证研究[J]. 食品安全质量检测学报, 2017, 8(7): 2453-2457. DOI:10.3969/j.issn.2095-0381.2017.07.014 |
| [10] |
孙会敏, 田颂九. 高效液相色谱法简介及其在药品检验中的应用[J]. 齐鲁药事, 2011, 30(1): 38-41. |
| [11] |
王明娟, 刘雅丹, 胡晓茹, 等. 色谱柱选择对六味安消胶囊中大黄素和大黄酚含量测定的影响[J]. 色谱, 2016, 34(11): 1077-1083. |
| [12] |
CNAS-GL03能力验证样品均匀性和稳定性评价指南[S]. 2006.
|
| [13] |
CNAS-GL02能力验证结果的统计处理和能力评价指南[S]. 2014.
|
| [14] |
洪小栩, 石莹, 宋雪洁, 等. 液相色谱柱进展及其在药品标准中的应用[J]. 药物分析杂志, 2017, 37(2): 191-201. |
| [15] |
叶六平, 孙磊, 王明娟, 等. 等效色谱柱选择在大黄和补骨脂多成分高效液相色谱分析中的应用[J]. 药物分析杂志, 2015, 35(6): 945-953. |
| [16] |
Wang Mingjuan, Dai Zhong, Ma Shuangcheng, et al. Rational Column Selection Approach for Purity Determination of Chemical Reference Standards of Natural Products Based on a Column Characterization Database[J]. Chin J Chromatogr, 2017, 35(2): 196-202. DOI:10.3724/SP.J.1123.2016.07013 |
| [17] |
中国药典: 四部[S]. 2015: XIV.
|
 2018, Vol. 32
2018, Vol. 32