在体外受精胚胎移植过程中,胚胎在不同阶段会接触不同种类的培养液,体外生殖培养液作为体外受精胚胎移植技术所需的必备医疗器械,其安全性、有效性必须得到控制。培养液的配方研究及配制是一项较为复杂的工作,一方面要模拟人体的自然生理环境,为生殖细胞提供最优的生存环境,另一方面还要保证对胚胎、婴儿无不良影响。
N(2)-L-丙氨酰-L-谷氨酰胺(L-Ala-L-Gln)是一种营养物质,在体内分解为L-谷氨酰胺和L-丙氨酸,其中L-谷氨酰胺(L-glutamine,Gln)是一种条件必需氨基酸,具有提供细胞生长的能量,减少促炎症因子的释放,增加抗炎细胞因子表达,促进蛋白合成,改善氮平衡,提高免疫力等作用[1-5]。
Gln通过代谢形成谷氨酸和α-酮戊二酸,从而进入三羧酸循环(Tricarboxylic Acid Cycle,TCA循环),为细胞提供能量[6]。在商业化的细胞培养液中,Gln的含量一般是2~6 mmol· L-1,远大于其他氨基酸。由于Gln水溶解度低,在水中溶解度为每100 mL溶解3.5 g,且对热不稳定,在加热状态下易降解为有毒的焦谷氨酸和氨[7],氨对细胞生长起到抑制作用[8-9],故单纯在培养液中加入Gln,会使培养液的保质期缩短,且质量不稳定。人们为了解决这一问题,选择在培养液中加入L-Ala-L-Gln用以替代Gln[10],L-Ala-L-Gln的加入不仅提供了细胞培养所需的Gln,其本身热稳定性好,不会受热分解,可以直接采用加热灭菌,保证了培养液的质量。因此,通过准确快速地测量胚胎培养液中的L-Ala-L-Gln含量,可以确保培养液能够达到使用要求,有助于提高体外生殖技术的成功率。
目前检测L-Ala-L-Gln较为常见的方法是氨基柱直接测试或柱前衍生法,通过液相色谱仪进行检测[11-14],检测时间较长,适用于L-Ala-L-Gln注射液的检测,对成分较复杂,含有多种氨基酸的人类辅助生殖技术用液并不适用。因此,本文采用液相色谱-三重四级杆质谱联用法检测体外生殖培养液中L-Ala-L-Gln,无需衍生化,检测速度快,大大提高了检测效率,可作为分析培养液中L-Ala-LGln的一种方法。
1 仪器与材料岛津LCMS-8060三重四级杆质谱仪,配备电喷雾离子源;岛津LC-30A超高效液相色谱仪,包括LC-30AD×2输液泵,DGU-20A5在线脱气机,SIL-30AC自动进样器,CTO-20AC柱温箱,CBM- 20A系统控制器;Sartorius CP225D电子天平;日立CR21G冷冻离心机;IKA VORTEX GENIUS3振荡器;密理博Milli-Q超纯水仪。
N(2)-L-丙酰胺-L-谷氨酰胺对照品,中国食品药品检定研究院,批号:140702-201503,99.7%;2个厂家含N(2)-L-丙酰胺-L-谷氨酰胺的6种人类辅助生殖技术用液,乙腈(色谱纯)购自Fisher Scientific公司,甲酸(色谱纯)购自MERCK公司。
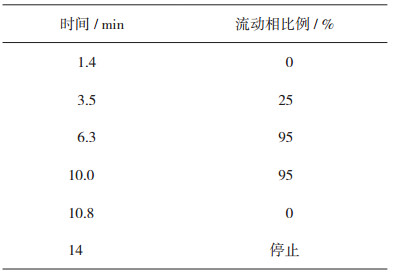
2 方法和结果 2.1 色谱条件色谱柱:SUPELCO Discovery HS F5-3(150 mm×2.1 mm,3 μm),流动相:体积分数为0.1%甲酸水溶液(A)-体积分数为0.1%甲酸乙腈溶液(B),梯度洗脱程序见表 1;流速:0.35 mL·min-1;柱温:40 ℃;进样量:1μL。
|
|
表 1 流动相梯度洗脱程序 |
离子源:电喷雾离子源;离子检测方式:多反应监测;离子极性:负离子;离子源接口电压:-3.0 kV;雾化气:氮气,3.0 L·min-1;干燥气:氮气,10 L·min-1;加热气:空气,10 L·min-1;碰撞气:氩气;脱溶剂管温度:250 ℃;加热模块温度:400 ℃;接口温度:300 ℃;L-Ala-L-Gln的质谱分析条件参数见表 2。
|
|
表 2 质谱分析参数 |
精密称定L-Ala-L-Gln对照品0.0128 g,置10 mL容量瓶中,加水定容至刻度,浓度为1276μg·mL-1。精密量取1.0 mL置10 mL容量瓶中,定容至刻度,得到浓度为127.6μg·mL-1的储备液。取储备液依次稀释为1.276、3.190、6.380、9.570、12.76 μg·mL-1的系列标准溶液。
2.4 供试品溶液配制取培养液200 μL,加200 μL乙腈,混匀后,15000 r·min-1离心1 min,取上清液稀释10倍后,用0.45μm滤膜过滤,取滤液作为供试品溶液。
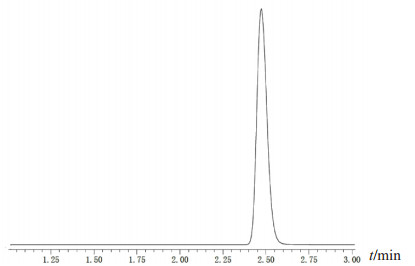
2.5 方法学考察 2.5.1 专属性试验分别取空白溶剂-纯化水、对照品溶液各1μL注入液质联用仪,依上述色谱条件进行检测,记录总离子流图,见图 1至图 3。结果显示除标准品的峰外未出现其他杂质峰。
|
图 1 N(2)-L-丙酰胺-L-谷氨酰胺MRM空白对照色谱图 |
|
图 2 N(2)-L-丙酰胺-L-谷氨酰胺MRM色谱图 |
|
图 3 N(2)-L-丙酰胺-L-谷氨酰胺质谱图 |
取对照品系列溶液进样,以浓度为横坐标,峰面积为纵坐标,进行线性回归,结果表明L-Ala-LGln在所测定的浓度范围内线性关系良好,线性范围为1.276~12.76μg·mL-1,线性方程:
y= 4×10-6x + 0.1336 r=0.9997
2.5.3 精密度试验取浓度为6.380μg·mL-1的对照品溶液,按上述色谱条件,连续进样6次,测得L-Ala-L-Gln的精密度良好(RSD=0.74%)。
2.5.4 稳定性考察取浓度为6.380μg·mL-1的对照品溶液,按上述色谱条件,在制备后室温放置,分别在2 h、4 h、24 h各进样两次,考察稳定性,结果表明L-Ala-L-Gln在配制好后室温下可稳定放置24 h (RSD=1.27%)。
2.5.5 回收率样品回收率试液:精密量取含L-Ala-L-Gln4.331μg·mL-1的样品1 mL,加入浓度为6.380μg·mL-1的对照品溶液1 ml,混合均匀,作为样品回收率试液。平行制样6份,按上述色谱条件进样测试,计算回收率,回收率结果在100.5%~103.0%,RSD=1.98%。
2.6 样品测定取不同厂家的培养液,按“2.4”节方法处理后,进样测试,结果见表 3。
|
|
表 3 L-Ala-L-Gln在不同培养液中的含量 |
现阶段,测量L-Ala-L-Gln多采用三种仪器,分别为高效液相色谱仪(HPLC)、氨基酸分析仪(AAA)及高效液相色谱串联质谱仪(HPLC-MS)。HPLC法是最普及的检测方法,通过对L-Ala-L-Gln衍生化后进行分析,适合工业化检测,但由于衍生化需手工操作,且L-Ala-L-Gln分离效果差,培养液中的其他氨基酸会干扰其精确定量,分析时间也较长(每个样本约用1小时)。AAA法采用在线衍生化,降低了人为影响因素,但其本质为HPLC,因此分析时间同样较长,分离效果无显著提升。HPLC-MS分析时间短,分离效果好,可以进行高通量检测,且重复性好,笔者采用多通道液相三重四级杆质谱联用法分析L-Ala-L-Gln,专属性强,即使色谱柱无法完全分离,在质谱检测器中,L-Ala-L-Gln与其他氨基酸也不互相干扰。同时,由于其兼顾了液相的特点,测试范围宽,样品稀释倍数较少,在提高了定量准确性的同时,也大幅缩短了检测时间。
本次试验建立的方法符合方法学验证要求,检测结果准确,重复性好,回收率高。在同一色谱条件下,仅需对培养液进行除蛋白处理,即可快速完成L-Ala-L-Gln的含量测定,提高了检测的工作效率。在不同作用的体外生殖培养液中,L-AlaL-Gln含量也不同,对比检测结果与投药量,本试验的检测结果均在标示含量允许范围内。
通过对比不同种类培养液中L-Ala-L-Gln的投药量,可以看出生产企业A对不同的培养液加入了相同浓度的L-Ala-L-Gln,生产企业B则加入了不同浓度的L-Ala-L-Gln。生产企业一般会根据细胞培养的试验结果设计调整自己的培养液配方,不同配方的效果不在本次试验的评价范围内,但可以通过本试验提供的方法,实时监测培养液中L-AlaL-Gln的消耗量,调整不同作用的体外生殖培养液中L-Ala-L-Gln的投药量,优化培养液配方,提高体外生殖技术的成功率。
本研究通过建立测试体外生殖培养液中L-AlaL-Gln的方法,测定了几种商业化胚胎培养液中L-Ala-L-Gln的含量,结果表明本方法具有可行性。本方法取样量仅为1 μL(如含蛋白则需100 μL),取样量小,适合胚胎培养过程中实时监测,为配方筛选及改进提供帮助。更适合于在胚胎培养中连续取样分析。同时,培养液中还含有蛋白质、抗生素、抗凝剂、维生素及无机盐类[15-16],各种成分联合起到促进细胞和胚胎发育、保持活力等多种作用。本次试验仅检测了培养液配方中的一类成分,有必要在后续的工作中逐步建立培养液中其他成分的含量测定方法,对培养液进行有效的质量控制,并尽早建立相关的质量控制标准,提高辅助生殖技术的成功率。
| [1] |
庄广伦. 辅助生殖技术的发展历程[J]. 中国实用妇科与产科志, 2010, 26(10): 729-731. |
| [2] |
张婷, 王晓民. 体外受精与试管婴儿-2010年诺贝尔生理学或医学奖简介[J]. 首都医科大学学报, 2010, 31(5): 678-682. DOI:10.3969/j.issn.1006-7795.2010.05.035 |
| [3] |
梅志强. 人类辅助生殖技术的发展历史与现状[J]. 中国计划生育学杂志, 2008(10): 584-586. DOI:10.3969/j.issn.1004-8189.2008.10.003 |
| [4] |
Wilmore DW, Smith RJ, O'Dwyer ST, et al. The Gut:A Central Organ after Surgical Stress[J]. Surgery, 1988, 104(5): 917-923. |
| [5] |
Bruke D, Alverdy JC, Aoys E, et al. Glutamine Supplemented Total Parenteral Nutrition Improves Gut Immune Function[J]. Arch Surg, 1989, 124(12): 1396-1399. DOI:10.1001/archsurg.1989.01410120042009 |
| [6] |
Hong RW, Rongds JD, Helton WS, et al. Glutamine Preserves Liver Glutatione after Lethal Hepatic Injury[J]. Ann Surg, 1992, 215(2): 114-119. DOI:10.1097/00000658-199202000-00004 |
| [7] |
Kircher B. The Role of L-Alanyl-L-Glutamine in the Immune Response in vitro[J]. Wien Klin Wochenschr, 2002, 114(15-16): 702-708. |
| [8] |
Muhling J. Efects of Arginine, L-Alanyl-L-Glutamine or Taurine on Neutrophil (PMN) Free Amino Acid Profiles and Immune Functions in vitro[J]. Amino Acids, 2002, 22(l): 39-53. |
| [9] |
Street JC, Dlort AM, Braddock PS, et al. A1H/15N N.M.R Study of Nitrogen Metabolism in Cultured Mammalian Cells[J]. Biochem J, 1993, 291(Pt 2): 485-492. |
| [10] |
Tritsch L, More GE. Spontaneous Decomposition of Glutamine in Cell Culture Media[J]. Exp Cell Res, 1986(28): 196. |
| [11] |
Atanassov C, Seiler N, Rebel G. Reduction of Ammonia Formation in Cell Cultures by L-Alanyl-L-Glutamine Requires Optimization of the Dipeptide Concentration[J]. J Biotech, 1998(62): 159-162. |
| [12] |
Lane M, Gardner DK. Ammonium Induces Aberrant Blastocyst Differentiation, Metabolism, pH Regulation, Gene Expression and Subsequently Alters Fetal Development in the Mouse[J]. Biol Reprod, 2003(69): 1109-1117. |
| [13] |
廖海明, 任雪, 杨红淼, 等. 首批N(2)-L-丙氨酰-L-谷氨酰胺国家对照品的研制[J]. 中国药事, 2013, 27(9): 959-962. |
| [14] |
朱曙东, 赵皓. 氨基酸的高效液相色谱分析[J]. 色谱, 1994(1): 20-24. |
| [15] |
谭力, 刘放南, 张旭松. 人胃粘膜中γ-氨基丁酸和谷氨酸含量的高效液相色谱法测定[J]. 色谱, 2004(2): 131-133. DOI:10.3321/j.issn:1000-8713.2004.02.009 |
| [16] |
张云楚, 王丹丹. 柱前衍生化HPLC法测定N(2)-L-丙氨酰-L-谷氨酰胺注射液的含量[J]. 中国生化药物杂志, 2006(6): 364-366. DOI:10.3969/j.issn.1005-1678.2006.06.014 |
| [17] |
Herrick JR, Bond JB, Magarey GM, et al. Toward a Feline-Optimized Culture Medium:Impact of Ions, Carbohydrates, Essential Amino Acids, Vitamins, and Serum on Development and Metabolism of in vitro Fertilization-Derived Feline Embryos Relative to Embryos Grown In Vivo[J]. BiolReprod, 2007(76): 858. |
| [18] |
王增艳, 何方方, 孙正怡, 等. 冷冻环玻璃化法冷冻小鼠卵母细胞的效果评价[J]. 生殖医学杂志, 2008, 17(1): 38-42. DOI:10.3969/j.issn.1004-3845.2008.01.011 |
| [19] |
李宗武, 朱传金, 刘庆勇. 人血浆及精浆中钙、镁、锌、铜对精液成分的影响[J]. 国外医学:医学地理分册, 2004, 25(3): 124-126. |
 2018, Vol. 32
2018, Vol. 32