新药上市前的临床试验一般由三方负责:药企、临床试验机构和医疗研发外包服务机构CRO(Contract Research Organization,以下简称CRO)。规范严谨、数据可靠的临床试验,不仅是药品上市前的一道关键安全屏障,也是药监部门是否批准药物上市的核心依据[1]。然而在我国,药物临床试验数据造假的问题依然存在。如何切实加强对临床试验数据的管理,保证数据的真实有效,成为药监部门和学术界积极探索的一个热点问题。
本文以药物临床试验数据清理为主要研究对象,通过对已有文献的搜集与梳理,找出我国现阶段药物临床试验数据清理存在的问题,在借鉴国外发达国家经验的基础上,提出了我国实施药物临床试验数据清理的对策和建议。
1 药物临床试验数据管理概述 1.1 药物临床试验数据管理的含义药物临床试验数据管理,是指研究者按照临床试验方案规定的流程采集大量的研究数据,利用标准数据库,采用计算机辅助人工进行数据核查、数据疑问和清理、数据盲审和锁定等研究过程。其目的是及时、有效和准确地提供科学可靠的临床数据供临床研究[2]。
1.2 药物临床试验数据的管理流程药物临床试验数据管理的流程包括下列环节,具体见图 1。
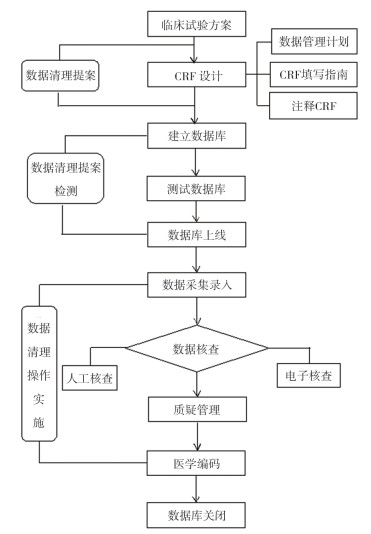
|
图 1 药物临床试验管理流程 |
1)CRF设计。临床试验依赖于病历报告表(Case Report Form,简称CRF)收集来的各种临床试验数据信息。因此,CRF必须能够全方位地反映出临床试验方案里要求的所有临床数据。CRF下设3个工作内容,包括数据管理计划、CRF填写指南、注释CRF。数据管理计划包括整个临床试验进程的时间点管理和相关人员的职责。CRF填写指南是根据研究方案对CRF数据点提出的具体填写说明。注释CRF记录了每个数据项的位置及其在对应的数据库中变量的名称和编码。
2)建立数据库。每个临床试验方案都有其特殊性,数据库应以CRF为基础,建立特定的标准数据库来确保CRF收集到的信息能被正确储存。
3)测试数据库。应确认数据管理员测试数据库功能是否与CRF的要求一致。包括数据录入页面设计、方式顺序、数据点顺序等。
4)数据库上线。当数据库按CRF要求开发完毕,数据管理人员确认了数据库设计开发的步骤并成功通过测试后,数据库就可以成为电子数据采集(Electronic Data Capture,简称EDC)系统,成功上线使用。
5)数据采集录入。数据来源于临床试验受试者的病历日志、身体检查等信息。采集后可通过人工录入或者自动传送进入数据库。
6)数据核查。临床数据管理团队根据临床试验方案要求,在规定时间内对数据进行正确性和完整性核查。数据核查又分为人工核查和电子核查。
7)质疑管理。数据核查后产生的质疑或问题,将通过数据库或以纸质版的形式通知临床试验研究者或临床监查员。待质疑得到回复后,要对数据进行修改。
8)医学编码。由具备临床医学知识的医学编码员将CRF中收录的关键性数据(如受试者病情历史、用药后的不良反应等)与标准字典中的词目进行匹配。标准字典通常采用ICH(人用药品注册技术规范国际协调会)开发的国际医学用语词典(Medical Dictionary for Regulatory Activities,简称MedDRA)、世界卫生组织药物词典(WHO Drug Dictionary)、世界卫生组织不良反应术语集(World Health Organization Adverse Reaction Terminology,简称WHOART)等。
9)数据库关闭。临床试验结束后,为防止数据库文档被无意或者未授权更改,临床数据管理团队需对数据库进行关闭。
1.3 药物临床试验数据管理的重要性临床研究的科学性结论是建立在高质量数据基础之上的,其数据管理尤为重要。一旦临床数据出现错误和缺失,临床研究就无法得到科学可靠的结论,就会使临床试验研究中的所有参与者,包括受试者、研究者、申办者及CRO等成员蒙受巨大的人、物、财损失,甚至导致受试者致畸、致残和死亡等严重后果[2]。
2 药物临床试验数据清理概述数据清理是临床试验数据管理工作的重要方面,临床试验的每个阶段都需要进行数据清理,其贯穿了临床试验数据管理的多个环节,见图 1。
2.1 药物临床试验数据清理的含义药物临床试验数据清理是指在临床试验数据核查过程中对发现的缺失数据或问题数据进行处理。处理方式有两种,内部解决和外部解决。内部解决是指该项目数据管理专员根据CRF的填写做出判断,解决问题。外部解决是指由项目数据管理员就问题数据对临床协调员或研究者发出质疑,通过对质疑的回答解决差异数据[3]。
2.2 药物临床试验数据清理的重要性通过高效的临床试验数据清理,研究者可以实时了解临床试验的进展情况,掌握临床试验过程中数据的变化趋势,保证临床试验结果的准确性和客观性,支撑整个临床试验结论的科学性和可靠性,为临床试验所有参与者实现最大效益。
2.3 药物临床试验数据的清理流程临床数据清理的目的在于保证数据的完整性、有效性和正确性。操作前,需对临床数据清理进行提案,根据临床试验方案的要求和CRF设计来制定详细的数据清理计划提案。提案应包括规定数据清理的时间点、缺失和重复数据的处理、相应事件的逻辑核查、外部数据与CRF收集的数据一致性核查等内容。
数据清理提案完成后,需要在数据库中进行检测。将数据清理提案的内容通过数据库体现出来,保证数据库中的变量规则与数据清理提案一致。
数据清理提案检测通过后,当数据录入后,根据数据清理提案的时间点对数据进行排查,配合EDC系统,对问题数据进行标记核查,通过发送质疑的形式传达给研究者或者临床监查员,得到符合逻辑的回复,按照回复进行问题数据的修改。
当所有的问题数据通过质疑管理步骤得到解决后,需要对CRF中的数据进行专业术语转化,保证数据的标准化。
3 我国药物临床试验数据清理现状及存在的问题 3.1 法律规范方面为了保证药物临床试验的质量,我国于2003年发布了《药品临床试验质量管理规范》(Good Clinical Practice,简称GCP)。GCP第四章第十七条指出,需要制定数据管理和数据可溯源性的规定;第五章第二十七条指出,研究者应保证数据真实、准确、完整、及时、合法地载入病历和病历报告表;第七章第四十七条(三)指出,应确认所有数据的记录与报告正确完整,所有病历报告表填写正确,并与原始资料一致;第十一章第六十二条指出,临床试验中所有观察结果和发现都应合适,在数据处理的每一阶段必须进行质量控制,以保证数据完整、准确、真实、可靠[4]。为了确保临床试验数据结果的准确可靠和科学性,又于2013年出台了《临床试验数据管理工作技术指南》,进一步强化临床数据管理,填补了临床数据清理工作技术指导的空白。但该指南只是对我国临床试验数据管理工作流程的规制,并未提出相应的界限以及质量要求。现有临床数据清理方面的规范化文件仍无法满足快速发展的临床试验需要,使新药的安全性和有效性评价出现问题和偏差。
3.2 监督管理方面我国药监部门尚未对临床试验数据开展系统性的监管工作,更多的是由申办方请伦理委员会进行定期稽查。伦理委员会的稽查工作定期进行,意味着每隔一段时间后才会对临床项目的进程进行监察。这种稽查方式无法保证药监部门于第一时间获得数据的总体质量;同时,也无法对临床试验数据中发生的方案偏离或不当操作进行及时纠正,容易导致临床试验项目的进程受到阻碍。
3.3 数据采集电子化方面目前,国内已陆续推出多种临床试验EDC系统,逐步适应了我国GCP和《临床试验的电子数据采集技术指导原则》要求。众多临床试验项目也已采用EDC系统进行数据清理,有利于及时发现“问题”和缺失数据等情况。当数据进入EDC系统后,违背标准的数据就会出现差异。其中,逻辑相对简单的数据差异可以根据EDC系统内部的自动核查发现问题;但这种内部自动核查是在逻辑简易且重复率高的情况下使用的,当出现逻辑复杂的数据清理时,其内部自动核查功能就显示出不足之处[3]。
3.4 人才队伍建设方面临床数据收集极易出现受试者数据缺失和数据源错误等问题,因此,数据收集人员和数据清理人员起着非常关键的作用,临床试验数据清理团队的专业素质亟待提高。另外,国内药企缺乏规范化的质量管理体系,亦使得数据清理工作存在一些制度性的障碍。
4 国外典型国家或地区药物临床数据清理的经验借鉴 4.1 美国临床试验数据的清理在美国,药品上市前后临床数据等安全信息的收集、分析和监管是药物临床试验的重要内容。美国对药物安全性方面的临床数据管控十分严格,其出台的临床研究数据质量管理规范(Good Clinical Data Management Practices,简称GCDMP),明确规定了临床数据清理工作的一系列操作规范,其中包括:数据质量要求、数据核查、EDC的用法规定、数据清理计划等,为临床数据的质量提供了保证,对临床试验项目的顺利开展具有极大的促进作用。
美国临床试验数据清理值得借鉴的具体做法有3个方面:
1)设置数据可信区间,保证数据质量。由生物统计部门给出分析模型,确定关键数据和次要数据的可信区间,超出可信区间的数据需要研究者给出相应的解释[5]。
2)确保数据和报告质量。数据经理和生物统计人员应紧密配合,保证收集的安全性数据符合分析要求,减少临床试验数据清理工作的负担,确保根据数据得出的安全性报告科学、真实[6]。
3)关键数据的处理。所有的临床试验项目研究都需要使用实验室检查数据等关键数据点,这些关键数据点来源于试验中心和实验室(试验中心以外的特定检查机构)。由于两者遵循的检查标准不同,往往导致关键数据点无法统一,影响了数据的质量。因此,美国制定了标准操作规程(Standard Operating Procedure,简称SOP)来确保实验室数据的采集、转换和核查符合SOP要求,减少了机构间的数据范围差别,遵循医学规范,保证所有的数据转换规范化[5]。
对于临床试验数据清理工作,美国做到了有据可循、有法可依。其GCDMP由非营利组织发起,并获得了行业的一致好评,提高了临床试验清理的效率和规范化水平。
4.2 日本临床试验数据的清理日本与中国的GCP法规有很多相似之处,同时也有各自的优势和特点。在数据清理工作检查方面,日本更为完善。
日本临床试验数据清理值得借鉴的具体做法有以下两个方面:
1)相关法规文件更新及时。日本对于数据管理工作要求很高,平均每隔3年就会更新相关法规,并同时发布法规的官方解释,逐条进行详细说明,临床试验数据清理法规可操作性较强[7]。
2)审查要求明确。对临床试验数据清理工作有专门的机构负责检查,并对临床试验的进展和数据一致性进行检查,保证数据可溯源。审查分为现场审查和适合性书面审查,且由不同小组分别进行审查。在现场对试验的原始数据与CRF进行一致性审查,避免人为的数据造假。
4.3 欧洲临床试验数据的清理欧洲目前面临的挑战主要是临床试验报告结果更多地涉及到欧洲以外的人群试验。由于欧洲人群种族和非欧洲种族因素对药物疗效或安全性有影响作用,可能出现的差异和需要重视的问题逐渐突显,数据清理工作需要进行权衡[8]。因此,欧盟出台了ICH E5等相关法规来补充支持临床数据方面的工作。ICH E5指南对欧洲内外种族因素进行了明确定义,准确区分试验人群,并对不同种类药物试验进行统计分类,对不同的人群进行身体因素研究,保证临床数据清理计划的设计具有可行性和前瞻性。
5 我国药物临床试验数据清理的对策与建议 5.1 完善药物临床试验数据清理法规,加强监管尽管我国已经出台了多部关于临床试验的法律规范,但针对临床数据清理的法规还不够完善。由于临床数据来源广泛、形式多样,在录入和传递过程中难免发生错误,造成数据误差,因此,相关监管部门对临床试验数据的质量应该进行彻底稽查和评估。这就需要食品药品监督管理部门和相关企业共同商讨制定出符合行业实际的临床数据清理法规,对临床数据清理限度和关键数据点做出审批要求,为数据清理提供有力地保障。
5.2 保障EDC系统内数据的安全目前,我国的EDC系统对于数据安全性仍缺乏行之有效的保障措施。为避免发生数据安全性风险,EDC系统应该设立和完善数据安全保护机制,以便在意外状况发生时及时恢复数据或阻挡外来入侵。在药物临床试验中心的主服务器和数据库中也应建立健全数据保护系统,以防止受试者的病历数据外泄[9]。
5.3 设计方案专业化数据收集必须依靠EDC内的CRF模块,所以,CRF的设计成为数据采集源的关键所在。数据类型主要有文本型、日期型、数值型等,其中文本型数据无法实现自动核查功能,需要人工核查。提示CRF上的文本信息应做到尽可能的封闭,单一选择,或采用符合医学要求的专业统一术语,降低EDC系统自动核查的障碍,减轻数据清理人员的工作量,提高数据的正确性。
5.4 保障数据转换的标准化临床数据交换标准协会(Clinical Data Interchanges Standards Consortium,简称CDISC)是一个开放的、多学科的、全球性的非营利组织,其已建立了涵盖研究方案设计、数据采集与分析、数据交换与递交等一系列环节的标准。CDISC的核心标准共有九类,分别有用于向监管部门递交的内容标准、操作数据模型、数据字段收集的内容标准以及非临床数据转换标准等。CDISC标准使得不同的临床研究项目间的数据可以共享和交换,方便数据清理时统一报告递交标准,减少各个数据间的格式转换工作,该标准有利于设计合适的CRF,降低数据由于转换格式而出现的差异率。为此,我国亦应加以利用以保障数据转换的标准化。
5.5 培养高素质的专业化临床试验数据清理人员在临床数据进入生物统计分析阶段之前,需要有临床试验数据清理人员对数据进行清理和检查。虽然成熟的EDC系统有自动核查处理能力,但因其能力有限,仍然需要人工进行操作,高素质的专业临床数据清理人员是必不可少的。因此,建议定期为临床数据清理人员开展技能提升培训,全面提升数据清理人员的工作能力和素质。
| [1] |
旅医网. 国内新药试验数据造假严重, 你吃的药可能就这样上市的[EB/OL]. (2016-12-06)[2017-04-15]. http://www.sohu.com/a/110909951_400591.
|
| [2] |
谢高强, 姚晨. 数据管理在临床研究中的地位和作用[J]. 北京大学学报(医学版), 2010(6): 641-643. |
| [3] |
陈昕. 利用SAS优化不良事件数据的人工检查流程[D]. 上海: 复旦大学, 2013.
|
| [4] |
国家食品药品监督管理总局. 国家食品药品监督管理总局令第3号药物临床试验质量管理规范[S]. 2016.
|
| [5] |
SCDM. Good Clinical Data Management Practices 2013[EB/OL]. [2017-03-01]. http://scdm.org/publications/gcdmp/.
|
| [6] |
王雅倩, 杨悦. CDISC标准与临床试验数据标准化[J]. 中国医药指南, 2016(12): 296-297. |
| [7] |
邓亚中, 于嘉, 刘川, 等. 电子化时代临床数据管理现状和未来趋势[J]. 中国新药杂志, 2014(8): 879-884. |
| [8] |
EMEA. Extrapolation of results from clinical studies conducted outside Europe to the EU-population[EB/OL]. [2017-03-15]. http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_001237.jsp&mid=.
|
| [9] |
曹红波, 刘智, 李楠, 等. 药品上市后临床试验远程数据管理模式的架构[J]. 天津中医药, 2014(12): 730-734. DOI:10.11656/j.issn.1672-1519.2014.12.08 |
 2018, Vol. 32
2018, Vol. 32 