骨髓抑制是肿瘤化学治疗(简称化疗)血液系统常见的、可危及生命的毒性反应[1],化疗可致正常的骨髓造血干细胞、骨髓造血微环境受到损伤,造成骨髓抑制,外周血细胞减少,尤其是中性粒细胞和血小板的明显降低,严重者可致感染或出血,常常迫使患者中断或延期治疗,最终导致化疗的失败。因此,加强对该类患者的药学监护是临床药师保证药物安全、合理使用的重点。临床药师通过参与1例肝胆管细胞癌伴发重度骨髓抑制合并肺部感染患者的药学监护,分析探讨发生重度骨髓抑制及肺部感染的原因和相关防治措施,为临床药师进行药学监护提供参考。
1 病例摘要患者,女,44岁,身高159 cm,体重65 kg,体表面积1.70 m2,Karnofsky(卡氏,KPS,百分法)功能状态评分80分,疼痛0分。主诉“确诊肝脏肿瘤8个月,求化疗”于2015年6月8日入院。患者于2014年10月21日被确诊为肝内低分化胆管细胞癌并肝内、双肺、双肾上腺、肝门及腹膜后淋巴结转移,分别于2014年10月29日与2014年12月4日行经皮肝动脉介入术2次,术中给予奥沙利铂注射液0.15 g、氟尿嘧啶注射液1000 mg、表柔比星注射液50 mg动脉注射化疗,疗效评价肿瘤疾病部分缓解(partial response,PR),肝脏肿瘤、两肺转移瘤较前缩小、减少。第2次介入术后血常规示白细胞(WBC)5.3×109·L-1、中性粒细胞(NEU)3.15×109·L-1、血红蛋白(HGB)123 g·L-1、血小板(PLT)72×109·L-1,为Ⅱ度骨髓抑制,未行处理。2015年1月9日复查胸腹部CT示两肺多发转移瘤较前进展,故疗效评价肿瘤疾病进展(progressive disease,PD),于2015年1月14日至2015年3月26日给予三氧化二砷(10mg ivgtt d1-14,q21d)方案静脉化疗4周期,胸腹部CT示两肺多发转移较前进展,左侧胸腔新增较多积液,疗效评价PD。临床药师于化疗第5周期开始对其进行药学监护,根据2015年“胆管癌诊断与治疗-外科专家共识” [2],建议更换GP方案(吉西他滨+顺铂)化疗或加用重组人血管内皮抑制素等靶向药物联合治疗,医师采纳,于2015年4月21日与2015年5月13日予GP方案联合重组人血管内皮抑制素治疗2周期(具体方案:吉西他滨2 g ivd d1、8+顺铂30 mg ivgtt d1-3+重组人血管内皮抑制素15 mg ivgtt d1-14,q21d)。第2周期化疗后患者出现Ⅱ度骨髓抑制,血常规示WBC 2.9×109·L-1、NEU 1.24×109·L-1、HGB 92 g·L-1、PLT 87×109·L-1,予重组人粒细胞集落刺激因子(Granulocyte Colony-Stimulating Factor,G-CSF)治疗后骨髓抑制缓解,胸腹部CT提示两肺转移瘤较前缩小、减少,疗效评价部分缓解(partial remission,PR)。本次入院诊断:肝胆管细胞癌并肝内、双肺、双肾上腺、肝门及腹膜后淋巴结转移(cT4N1M1,Ⅳ期)。
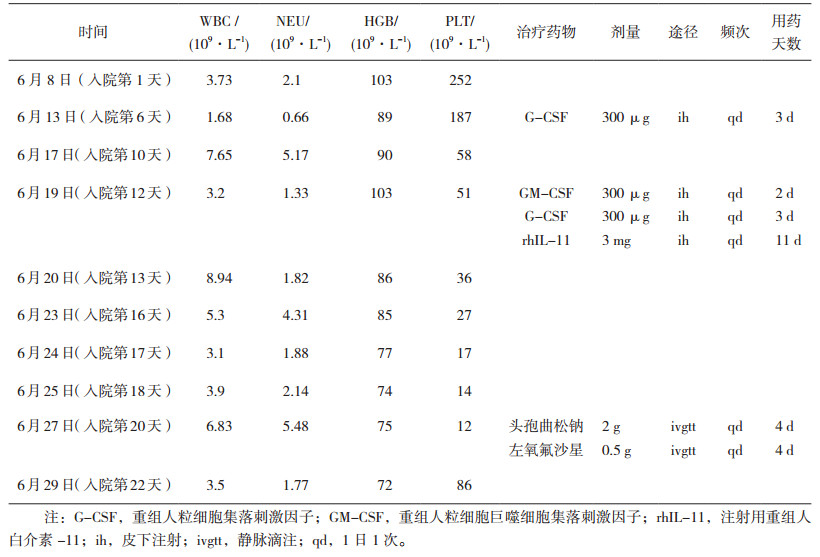
患者入院后,6月8日查血常规正常,肝肾功能、电解质等项均未见明显异常。根据KPS功能状态评分标准,评分≥70分,可予化疗,于6月9日(入院第2天)开始行第3周期GP方案联合重组人血管内皮抑制素治疗。6月13日(入院第6天),患者出现Ⅲ度骨髓抑制,予G-CSF(300 μg ih qd),连用3天。6月18日(入院第11天)粒细胞恢复正常,PLT 58×109·L-1,继续予吉西他滨第8天方案原剂量化疗。化疗后患者出现Ⅳ度骨髓抑制。6月26日(入院后第19天)开始出现反复发热,体温最高39.2℃,伴畏寒、头痛、咳嗽,予痰培养+真菌培养鉴定,CR胸片检查,并给予氯化铵、塞来昔布解热镇痛止咳等对症处理。6月27日(入院第20天)体温最高39.6℃。C-反应蛋白(CRP)157 mg·L-1、降钙素原(PCT)0.2 ng·mL-1,胸部CT示两肺纹理增多,两肺散在斑点状高密度影。予血培养鉴定,并给予头孢曲松钠(2 g ivd qd)联合左氧氟沙星(0.5 g ivd qd)抗感染治疗。6月29日(入院第22天)体温恢复正常,不适症状缓解。6月30日(入院第23天)PLT 86×109·L-1、CRP 108 mg·L-1,痰培养结果未见致病细菌及真菌生长。予停用头孢曲松钠与左氧氟沙星。7月3日(入院第26天)回报血培养5天结果无细菌生长。患者无不适出院。具体药物治疗与血常规变化情况,见表 1。
|
|
表 1 患者骨髓抑制与药物治疗情况 |
骨髓抑制可受许多因素影响,有文献研究[3],高剂量化疗、高毒性化疗、化疗前白细胞水平、KPS评分≤70分以及恶性肿瘤骨转移等均可影响或加重骨髓抑制反应。该患者KPS评分80分,尚未见骨转移,故分析其出现重度骨髓抑制的主要原因是受高剂量化疗、高毒性化疗以及化疗前白细胞水平的影响。
高剂量化疗:根据“2015年胆管癌诊断与治疗-外科专家共识” [2]“2014年美国肝胆胰学会共识声明:肝内胆管癌管理” [4]“2015年NCCN肝胆肿瘤指南(V2版)” [5]均推荐吉西他滨联合顺铂作为晚期胆管癌患者的一线化疗用药,故选用该方案。根据说明书,患者体表面积为1.70 m2,吉西他滨推荐剂量为1250 mg·m-2,顺铂推荐剂量为30 mg·m-2当中性粒细胞下降至0.5×109·L-1~1.0×109·L-1或血小板下降至50×109·L-1~100×109·L-1时,吉西他滨应减量至原剂量的75%使用。6月13日(化疗第5天)患者中性粒细胞下降至0.66×109·L-1,药师建议减量,但医生考虑粒细胞计数已恢复,仍按原剂量给予吉西他滨化疗,故给药剂量偏大,是导致骨髓抑制反应的主要原因之一。
高毒性化疗:骨髓抑制是化疗最常见的限制性毒副反应。该患者化疗前尚未使用药物,在给予GP方案联合重组人血管内皮抑制素治疗时出现骨髓抑制,故考虑该治疗方案也是导致骨髓抑制的主要原因。根据“肿瘤化疗所致血小板减少症诊疗专家共识(2013-2014版)” [6],吉西他滨与顺铂均可导致白细胞与血小板减少,且以吉西他滨对血小板的抑制作用最强[7],其发生时间详见表 2。而重组人血管内皮抑制素的主要不良反应为心脏毒性,孙婷等[8]对重组人血管内皮抑制素联合GP方案与GP方案的安全性进行Meta分析,结果表明,联用重组人血管内皮抑制素对GP方案所致骨髓抑制程度的影响无统计学意义。患者于化疗第5天出现Ⅲ度骨髓抑制,表现为白细胞与中性粒细胞的减少(见表 1),根据表 2,GP方案中吉西他滨引起白细胞下降时间为7~14天,而顺铂一般于用药后第18~23天发生,由于多程化疗史等因素亦可使骨髓抑制程度加重、时间提前,故可推断吉西他滨所致的可能性较大。予G-CSF纠正后,白细胞恢复正常值,临床医生以原剂量继续给予吉西他滨化疗。患者化疗后出现Ⅳ度骨髓抑制,主要以血小板的持续下降为主。在给予G-CSF、rhIL-11治疗的情况下,于6月24日(化疗后第14天)下降至最低点,故化疗后的骨髓抑制考虑为吉西他滨与顺铂所致。由于GP方案联用的给药顺序与毒性反应具有相关性,化疗时先给予吉西他滨后给予顺铂,则具有协同作用,且毒性无叠加,反之,则毒性反应增加[9],因此,化疗过程应监护给药顺序。该患者给药顺序合理,故可予排除该方面影响。
|
|
表 2 GP方案对骨髓抑制的影响 |
化疗前白细胞水平:该患者化疗前白细胞计数为3.73×109·L-1,略低于正常值,表明患者自身的粒系造血功能出现一定程度的下降,因此,化疗后易出现骨髓抑制反应。
另外,有文献分析[10],多程化疗易损伤患者的骨髓储备功能,使骨髓抑制更容易发生,且抑制程度更严重。故该患者多程化疗史也与骨髓抑制相关。
综上所述,该患者出现重度骨髓抑制与其高剂量化疗、高毒性化疗、化疗前白细胞水平、多程化疗史等因素有关。
3 骨髓抑制的药学监护 3.1 白细胞与中性粒细胞计数减少的药学监护该患者6月13日出现白细胞与中性粒细胞计数减少,给予G-CSF(300 μg ih qd)连续治疗3天后,基本恢复正常值,继续予以原方案化疗。6月19日,中性粒细胞计数再次下降,给予G-CSF联合GM-CSF治疗,方案合理。G-CSF与GM-CSF均能较快升高白细胞,疗效可靠。两者的主要区别在于G-CSF增加骨髓中粒细胞产生能力为9.4倍、GMCSF为1.5倍,G-CSF的升白能力较强[11]。而GMCSF可提高患者的抗感染和免疫功能,可用于骨髓抑制预防性用药。两者联合应用,可提高疗效。
应用G-CSF与GM-CSF治疗时,临床药师应监护药物的给药剂量以及给药与停药时机,关注药物不良反应,预防感染的发生。G-CSF与GM-CSF应在化疗药物给药结束后24~48小时起给予皮下或静脉注射,G-CSF给药剂量为每公斤体重2~5μg,GM-CSF为3~10μg,每日1次,并于中性粒细胞回升至5.0×109·L-1(白细胞计数10.0×109·L-1)以上时,停止给药。该患者于化疗第6天及化疗后第4天给予,给药剂量与时机基本合理。针对该患者白细胞与中性粒细胞下降引起免疫功能下降与感染的风险,临床药师密切监护患者,嘱其加强营养、清淡饮食、多饮水、注意休息、配戴口罩、防感冒、多漱口及加强口腔护理。此外密切监护患者的血常规,观察患者有无发热、乏力等不适。在监护期间,该患者感觉乏力,食欲、睡眠尚可,无发热反应。
3.2 血小板减少的药学监护根据“肿瘤化疗所致血小板减少症诊疗中国专家共识(2014版)” [12],当10×109·L-1<PLT<75×109·L-1时,应给予重组人血小板生成素(rhTPO)和(或)重组人白细胞介素11(rhlL-11)对症治疗,当患者的PLT≤20×109·L-1时,应考虑输注血小板。rhIL-11推荐剂量为每公斤体重2 5 ~ 5 0 μ g,皮下注射,每日1次,至少连用7 ~ 1 0 d,至化疗抑制作用消失并PLT≥100×109·L-1或至PLT较用药前升高50×109·L-1以上时停药。该患者6月17日PLT 58×109·L-1,给予rhIL-11(3 mg ih qd),治疗合理。6月27日PLT下降至最低点,6月29日上升至86×109·L-1,表明血小板计数已逐渐恢复正常。
针对该患者血小板低下存在出血危险及rhIL-11常见的不良反应,临床药师密切监护患者有无水肿、骨痛、发热、感染等不良反应发生,并嘱其尽量避免下床活动,防止受伤,避免用牙刷,可用漱口水,并加强口腔护理。此外密切监护患者的血常规、凝血因子,观察患者有无出血点、瘀点、瘀斑、血尿、血便等。在监护期间,该患者未出现与血小板下降相关出血事件及相关不良反应发生。
3.3 肺部感染的药学监护患者入院前血常规正常,无咳嗽、咳痰等不适反应,化疗第5 d中性粒细胞下降至0.66×109·L-1,粒细胞未降至最低点,预计48 h后可减少至<0.5×109·L-1,故存在中性粒细胞缺乏可能,且住院时间长,存在院内感染的风险。给予升白治疗后再次化疗,导致骨髓抑制加重,出现发热症状,体温最高39.6℃,伴畏寒、咳嗽、咳痰。PLT 12×109·L-1、NEU% 80.2%,CRP 157 mg·L-1、PCT 0.2 ng·mL-1,胸片示两肺纹理增多,两肺散在斑点状高密度影。根据文献,粒细胞减少患者,一旦出现发热应立即做血培养和药敏,并给予广谱抗生素治疗[13],患者已出现肺部感染的表现,根据抗菌药物临床应用指导原则(2015版)[14],药师建议给予广谱的三代头孢菌素联合氟喹诺酮类药物治疗。医师采纳并给予头孢曲松钠联合左氧氟沙星抗感染治疗,应用3天后患者症状缓解,体温恢复正常。
患者发生严重骨髓抑制,免疫功能低下,住院时间长,易诱发肺部感染。有文献显示,肿瘤化疗患者医院感染率为9.6%,远高于其他科室医院感染发生率[15]。因此,药师应警惕该类患者感染的可能,及时对该类患者进行健康教育,嘱其注意防感冒、外出应戴口罩,并加强营养;对患者做好口腔等基础护理、并采取加强环境消毒等医院感染防范措施,以减少病原微生物的传染和扩散。抗感染治疗症状缓解后,患者要求出院,对患者行健康教育,并嘱其院外复查血常规,如有异常或出现不适情况,及时入院就诊。
4 总结肝内胆管细胞癌是起源于肝内胆管上皮的恶性肿瘤,约占原发性肝癌的10%~15%,且其发病率呈逐年上升趋势[16],肝内胆管细胞癌在临床上相对少见,往往恶性程度较强,复发率较高,再加之早期临床表现缺乏特异性,确诊时多为晚期,大部分患者失去手术机会,预后情况极差,平均生存期仅为3~4个月左右[17]。该患者为晚期多发性转移的胆管癌患者,已行多程化疗,机体免疫功能低下,化疗前白细胞略低于正常水平,且所使用的GP方案,易导致严重骨髓抑制,药师根据指南等文献要求,注重对药物的选用、剂量的调整、药物不良反应等的监护和干预,还需在化疗前做好充分的评估,在选择化疗方案及给药剂量时应考虑患者的耐受性,必要时适当减量应用。对患者用药过程可能出现的骨髓抑制程度及其他不良反应要加强防护,及时干预不合理用药行为,把好每个用药环节。骨髓抑制是化疗患者常见且严重的不良反应,当出现骨髓抑制时,在积极升白治疗的同时,应注意感染的风险防范,严重粒细胞缺乏患者应及时采取隔离措施,预防感染。目前,越来越多的医院将临床药师纳入医院的多学科联合查房会诊团队中,药师应利用自身的药学专业优势,依据相关指南并结合临床进行用药分析,与医生共同制定用药方案。药师应注重病史及用药史的采集,从药师的角度详细询问患者的病情与用药史,做好用药教育和健康教育。治疗过程应警惕药物不良反应的发生,为患者提供个性化的药学服务,保障患者用药安全。
| [1] |
Brenet F, Kermani P, Spektor R, et al. TGF Restores Hematopoietic Homeostasis after Myelosuppressive chemotherapy[J]. J Exp Med, 2013, 210(3): 623-639. DOI:10.1084/jem.20121610 |
| [2] |
国际肝胆胰学会中国分会, 中华医学会外科学分会肝脏外科学组. 肝胆癌诊断与治疗-外科专家共识[J]. 临床肝胆病杂志, 2015, 31(1): 12-16. |
| [3] |
江曙红, 吴怡青, 王远飞, 等. 化疗后骨髓抑制的影响因素分析[J]. 吉林医学, 2014, 35(18): 4010-4011. |
| [4] |
周霞, 臧红, 刘鸿凌. 2014年美国肝胆胰学会共识声明:肝内胆管癌管理摘译[J]. 临床肝胆病杂志, 2015, 31(10): 1584-1587. |
| [5] |
National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Hepatobiliary Cancers, Version 2[EB/OL]. (2015-02-06)[2017-03-30] Available at http://www.nccn.org/professionals/physician_gls/PDF/hepatobiliary.
|
| [6] |
中国抗癌协会临床肿瘤学协作专业委员会. 肿瘤化疗所致血小板减少症诊疗中国专家共识(2013-2014版)[C]. CSCO抗淋巴瘤联盟淋巴瘤治疗专家共识研讨会, 2014.
|
| [7] |
欧阳丽辉, 彭六保, 曾小慧, 等. 重组人血管内皮抑制素联合GP方案与GP方案在非小细胞肺癌患者中疗效比较的meta分析[J]. 中南药学, 2012, 10(10): 781-787. |
| [8] |
孙婷, 方明治. 化疗致血小板减少症临床治疗进展[J]. 辽宁中医药大学学报, 2013, 15(3): 244-247. |
| [9] |
丁永斌. 肿瘤化疗处方手册[M]. 第2版. 江苏: 江苏科学技术出版社, 2010.
|
| [10] |
田晓燕, 姚燕琴, 尤海生. 化疗药致Ⅳ度骨髓抑制病例分析[J]. 西北药学杂志, 2011, 26(6): 462-463. |
| [11] |
安永恒, 丁爱萍, 梁军. 肿瘤合理用药[M]. 第2版. 北京: 人民卫生出版社, 2009: 348.
|
| [12] |
中国抗癌协会临床肿瘤学协作专业委员会. 肿瘤化疗所致血小板减少症诊疗中国专家共识[J]. 中华肿瘤杂志, 2014, 36(11): 876-879. DOI:10.3760/cma.j.issn.0253-3766.2014.11.016 |
| [13] |
石远凯, 孙燕. 临床肿瘤内科手册[M]. 第6版. 北京: 人民卫生出版社, 2014: 97-97.
|
| [14] |
钟南山, 万希润, 马小军, 等. 国卫办医发[2015] 43号抗菌药物临床应用指导原则[S]. 2015: 52-53.
|
| [15] |
李常青. 肿瘤化疗医院感染的相关因素分析及防范措施探讨[J]. 中华医院感染学杂志, 2013, 23(10): 2316-2318. |
| [16] |
Esnaola N F, Meyer J E, Karachristos A, et al. Evaluation and Management of Intrahepatic and Extrahepatic Cholangiocarcinoma[J]. Cancer, 2016, 122(9): 1349-1369. DOI:10.1002/cncr.v122.9 |
| [17] |
黄磊. 替吉奥联合奥沙利铂治疗晚期肝内胆管细胞癌临床效果研究[J]. 现代诊断与治疗, 2014, 25(10): 2234-2235. |
 2018, Vol. 32
2018, Vol. 32