2. 广西食品药品检验所, 南宁 530021
2. Guangxi Institute for Food and Drug Control, Nanning 530021, China
宫颈炎康栓系广西康华药业有限责任公司独家产品,为原中药三类新药,主要用于慢性宫颈糜烂属于带下湿热证候的治疗,临床上使用微波结合宫颈炎康栓药物治疗宫颈糜烂均有较好的疗效[1-4]。该中药主要成分为苦参、枯矾、苦杏仁、冰片等,原有的质量标准中收载有苦参碱含量测定宫颈炎康栓中苦参碱的含量[5],但同时测定苦参碱和槐定碱的含量未见报道。本文参照有关文献[6-10],建立了HPLC法同时测定宫颈炎康栓中苦参碱及槐定碱的含量。
1 仪器与试药 1.1 仪器Agilent 1100高效液相色谱仪,VWD紫外检测器(美国Agilent公司),Millipore纯水机(美国密理博公司)。
1.2 试药苦参碱对照品(中国药品生物制品检定所,批号:110805-200306,供含量测定用),槐定碱对照品(中国药品生物制品检定所,批号:110784-200303,供鉴别用,经峰面积归一化法计算含量为99.4%),氧化苦参碱对照品(中国药品生物制品检定所,批号:110780-200405,供含量测定用);宫颈炎康栓(批号:100301、100804、100908、101007、101108、101109、101110、110101、110102、110103,广西康华药业有限责任公司);乙腈为色谱纯,水为高纯水,其他试剂均为分析纯。缺苦参的阴性对照样品由本中心自制。
2 方法与结果 2.1 色谱条件与系统适用性试验色谱柱:UltimateXB-NH2(4.6 mm × 250 mm,5 μm);流动相:乙腈-3%磷酸溶液(97︰3);流速:1.0 mL·min-1;检测波长:206 nm;柱温:35 ℃;进样量:10 μL。理论板数按苦参碱计算应不低于5000;理论板数按槐定碱计算应不低于5000。
2.2 溶剂的制备 2.2.1 对照品储备液的制备精密称取苦参碱对照品10.19 mg,置20 mL量瓶中,加乙腈使溶解并稀释至刻度,摇匀,作为苦参碱对照品储备液;精密称取槐定碱对照品10.35 mg,置20 mL量瓶中,加乙腈使溶解并稀释至刻度,摇匀,作为槐定碱对照品储备液;精密称取氧化苦参碱对照品10.42 mg,置20 mL量瓶中,加乙腈使溶解并稀释至刻度,摇匀,作为氧化苦参碱对照品储备液。
2.2.2 供试品溶液的制备取宫颈炎康栓10粒,精密称定,置温水中使融化,混匀,冷却,取约0.5 g,精密称定,置具塞锥形瓶中,精密加入乙醇50 mL,密塞,称定重量,加热回流30 min,放冷,再称定重量,用乙醇补足减失的重量,摇匀,置0 ℃下放置30 min,取出,放至室温,摇匀,滤过,取续滤液,即得。
2.2.3 阴性对照溶液的制备按制剂制备方法,制备不含苦参的阴性样品,按“2.2.2”节方法制备阴性对照溶液。
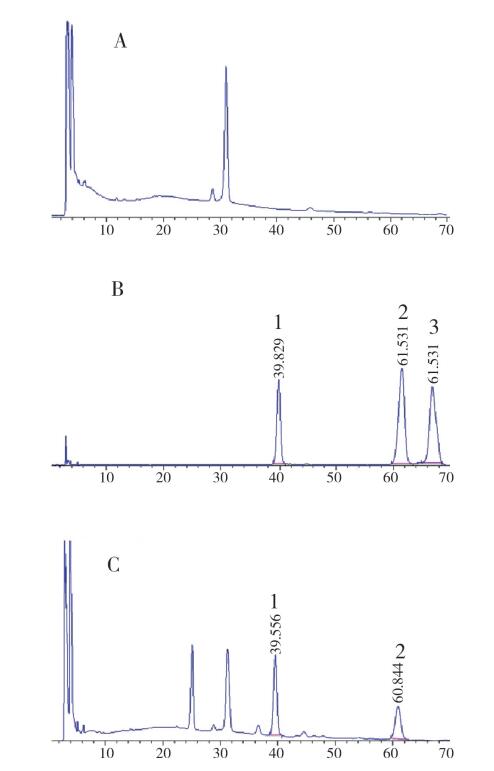
2.3 空白试验按上述色谱条件,分别取对照品溶液、供试品溶液及阴性对照溶液各10 μL,注入液相色谱仪,记录色谱图。结果表明:阴性对照溶液在与苦参碱和槐定碱对照品溶液相同保留时间处无干扰峰出现,处方中其他药味对测定结果无影响。HPLC色谱图见图 1。
|
图 1 宫颈炎康栓HPLC色谱图 A.阴性样品;B.对照品;C.样品;1.苦参碱;2.槐定碱;3.氧化苦参碱。 |
分别精密吸取苦参碱和槐定碱对照品储备液各1、2、5、10、20、50 mL,置100 mL容量瓶中,加乙腈定容至刻度,制成不同浓度的混合对照品溶液,按上述色谱条件测定,以对照品的进样量X (μg)为横坐标,峰面积Y为纵坐标,绘制标准曲线,并进行线性回归。
苦参碱的回归方程:Y=1852.3X+3.6333,r=1.0000,表明苦参碱进样量在0.05095~2.5475 μg与峰面积呈良好的线性关系。
槐定碱的回归方程:Y=1689.7X-4.4056,r=1.0000,表明槐定碱进样量在0.05144~2.5720 μg与峰面积呈良好的线性关系。
2.5 精密度试验取同一混合对照品溶液,连续进样6次,测定峰面积,以峰面积考察精密度,苦参碱RSD为0.11%,槐定碱RSD为0.99%,表明仪器精密度良好。
2.6 重复性试验取同一样品(批号:110103)6份,按“2.2.2”节方法制备供试品溶液,按“2.1”节方法进行测定,结果苦参碱的平均含量为2.85 mg·g-1,RSD=2.33%,槐定碱的平均含量为2.10 mg·g-1,RSD=1.93%,表明本试验重复性良好。
2.7 稳定性试验精密吸取同一供试品溶液,分别于制备后0、8、14、20、24 h,按“2.1”节方法进行测定,苦参碱的平均峰面积为540.875,RSD=0.14%,槐定碱的平均峰面积为353.595,RSD=0.62%,表明供试品溶液在24 h内稳定。
2.8 加样回收试验精密称取苦参碱对照品18.56 mg,置50 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀,即得,作为苦参碱加样对照品溶液;精密称取槐定碱对照品12.75 mg,置50 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀,即得,作为槐定碱加样对照品溶液。精密称取已知含量的同一样品(批号:110103)约0.25 g,共9份,分别置具塞锥形瓶中,每3份分别精密加入苦参碱对照品溶液及槐定碱对照品溶液各1.0、2.0、4.0 mL,低温挥干,按“2.2.2”节方法制成供试品溶液,按“2.1”节方法进行测定,分别计算回收率,结果见表 1、表 2。
|
|
表 1 苦参碱加样回收率试验结果(n=9) |
|
|
表 2 槐定碱加样回收率试验结果(n=9) |
取本品10批,按“2.2.1”节方法制备对照品溶液,按“2.2.2”节方法制备供试品溶液,按“2.1”节色谱条件,进行含量测定,结果见表 3。
|
|
表 3 10批样品测定结果 |
苦参碱在204 nm有最大吸收,槐定碱在206 nm有最大吸收,两者在206 nm处均有较高吸收,故选择检测波长为206 nm。
3.2 流动相的选择《中国药典》2015年版中苦参含量测定项下,所选用流动相为乙腈-无水乙醇-3%磷酸溶液(80︰10︰10),而乙醇在小于210 nm有最末端吸收,对苦参碱和槐定碱的测定产生干扰,试验过程中对流动相进行优化,采用乙腈-3%磷酸溶液(97︰3)作为流动相,能使待测成分得到较好的分离且不受其他成分的干扰。
3.3 色谱柱、提取溶剂和提取时间的选择参考文献,比较了2种色谱柱:C18柱和氨基柱,使用氨基柱时苦参碱和槐定碱的峰形良好,分离度均大于1.5,且不受杂质峰的影响。比较了甲醇、三氯甲烷、乙醇、乙醇-氨水(100︰2)作为提取溶剂的提取效果,结果显示:甲醇在加热过程中无法使样品完全溶解;《中国药典》2015年版中苦参含量测定项下,苦参的提取溶剂为三氯甲烷-浓氨,本品为栓剂,选用的辅料多为脂溶性成分,试验中三氯甲烷溶解了大量的基质辅料,较难净化;乙醇-氨水(100︰2)提取后,样品的峰形不好,且保留时间漂移;最终选择提取效果最佳的乙醇作为提取溶剂。比较了超声和回流的提取效果,结果显示:超声处理的样品基质无法溶散,样品结块,影响提取效率,故选择提取方式为加热回流。比较了加热回流15、30、60 min的提取效率,结果显示:加热回流30 min提取较完全。
3.4 结果分析苦参为方中主药,含有苦参碱、氧化苦参碱、槐定碱等活性成分[11-13],研究表明苦参中的苦参碱和氧化苦参碱存在相互转化的过程,含有苦参药材的复方水煮以后,苦参碱含量远高于氧化苦参碱,并且随着加热时间的延长,比例在显著地增大[14],氧化苦参碱在有还原物质存在时,加热氧化苦参碱转变为苦参碱,甚至未能检出氧化苦参碱[15]。试验中通过HPLC分析氧化苦参碱,发现本样品中未检测到氧化苦参碱的峰,推断本制剂可能在制备过程中由于水煮与方中其他药味发生反应,使苦参中的大部分氧化苦参碱转化为苦参碱,使试验中检测不到。本文采用苦参碱与槐定碱之和作为控制指标,实验分析表明,此方法操作简便、分析快速,能够准确测定宫颈炎康栓中的主要活性物质,有利于该制剂的质量控制。
| [1] |
周倩. 激光、微波和宫颈炎康栓局部治疗宫颈糜烂疗效对比观察[J]. 山东医药, 2011, 51(10): 74-75. DOI:10.3969/j.issn.1002-266X.2011.10.045 |
| [2] |
杨润根. 微波联合宫颈炎康栓治愈重度宫颈糜烂206例临床观察和体会[J]. 中国医药创新, 2012, 9(4): 18-20. |
| [3] |
蒋艳丽, 魏东艳, 蔡振吉. 微波联合宫颈炎康栓治疗宫颈糜烂疗效观察[J]. 中国现代药物应用, 2010, 4(4): 36-36. |
| [4] |
周维谨, 韩耀玲, 车焱, 等. 宫颈炎康栓治疗中重度宫颈糜烂疗效观察[J]. 中国计划生育学杂志, 2007, 15(4): 226-229. |
| [5] |
凌朝珍, 唐新, 梁燕. HPLC法测定宫颈炎康栓的含量[J]. 中国卫生产业, 2012(12): 119-122. |
| [6] |
叶世芸, 卢顺林, 毕嘉乐, 等. HPLC法测定妇炎膜中苦参碱及氧化苦参碱的含量[J]. 现代中药研究与实践, 2012(5): 55-59. |
| [7] |
梁亚丽, 郭文敏, 王莉芳, 等. HPLC法测定妇宁阴道泡腾片中苦参碱和氧化苦参碱的总量[J]. 中国药师, 2010, 13(10): 1411-1413. DOI:10.3969/j.issn.1008-049X.2010.10.010 |
| [8] |
吕佳, 王丹, 张振秋, 等. HPLC同时测定苦参药材中5种生物碱的含量[J]. 中国中医药信息杂志, 2013, 20(9): 61-62. |
| [9] |
洪世忠. 复方苦参碱注射液中苦参碱和氧化苦参碱的总含量测定[J]. 中医学报, 2015(7): 1014-1016. |
| [10] |
牛天增, 乔玉峰, 李明花, 等. 苦参及其制剂中生物碱成分测定方法研究进展[J]. 亚太传统医药, 2015, 11(19): 56-59. |
| [11] |
张翅, 马悦, 高慧敏, 等. 苦参化学成分研究进展[J]. 中国实验方剂学杂志, 2014, 20(4): 205-214. |
| [12] |
苗抗立, 张建中, 董颖, 等. 苦参的化学成分及药理的研究进展[J]. 天然产物研究与开发, 2001, 13(2): 69-73. |
| [13] |
刘伟, 唐金花, 王亚娣. 苦参的研究进展[J]. 时珍国医国药, 2006, 17(5): 829-830. |
| [14] |
贾敏鸽, 孙文基. 苦参及其复方中苦参碱与氧化苦参碱的转化研究[J]. 药物分析杂志, 2003, 23(2): 91-93. |
| [15] |
陆蕴如, 杨钟柯. 苦参在复方中化学成分变化的研究[J]. 中国中药杂志, 1996, 21(7): 412-414. |
 2017, Vol. 31
2017, Vol. 31 
