菟丝草为维吾尔医常用药材,为旋花科植物菟丝子(cuscuta chinensis lam.)及其同属植物的干燥地上部分。本品性质二级干热,味辛。具清除异常黑胆质或黏液质,散气通阻,解除狂,爽心悦志,清脑安神,软坚消肿的作用[1-7]。现行质量标准收载于《中华人民共和国卫生部药品标准维吾尔药分册》[8],原标准只有性状鉴别,标准控制比较简单。本文通过对菟丝草药材进行研究,增加了TLC鉴别方法,并采用HPLC法测定金丝桃苷的含量,使质量标准进一步完善提高。
1 仪器与试药岛津LC-20AT高效液相色谱仪,SPD-M10AVP二极管阵列检测器,Lab solution色谱工作站(日本岛津)。KUDOS SK7210LHC型超声仪(上海科导超声仪器有限公司)
金丝桃苷对照品(中国食品药品检定研究院,批号:11521-200303,供含量测定用)。菟丝草对照药材(新疆维吾尔自治区食品药品检验所自制,批号:20120722)供试品:菟丝草样品10批(批号分别为20100521、20110517、20110221、20110325、20110319、20110317、20110623、20110523、20110728、20110806),经新疆大学生命科学与技术学院王虹老师鉴定均为旋花科植物菟丝子(cuscuta chinensis lam.)的干燥地上部分。乙腈为色谱纯(Fisher公司),其余化学试剂均为分析纯。
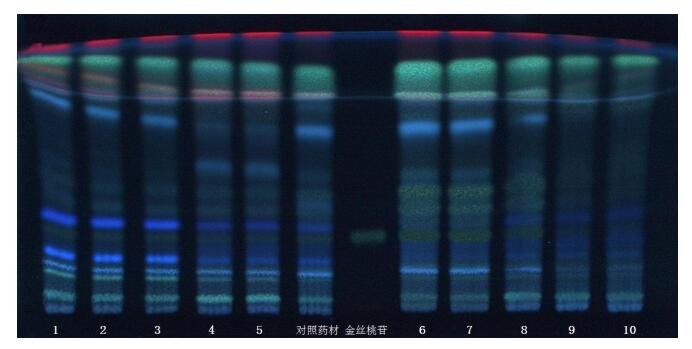
2 方法与结果 2.1 菟丝草TLC鉴别取本品粉末1 g,加甲醇30 mL,超声(功率:350 W,频率:59 kHz)处理10 min,滤液蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。另取菟丝草对照药材1 g,同法制成对照药材溶液。再取金丝桃苷对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取供试品溶液10 μL,对照品和对照药材溶液各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-丁酮-甲酸-水(10 ︰ 6 ︰ 1 ︰ 2)的上层液为展开剂,展开,取出,晾干。喷以5%三氯化铝乙醇液,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点。见图 1。
|
图 1 薄层色谱图 1 ~ 10.样品(批号:20100521、20110517、20110221、20110325、20110319、20110317、20100623、20110523、20110728、20110806)。 |
色谱柱:Agilent Eclipse TC-C18(250 mm× 4.6 mm,5 μ m);流动相:乙腈-0.1%磷酸溶液(17︰83);检测波长:360 nm;流速:1.0 mL·min-1;柱温:30℃;进样量:10 μL。理论板数按金丝桃苷计应不低于6000。
2.2.2 对照品溶液制备取金丝桃苷对照品适量,精密称定,加50%甲醇制成每1 mL含15 μg的溶液,作为对照品溶液。
2.2.3 供试品溶液制备取本品粉末(过三号筛)2 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,称定重量,超声(功率:350 W,频率:59 kHz)处理1 h,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,用0.45 μm的微孔滤膜过滤,取续滤液,作为供试品溶液。
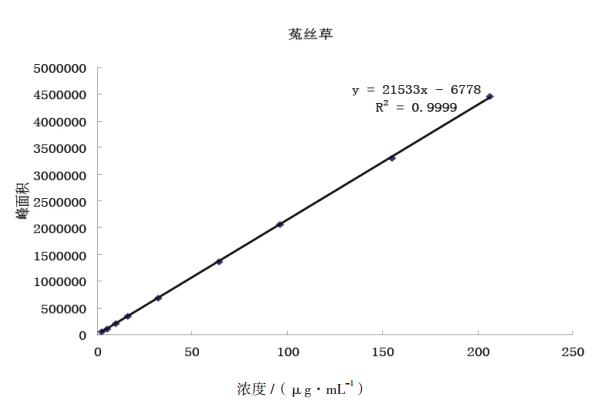
2.2.4 线性关系考察精密称量对照品适量,加50%甲醇使溶解,摇匀,制成每1 mL含金丝桃苷2.568、5.136、9.63、16.05、32.1、64.2、96.3、154.8、206.4 μg·mL-1的系列浓度对照品溶液,分别进样10 μ L,按“2.2.1”节下的色谱条件测定峰面积,以浓度为横坐标,峰面积为纵坐标,进行回归,得金丝桃苷的回归方程:
| $\begin{array}{*{20}{c}} {Y = 21533X - 6778}&{r = 0.9999} \end{array}$ |
金丝桃苷进样浓度为2.568~206.4 μg·mL-1与峰面积呈良好的线性关系,见图 1。
|
图 1 标准曲线图 |
精密吸取供试品溶液(1号样),重复进样6次,每次10 μL,按“2.2.1”节下的色谱条件测定峰面积,计算相对标准偏差,金丝桃苷峰面积RSD为0.16%,结果表明仪器精密度良好。
2.2.6 稳定性试验取同一供试品溶液(1号样),分别于配制后0、2、4、8、12、24 h,按“2.2.1”节下的色谱条件测定峰面积,计算相对标准偏差RSD为0.40%。结果表明供试品溶液在室温下24 h内稳定。
2.2.7 重复性试验取供试品(1号样)适量,照“2.2.3”方法制备供试品溶液6份,按“2.2.1”节下的色谱条件测定,结果金丝桃苷的平均含量为0.40 mg·g-1,RSD为2.06%,表明本试验重复性良好。
2.2.8 加样回收率试验取供试品(1号样)1 g,共9份,分别精密加入每1 mL含金丝桃苷0.09728 mg的对照品溶液4、5、6 mL,按“2.2.3”方法制备测试溶液,按“2.2.1”节下的色谱条件测定,计算回收率,结果金丝桃苷平均回收率为100.18%(n=9),RSD为2.09%,见表 1。
|
|
表 1 金丝桃苷回收率测定结果(n=9) |
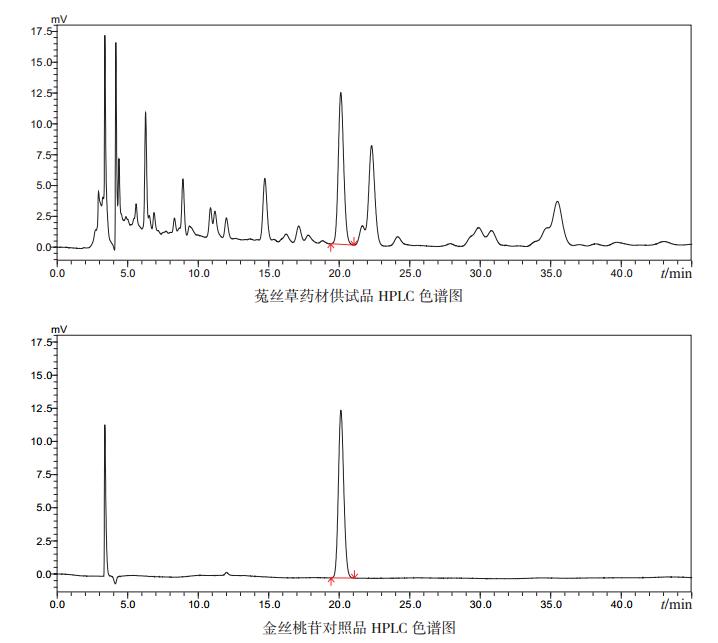
分别称定10批菟丝草药材粉末,按“2.2.3”方法制备测试溶液,按“2.2.1”节下的色谱条件测定,结果见表 2和图 2。
|
|
表 2 样品测定结果 |
|
图 2 菟丝草药材HPLC色谱图 |
文献报道菟丝草含黄酮类成分[9-11],本研究采用金丝桃苷对照品进行薄层色谱鉴别,斑点清晰,重现性好。
3.2 提取溶剂和超声时间的考察分别采用不同浓度的溶剂、不同超声时间进行测定,结果显示:使用50%甲醇溶液,超声1 h制备供试品溶液,得到的金丝桃苷含量高。
3.3 新增含量测定项菟丝草主要成分是金丝桃苷[12-15],具明显的强心作用。故选用金丝桃苷作为含量测定指标,以进一步完善菟丝草药材的质量标准。
| [1] |
中国医学百科全书编辑委员会. 中国医学百科全书:维吾尔医学[M]. 上海: 上海科学技术出版社, 2005: 299.
|
| [2] |
江苏新医学院. 中药大词辞典:下册[M]. 上海: 上海科学技术出版社, 1977: 2005.
|
| [3] |
国家中医药管理局《中华本草》编委会. 中华本草:维吾尔药卷[M]. 上海: 上海科学技术出版社, 2005: 301-302.
|
| [4] |
刘勇民, 沙吾提·伊克木. 维吾尔药志:下册[M]. 乌鲁木齐: 新疆科技卫生出版社, 1999: 831-832.
|
| [5] |
中国药典: 一部[S]. 2015: 309-309.
|
| [6] |
中国科学院新疆生物土壤沙漠研究所. 新疆药用植物志:第三卷)[M]. 乌鲁木齐: 新疆人民出版社, 1981: 51-60.
|
| [7] |
新疆维吾尔自治区卫生厅. 维吾尔药材标准:上册[M]. 乌鲁木齐: 新疆科技卫生出版社, 1993: 292.
|
| [8] |
中华人民共和国卫生部药典委员会. 中华人民共和国卫生部药品标准: 维吾尔药分册[S]. 1998: 91.
|
| [9] |
毛艳, 顾政一, 杨伟俊, 等. 维药菟丝草的质量标准研究[J]. 中国药房, 2013, 24(19): 1782-1783. DOI:10.6039/j.issn.1001-0408.2013.19.19 |
| [10] |
毛艳, 顾政一, 杨伟俊, 等. 维药菟丝草的生药鉴别[J]. 中药材, 2013, 36(6): 911-913. |
| [11] |
娜仁高娃, 王青虎, 那音台, 等. HPLC法同时测定蒙药菟丝草中三种成分的含量[J]. 中国药房, 2014, 25(7): 649-651. DOI:10.6039/j.issn.1001-0408.2014.07.25 |
| [12] |
李东峰, 赵军, 王建华. 高效液相色谱法测定山楂中金丝桃苷的含量[J]. 新疆医科大学学报, 2008, 31(12): 37-38. |
| [13] |
管群, 吕圭源, 俞静静, 等. 不同产地菟丝子总黄酮及金丝桃苷的含量测定[J]. 浙江中医药大学学报, 2012(2): 74-76. |
| [14] |
王艳, 王先容, 马凤余, 等. 金丝桃苷在植物中分布及其含量测定[J]. 安徽医药, 2009, 13(11): 1312. DOI:10.3969/j.issn.1009-6469.2009.11.003 |
| [15] |
李景庄, 胡君萍, 杨建华, 等. HPLC-UV法测定天山花楸中金丝桃苷和芦丁的含量[J]. 药物分析杂志, 2009, 29(2): 310-312. |
 2017, Vol. 31
2017, Vol. 31 