加压素(vasopressin, AVP)又称后叶加压素、抗利尿激素,是由下丘脑的视上核神经细胞产生的环状肽类激素。加压素在临床上主要用于尿崩症、食管静脉曲张出血的治疗,也用于中枢性尿崩症、肾性尿崩症和精神性烦渴的鉴别诊断。本文就加压素及其类似物的基础研究进展及在临床中的应用,作如下综述。
1 加压素的结构、代谢、体内分布与功能加压素的结构是一环形九肽,氨基酸序列为L-半胱氨酰-L-酪氨酰-L-异亮氨酰-L-谷氨酰胺酰-L-门冬酰胺酰-L-半胱氨酰-L-脯氨酰-L-精氨酰-L-甘氨酰胺环(1→6)二硫化物,其中两个半胱氨酸在1,6位组成1个二硫键,如图 1所示[1]。其分子量为1084.23,在血液循环中以自由肽的形式存在。1954年成功合成出AVP,AVP在调节游离水的重吸收、体液的等渗浓度、血液容积、血压、细胞收缩、细胞增殖和促肾上腺皮质激素(ACTH)的分泌等方面具有重要作用[2]。AVP合成后储存在下丘脑,达到一定浓度后沿神经束向下运输,通过动脉圆锥到达垂体后叶的神经末梢,它在那里被释放入体循环系统。
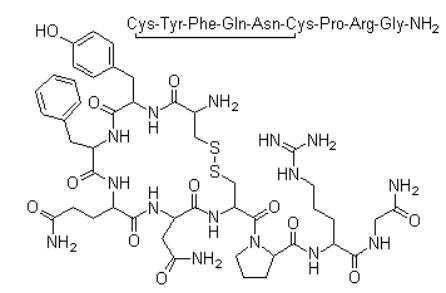
|
图 1 加压素的结构示意图 |
AVP的生物学效应被一类特异的G蛋白偶联的膜受体家族所介导[3]。这些受体根据所偶联的细胞内第二信使系统的不同分为三个亚型:V1a、V1b、V2,见表 1。V1a和V1b受体相联系的是膜内磷酸肌醇信号转导通路,以细胞内的钙离子为第二信使;V2受体相联系的是膜内的腺苷酸环化酶信号转导通路,以细胞内的环磷酸腺苷(cAMP)为第二信使;V1a和V1b是根据两种受体分布的组织不同而分类。V1a分布于血管平滑肌和血小板,V1b受体分布于垂体。AVP通过V1a受体增加血管紧张度的机制有:1)通过激活血管平滑肌的V1受体增加细胞内的钙离子浓度介导血管收缩;2)通过调节ATP-敏感的K+通道使膜部分去极化;3)调节血管平滑肌内皮周围一氧化氮浓度;4)对肾上腺素能激素和其他缩血管物质如血管紧张素Ⅱ的允许作用。研究证明,分布在心肌的V1a受体还能引起左室重构。AVP通过和V1a受体偶联的G蛋白激活第二信使三磷酸肌醇(IP3),增加了钙离子和蛋白激酶C(PKC)的浓度。PKC能增加一种特异的生长调节基因表达,比如c-Fos(一种原癌基因),使心肌细胞增生、肥大,最终导致左室重构。在基础实验中人们观察到AVP诱导了幼鼠心肌细胞的蛋白质合成,在成年老鼠同样诱导了心肌细胞的蛋白质合成。V1b受体和V1a受体及V2受体分别具有45%、39%的同源性。它能促进垂体前叶ACTH的分泌和DNA、cAMP的合成。肾脏水分重吸收的调节主要靠AVP来实现。肾脏集合管基底侧膜分布着V2型AVP受体,AVP和这些受体结合通过G蛋白-腺苷酸环化酶和蛋白激酶A(PKA)系统使水通道磷酸化来控制着肾脏水的排泄。肾脏V2型膜受体对AVP刺激的反应能力是受一类分布在集合管细胞的叫做水通道的膜蛋白质调节的,尽管肾脏至少有7种水通道,水通道-2(AQP2)是AVP主要作用的靶位点。AQP2通过短期和长期两种机制来调节水分的排泄:短期机制是调控AQP2向细胞表面的快速穿梭运动;长期机制是刺激编码AQP2的mRNA的合成。短期机制的意义在于:AQP2从胞内的小囊泡向细胞顶端运输,插入集合管的顶端膜,顶端膜的AQP2密度增加,以此来提高对水的通透性,水分顺着渗透梯度被肾脏重吸收,并因此使血浆渗透压下降。而长期机制则是AVP导致集合管AQP2的转录过程发生变化,使AQP2表达增加[4]。
|
|
表 1 加压素受体亚型的分布和生理作用 |
近年来,在研究这些加压素类似物的过程中,由于化合物同加压素或缩宫素在结构上的类似性,经常会使用到下述几种模型进行药物活性的研究。
3.1 加压素受体结合实验采用稳定转染加压素受体使之高表达的细胞,实验采用24孔板进行[5]。在高表达加压素受体的细胞中加入3H标记的加压素,于4℃孵育2 h。再加入不同浓度的加压素类似物,37℃孵育4 h后裂解细胞,用液体闪烁记数器检测。通过绘制亲和力结合曲线,计算IC50值来表示化合物与加压素受体的亲和力。
3.2 加压素受体拮抗作用实验候选化合物的AVP受体拮抗作用是通过测量表达AVP-V2受体的细胞激活或抑制AVP诱导的cAMP积累量的方法来进行的[6]。因此,该方法亦可称为cAMP诱导实验。将细胞接种24h后,加入加压素或其类似物共同培养30 min。处理后的细胞用超声震荡,用cAMP femto kit(Cisbio)进行分析。加压素拮抗能力用pA2值表示,所谓pA2值是指一种拮抗剂消除2倍单位的激动剂的生物效应的平均摩尔浓度和没有拮抗剂时由1倍单位激动剂引起的生物效应的摩尔浓度比值的自然对数的负值。
3.3 大鼠利尿活性实验将饲养的SD大鼠静脉或灌胃给予加压素类似物,以同样给药途径及剂量给予呋塞米作为阳性对照组,给药前灌胃5%体重量的生理盐水,以增加水负荷。大鼠被放置在代谢笼中,收集自发性尿液并定量[7]。
3.4 升压效应试验取成年雄性大鼠麻醉后固定于保温手术台上分离器官,在一侧颈静脉插入静脉插管抗凝后供注射药液用。然后剥离另一侧颈动脉,插入与血压计相连的动脉插管,在血压计与插管通路中充满氯化钠注射液,并于动脉插管中注入适量肝素,全部手术完毕后,将血压计调节到与动物血压相当的高度,开启动脉夹,记录血压。缓缓注入适宜的交感神经阻断药(如酚妥拉明),待血压稳定后,即可进行药液注射。通过比较化合物与加压素标准品所致血压升高的高度,计算化合物对血压的影响[8]。
4 加压素激动剂及拮抗剂 4.1 选择性加压素V2受体激动剂加压素作为抗利尿受体激动剂和血管加压受体激动剂,不具有选择性。如已经上市多年的鞣酸加压素(又称长效尿崩停),临床用于中枢性尿崩症的治疗,对肾脏有直接抗利尿作用,也能收缩周围血管,并引起肠道、胆囊及膀胱的收缩,但几乎无催产作用。1967年合成出第一个选择性V2受体激动剂——Mpa1, D-Arg8VP(dDAVP去氨加压素),具有较强的抗利尿作用及较弱的加压作用,其抗利尿作用/加压作用比是加压素的2000~3000倍,作用维持时间也较加压素长,此外去氨加压素的催产素活性明显减弱,仅为精氨酸加压素的1.3%~25%。随后发现[Val4,D-Arg8] VP(VDAVP)和[Mpa1,Val4,D-Arg8] VP(dVDAVP)也表现出对V2受体的高选择性,具有显著的抗利尿选择性[9-11]。Kwiatkowska等[12]对AVP 2位进行修饰,以3,3-二苯基-L-丙氨酸或其D-对映体(Dip或D-Dip)进行取代,发现[Mpa1,D-Dip2] AVP、[Mpa1,D-Dip2,Val4] AVP、[Mpa1,D-Dip2,D-Arg8] VP和[Mpa1,D-Dip2,Val4,D-Arg8] VP这4个化合物显示出较强的抗利尿活性,见表 2。
|
|
表 2 选择性加压素V2受体激动剂 |
1964年合成出第一个选择性V1a受体激动剂—[Phe2,Orn8] vasotocin,直到2002年才合成出第一个选择性V1b受体激动剂—d [Cha4] AVP。F-180(结构为[Hmp-Phe-Ile-Hgn-Asn-Cys-Pro-Dab(Abu)-Gly-NH2][13],其中:Hmp为2-羟基-3-巯基丙酸; Hgn为人谷氨酰胺;Dab为2,4-二氨基丁酸;Abu为2-氨基丁酸)显示出选择性较强的加压素V1a受体激动作用;由Ferring公司最新合成的FE 202158([Phe2,Ile3,Hgn4,Orn(iPr)8] AVP,其中iPr为异丙基),具有更强的加压素V1a受体激动作用,目前正在临床实验阶段,用于治疗因血管舒张引起的低血压[14],见表 3。
|
|
表 3 选择性加压素V1a和V1b受体激动剂 |
5种药典收载的加压素及其类似物的原料药有5种,制剂有11种[15-18],见表 4。
|
|
表 4 加压素及其类似物的原料药和制剂在各药典的收载情况 |
随着色谱技术的发展,杂质分析成为药品质量控制的主流,各国药典相继颁布杂质控制指导原则,并通过“已知杂质”、“单个未知杂质”和“总杂质”实现对化学药品中杂质的控制。下面汇总了7种加压素类似物的杂质标准要求[15-22]。
1)加压素,原料药收载于USP38,ChP2010未见收载。虽然在USP38中未列举可检测杂质,但在有关物质项下的系统适用性要求中规定,主峰与赖氨加压素峰的分离度不得小于1.1。
2)醋酸去氨加压素,去氨加压素原料药收载于EP8.0、BP2014及USP38,ChP2010未见收载。EP8.0中杂质项下列举了7种可检测杂质,其中杂质A、B和C分别为5位门冬酰胺或4位谷氨酰胺或9位甘氨酰胺的脱酰胺产物;杂质D为8位L-精氨酸消旋化产物;杂质E和F分别为4位谷氨酰胺或5位门冬酰胺乙酰氨甲基化的产物;杂质G为9位甘氨酰胺二甲基化产物。EP8.0、BP2014及USP38在含量测定及有关物质项下的系统适用性要求中均有规定,主峰与缩宫素峰(缩宫素的结构与去氨加压素的结构十分近似,仅在第1、3、8位有区别)的分离度不得小于1.5。USP38中在鉴别项下还采用MS测定分子量。
3)缩宫素,缩宫素原料药收载于EP8.0、BP 2014、J P 16及USP 38,ChP 2010未见收载。USP38未要求进行系统适用性实验,也未列举可检测杂质,只规定在含量测定时主峰与最近的杂质峰分离度不得小于1.5。USP38中在鉴别项下还采用NMR对结果进行确证。
4)苯赖加压素,是合成的醋酸九肽,氨基酸序列为:L-半胱氨酰-L-苯丙氨酰-L-苯丙氨酰-L-谷氨酰胺酰-L门冬酰胺酰-L半胱氨酰-L-脯氨酰-L-赖氨酰-L-甘氨酰胺环(1,6)-二硫化物。其抗利尿作用弱于血管加压素。当禁用拟交感神经药时,被作为口腔使用局麻药后的血管收缩剂,也作为治疗口腔疼痛和炎症的制剂成分之一。苯赖升压素原料药收载于EP8.0和BP2014,ChP2010未见收载。EP8.0中杂质项下列举了6种已知杂质,对每一种已知杂质都规定了限度范围。杂质A为1,6位半胱氨酸开环并乙酰胺甲基化的还原产物,杂质B和F分别为4位谷氨酰胺或5位门冬酰胺脱酰胺产物;杂质C和D分别为(1.6)(1.6) 或(1.1)(6.6)二硫键产物;杂质E为N端乙酰化产物。在含量测定及有关物质项下的系统适用性要求中规定,杂质C峰与杂质D峰的分离度不得小于1.5。
5)赖氨加压素,哺乳动物如猪等脑下垂体后叶分泌激素,与加压素结构唯一不同点在于第八位由精氨酸换成赖氨酸。USP38收载其鼻腔溶液。主峰与精氨酸加压素的分离度不得小于1.1。
6)特利加压素,氨基酸序列为L-甘氨酰-L-甘氨酰-L-甘氨酰-L-半胱氨酰-L-酪氨酰-L-苯丙氨酰-L-甘氨酰-L-天冬酰胺酰-L-半胱氨酰-L-脯氨酰-L-赖氨酰-L-甘氨酰胺环(1,6)-二硫化物。特利加压素自身无活性,其三甘氨酰基会被体内酶切除而以稳定速率缓慢地释放出赖氨加压素而获得加压素的生理活性。特利加压素可降低门静脉血压,但并不会像加压素一样对动脉血压产生明显的改变,也不会增加纤维蛋白的溶解作用。有关研究显示,特利加压素中可检测到以下11种已知杂质[D-Phe6]、[des-Gly1,Gly2,Gly3]、[des-Gly1,Gly2]、[des-Gly1]、[β-Asp8]、[Asp8]、[Glu7]、[Gly12-OH]、[Asp8,Gly12-OH]、[Glu7,Gly12-OH]、[Gly12-OEt]。
7)卡贝缩宫素,是合成的加压素类似物,氨基酸序列为丁酰-L-甲基酪氨酰-L-异亮氨酰-L-谷氨酰胺酰-L-门冬酰胺酰-L-半胱氨酰-L-脯氨酰-L-亮氨酰-L-甘氨酰胺环(1→6)一硫化物,据报道有更长的作用时间。有关研究显示,卡贝缩宫素中可检测到以下6种已知杂质,分别为5位门冬酰胺消旋化产物、6位半胱氨酸消旋化产物、卡贝加压素亚砜Ⅰ、卡贝缩宫素亚砜Ⅱ、4位谷氨酰胺脱酰胺产物、9位甘氨酰胺脱酰胺产物。
7 展望近几年来,对非肽类加压素类似物的研究成为国外各大制药企业的研究热点。人们开发AVP受体拮抗剂的兴趣开始于20世纪60年代初肽类AVP受体拮抗剂的开发[23]。然而,这些化合物生物半衰期短,口服生物利用度低,很难作为药物进一步研究开发。1991年第一个非肽类AVP受体拮抗剂OPC-21268在日本发现[24],这些非肽类的化合物比早些时候的肽类化合物有更好的生物利用度和较长的生物半衰期,并且在治疗低钠血症方面取得了突破性进展[25-28],见表 5。
|
|
表 5 非肽类加压素拮抗剂研究进展 |
在化学结构上,它们均是苯并氮杂卓或2-羟基吲哚的衍生物。已发现的各种AVP V2受体拮抗剂对受体作用的选择性不同,可分为选择性V2受体拮抗剂和V1a/V2双重受体拮抗剂。其中V1a/V2双重受体拮抗剂考尼伐坦(conivaptan)已于2005年被FDA批准上市,主要用于血容量正常的低钠血症治疗。选择性V2受体拮抗剂的代表药物有托伐普坦(tolvaptan)和利希普坦(lixivaptan),其中前者已于2009年被FDA批准上市用于低钠血症的治疗,后者目前仍处于注册阶段。此外,AVP V2受体拮抗剂在治疗多囊肾患者的肾功能衰竭、先天性尿崩症以及预防肝硬化腹水形成等方面的研究也在进行中。近几年,选择性V1a受体拮抗剂和选择性V1b受体拮抗剂也逐渐引起人们的重视,如三氮唑类选择性V1a受体拮抗剂PF-184563、内酰胺类选择性V1a受体拮抗剂SRX246和吲哚酮类选择性V1b受体拮抗剂SSR149415等[29]。Breuer等[30]对SSR149415进行了一系列药理试验,发现在治疗多动症、焦虑和抑郁症等方面表现出良好的开发前景,作为抗焦虑和抗抑郁症药物进入Ⅱ期临床研究。
| [1] |
Koshimizu TA, Nakamura K, Egashira N, et al. Vasopressin V1a and V1b Receptors: from Molecules to Physiological Systems[J]. Physiol Rev, 2012, 92(4): 1813-1864. DOI:10.1152/physrev.00035.2011 |
| [2] |
Thibonnier M, L N Berti-Mattera, N Dulin, et al. Signal Transduction Pathways of the Human V1-vascular, V2-renal, V3-pituitary Vasopressin and Oxytocin Receptors[J]. Prog Brain Res, 1998, 119: 147-161. |
| [3] |
Leng G, Sabatier N. Measuring Oxytocin and Vasopressin: Bioassays, Immunoassays and Random Numbers[J]. J Neuroendocrinol, 2016, 28(10). DOI:10.1111/jne.12413 |
| [4] |
Manning M, Stoev S, Chini B, et al. Peptide and Nonpeptide Agonists and Antagonists for the Vasopressin and Oxytocin V1a, V1b, V2 and OT Receptors: Research Tools and Potential Therapeutic Agents[J]. Prog Brain Res, 2008, 170: 473-512. DOI:10.1016/S0079-6123(08)00437-8 |
| [5] |
Rubin LH, Yao L, Keedy SK, et al. Sex Differences in Associations of Arginine Vasopressin and Oxytocin with Resting-state Functional Brain Connectivity[J]. J Neurosci Res, 2017, 95(1-2): 576-586. DOI:10.1002/jnr.23820 |
| [6] |
Szeto A1, McCabe PM, Nation DA, et al. Evaluation of Enzyme Immunoassay and Radioimmunoassay Methods for the Measurement of Plasma Oxytocin[J]. Psychosom Med, 2011, 73(5): 393-400. DOI:10.1097/PSY.0b013e31821df0c2 |
| [7] |
McCullough ME, Churchland PS, Mendez AJ, et al. Leng G, Sabatier N. Measuring Oxytocin and Vasopressin: Bioassays, Immunoassays and Random Numbers[J]. J Neuroendocrinol, 2016, 28(10). DOI:10.1111/jne.12413 |
| [8] |
张媛, 刘倩, 吴彦霖, 等. 第一批赖氨酸升压素国家标准品的制备[J]. 中国生物制品学杂志, 2014, 27(7): 923-926. |
| [9] |
Narayen G, Mandal SN. Vasopressin Receptor Antagonists and Their Role in Clinical Medicine[J]. Indian J Endocrinol Metab, 2012, 16(2): 183-191. DOI:10.4103/2230-8210.93734 |
| [10] |
Manning M, Misicka A, Olma A, et al. Oxytocin and Vasopressin Agonists and Antagonists as Research Tools and Potential Therapeutics[J]. J Neuroendocrinol, 2012, 24(4): 609-628. DOI:10.1111/j.1365-2826.2012.02303.x |
| [11] |
Holt NF, Haspel KL. Vasopressin: a Review of Therapeutic Applications[J]. J Cardiothorac Vasc Anesth, 2010, 24(2): 330-347. DOI:10.1053/j.jvca.2009.09.006 |
| [12] |
Kwiatkowska A, Sobolewski D, Prahl A, et al. Arginine Vasopressin and its Analogues-the Influence of Position 2 Modification with 3, 3-Diphenylalanine Enantiomers. Highly Potent V2 Agonists[J]. Eur J Med Chem, 2009, 44: 2862-2867. DOI:10.1016/j.ejmech.2008.12.010 |
| [13] |
Andre's M, Trueba M, Guillon G. Pharmacological Characterization of F-180:a Selective Human V1a Vasopressin Receptor Agonist of High Affinity[J]. Br J Pharmacol, 2002, 135: 1828-1836. DOI:10.1038/sj.bjp.0704634 |
| [14] |
Laporte R, Kohan A, Heitzmann J, et al. Pharmacological Characterization of FE 202158, a Novel, Potent, Selective, and Short-acting Peptidic Vasopressin V1a Receptor Full Agonist for the Treatment of Vasodilatory Hypotension[J]. J Pharmacol Exp Ther, 2011, 337: 786-796. DOI:10.1124/jpet.111.178848 |
| [15] |
Society of Japanese Pharmacopeia. Japanese Pharmacopoeia XVI[S].Tokyo:YAKUJINIPPO, 2011.
|
| [16] |
British Pharmacopeia Commission Office. British Pharmacopoeia[S]. London: The Stationery Office, 2015.
|
| [17] |
Council of Europe. European Pharmacopoeia 8.0 [S]. Nrdlingen:Druckerei C. H. Beck, 2014.
|
| [18] |
黄青, 陆益红, 史清水, 等. 高效液相色谱法测定缩宫素注射剂含量及其与生物效价测定法比较和应用[J]. 药物分析杂志, 2015, 35(6): 1115-1121. |
| [19] |
陈建国, 陆益红, 黄青, 等. 缩宫素的制备及其质量分析研究进展[J]. 中国生化药物杂志, 2012, 33(5): 698-700. |
| [20] |
李健和, 曹俊华, 周冬初, 等. 长效催产素受体激动剂卡贝缩宫素的药理作用与临床应用[J]. 中国新药与临床杂志, 2012, 31(3): 134-138. |
| [21] |
Chan WY, Wo NC, Stoev ST, et al. Discovery and Design of Novel and Selective Vasopressin and Oxytocin Agonists and Antagonists: the Role of Bioassays[J]. Exp Physiol., 2000, 85(9): 7S-18S. |
| [22] |
田文静, 任雪, 廖海明, 等. 多肽类药物质量控制研究进展[J]. 药物分析杂志, 2013, 33(7): 1115-1120. |
| [23] |
张大帅, 穆帅, 刘颖. 非肽类精氨酸加压素受体拮抗剂的研究进展[J]. 中国药物化学杂志, 2014, 24(2): 103-115. |
| [24] |
Yamamura Y, Ogawa H, Chihara T, et al. OPC-21268, as an Orally Effective, Nonpeptide Vasopressin V1 Receptor Antagonist[J]. Science, 1991, 252: 572-574. DOI:10.1126/science.1850553 |
| [25] |
Serradeil-Le Gal C, Wagnon J, Garcia C, et al. Biochemical and Pharmacological Properties of SR 49059, a New, Potent, Nonpeptide Antagonist of Rat and Human Vasopressin V1a Receptors[J]. J Clin Invest, 1993, 92: 224-231. DOI:10.1172/JCI116554 |
| [26] |
Ferguson-Myrthil N. Novel Agents for the Treatment of Hyponatremia: a Review of Conivaptan and Tolvaptan[J]. Cardiol Rev, 2010, 18: 313-321. DOI:10.1097/CRD.0b013e3181f5b3b7 |
| [27] |
Naidech AM, Paparello J, Liebling SM, et al. Use of Conivaptan (Vaprisol)for Hyponatremic Neuro-ICU Patients[J]. Neurocrit Care, 2010, 13: 57-61. DOI:10.1007/s12028-010-9379-5 |
| [28] |
Schrier RW, Gross P, Gheorghiade M, et al. Tolvaptan, a Selective Oral Vasopressin V2-receptor Antagonist, for Hyponatremia[J]. N Engl J Med, 2006, 355: 2099-2112. DOI:10.1056/NEJMoa065181 |
| [29] |
Griffante C, Green A, Curcuruto O, et al. Selectivity of d[Cha4]AVP and SSR149415 at Human Vasopressin and Oxytocin Receptors: Evidence that SSR149415 is a Mixed Vasopressin V1b. Oxytocin Receptor Antagonist[J]. Br J Pharmacol, 2005, 146: 744-751. DOI:10.1038/sj.bjp.0706383 |
| [30] |
Breuer ME, van Gaalen MM, Wernet W, et al. SSR149415, a Non-peptide Vasopressin V1b Receptor Antagonist, has Long-lasting Antidepressant Effects in the Olfactory Bulbectomy-induced Hyperactivity Depression Model[J]. Naunyn Schmiedebergs Arch Pharmacol, 2009, 379(1): 101-106. DOI:10.1007/s00210-008-0336-1 |
 2017, Vol. 31
2017, Vol. 31 
