水溶性维生素是人体维持正常生理功能所必须的一类微量有机物质,适量摄取对生长、代谢、发育都起到了积极的促进作用,而过量摄入却会造成严重危害[1-4]。随着食品工业的发展和人们对保健食品需求程度的日渐提高,市场上出现了各类添加水溶性维生素的保健食品,虽然已引起了质量监督部门极大的重视,但目前我国仍未完善针对此类商品功效成分检测的相关标准,在实际应用中只能参考食品标准。由于水溶性维生素之间结构及化学性质相差很大,同时测定比较困难,所以,目前国标法测定食品中水溶性维生素采用多种条件分别测定。以婴幼儿食品和乳品的检测为例,其中维生素B1、B2、B6分别采用高效液相色谱法(HPLC)配荧光检测器[5-7]; 泛酸、生物素、叶酸、维生素B12分别采用微生物法[8-11]; 烟酸、烟酰胺采用HPLC配紫外检测器[12]; 维生素C采用荧光分光光度法[13]。这些方法多数涉及繁杂费时的前处理,并不适用于基质相对简单的保健食品,反而降低了待测组分的回收率。另外,近年来,也有水溶性维生素检测方法研究的相关报道[14-22],较为集中使用了HPLC法,然而水溶性维生素大多以离子形态存在于水溶液中,在反相色谱柱上的保留能力较差,所以,文献中大多采取在流动相中加入对柱效及泵损害较大的离子对试剂或衍生的方法改善峰形和分离度。即便如此,由于维生素添加量相差很大,从μg/100 g级到g/100 g级,普通检测器很难同时保证各种待测物都具有较高的灵敏度,因此,仍然很少有研究能够同时检测10种及以上水溶性维生素。可见,建立一种同时定量分析保健食品中多种水溶性维生素的方法非常必要。
本研究建立了一种简便、快速、准确、灵敏的超高效液相色谱-串联质谱(UPLC-MS/MS)方法[23-25],以甲醇-水体系作为流动相,在5.5 min内,实现对10种水溶性维生素进行同步分析,测定结果与国标法相吻合,适用于保健食品中多种水溶性维生素同时定量检测,显著提高了分析效率,并降低了检测成本。
1 材料与方法 1.1 材料与试剂10种水溶性维生素标准物质:维生素B1 (含量99.9%,批号D2229)、维生素B2(含量99.5%,批号160608)、泛酸钙(含量97.0%,批号501109)、维生素B6(含量99.9%,批号D3115A)、生物素(含量99.0%,批号50603)、叶酸(含量91.3%,批号40814)、维生素B12(含量98.4%,批号30630)、维生素C (含量98.4%,批号160810)、烟酸(含量99.8%,批号40206) 和烟酰胺(含量99.9%,批号40227),均购自德国Dr Ehrenstorfer GmbH公司;甲醇、甲酸(色谱纯,德国Merck公司);氨水(26%,g/v),醋酸铵、冰醋酸(分析纯,国药集团化学试剂有限公司)。
1.2 仪器与设备1290-6460型超高效液相色谱-串联质谱仪,配电喷雾电离源(美国Agilent公司);AL204电子天平(瑞士METTLER TOLEDO公司);高速离心机(日本HITACH公司);超声波提取器(武汉中科公司)。
1.3 方法 1.3.1 溶液的配制样品溶液:准确称取2 g试样(精确至0.01 g)于50 mL棕色量瓶中,加入40 mL水,超声(频率:40 kHz,功率:100 W)10 min,冷却至室温,用水定容至刻度,摇勻,上清液经微孔滤膜过滤,供液相色谱-串联质谱仪测定。
空白基质溶液:取不含待测组分的保健食品样品,按照“1.3.1.1”节方法操作,收集滤液即得。
维生素B1标准储备液:称取相当于硫胺素0.1 g(精确至0.0001 g)的维生素B1标准品,加入30 mL水溶解,甲酸调节pH值至2.0后,用水转移并定容于100 mL棕色量瓶中。置于0~4 ℃冰箱中,保存期为3个月。
维生素B2标准储备液:称取维生素B2标准品0.1 g(精确至0.0001 g),加入30 mL氨水溶液[水-氨水(V/V)=5:1]溶解,用水转移并定容至100 mL棕色量瓶中。置于0~4 ℃冰箱中,保存期为3个月。
生物素、叶酸标准储备液:分别称取生物素、叶酸标准品0.1 g(精确至0.0001 g),加入30 mL氨水溶液[水-氨水(V/V)=5:1]溶解,甲酸调节pH值至7.0后,用水转移并定容至100 mL棕色量瓶中。置于0~4 ℃冰箱中,保存期为3个月。
维生素C标准储备液:称取维生素C标准品0.1 g(精确至0.0001 g),用醋酸氨缓冲溶液溶解,转移并定容至100 mL棕色量瓶中。临用时配制。
维生素B6、维生素B12、烟酸、烟酰胺、泛酸标准储备液:分别称取维生素B6、维生素B12、烟酸、烟酰胺和泛酸相当于0.1 g的标准品(精确至0.0001 g),用水溶解,转移并定容至100 mL棕色量瓶中。置于0~4 ℃冰箱中,保存期为3个月。
维生素B1基质标准工作液:准确吸取维生素B1准储备液适量,用空白基质溶液将其稀释成含量分别为0.01、0.05、0.1、0.5、1 μg·mL-1的基质标准工作液。
维生素C基质标准工作液:准确吸取维生素C标准储备液适量,用空白基质溶液将其稀释成含量分别为0.1、0.2、0.5、1、10 μg·mL-1的基质标准工作液。
8种维生素基质混合标准工作液:准确吸取维生素B2、泛酸、生物素、维生素B6、叶酸、维生素B12、烟酸、烟酰胺标准储备液适量,用空白基质溶液将其稀释成含量分别为0.01、0.05、0.1、0.5、1 μg·mL-1的基质混合标准工作液。
1.3.2 色谱条件色谱柱:Waters ACQUITY UPLC HSS T3 (2.1 mm × 100 mm,1.8 μm); 流速0.3 mL·min-1;柱温30 ℃; 进样量为2 μL; 流动相梯度洗脱程序见表 1。
|
|
表 1 流动相梯度洗脱程序 |
离子源:电喷雾离子化(ESI)正离子模式;雾化气温度:300 ℃;雾化气流速:5 L·min-1;喷雾气压力:45 psi;毛细管电压:3500 V;多反应监测扫描(MRM)采集参数见表 2。
|
|
表 2 液质采集参数 |
水溶性维生素对温度、光照、pH值等因素均较敏感[26-27],所有操作应避免强光高温。测定的10种水溶性维生素中,维生素B2、生物素和叶酸在常温下溶解性差,易溶于碱性溶液,所以加入氨水溶液,充分溶解后,用甲酸调节pH值至7.0, 再加水定容,使溶液仍保持中性,不影响各个组分的稳定性。和维生素C在中性及碱性条件下均易发生氧化降解,所以单独在酸性条件下配制,以延长其标准溶液的稳定性。
2.2 提取溶剂的优化水溶性维生素易溶于水、甲醇和乙醇,且pH值对10种待测组分的稳定性及溶解性的影响存在差异,故本研究分别选取水、醋酸铵缓冲溶液(pH 4.5)、甲醇和乙醇作为提取溶剂,以空白样品的添加回收率作为评价指标,进行比对试验。结果表明,以水为提取溶剂时,10种维生素的回收率均较高,且重现性好,因此,本研究选择水作为提取溶剂。
2.3 提取方法的优化以水作为提取溶剂,分别考察了涡旋1、2、3 min和超声5、10、15 min两种提取方式。如图 1所示,置于离心管中的涡旋提取样品由于受到光照导致分解,大部分待测组分随着提取时间的延长,回收率持续下降,提取率在70%左右。超声提取样品全程在棕色容量瓶中操作,样品回收率随着提取时间的增加先上升,但由于继续超声引起温度逐步升高,维生素B2和叶酸等受热易分解组分的回收率随之呈现下降趋势。试验表明,超声提取的效果较好,10种待测物的回收率均达到85%以上。因此,最终将提取方式确定为超声10 min。

|
图 1 10种维生素提取效果比较 |
本研究比较了高强度桂胶颗粒填充的Waters ACQUITY HSS C18(2.1 mm × 100 mm, 1.8 μm)和Waters ACOUTITY UPLC HSS T3(2.1 mm × l00 mm,1.8 μm)2种色谱柱,发现由于水溶性维生素大多以离子形态存在于水溶液中的特性,在反相C18柱上的保留能力较差,在相同流动相下,10种维生素在C18色谱柱上基本没有保留,大部分在1 min内流出,而T3色谱柱大大地增强了对极性分子的反相保留能力,可以对待测物进行很好的分离,从而准确定性及定量。
2.3.2 色谱条件的选择本研究首先比较了水-乙腈和水-甲醇流动相体系,发现乙腈在本仪器上噪音较大,基底较高,放弃使用。而以水-甲醇作为流动相时,维生素B1拖尾,维生素C和叶酸均呈双峰,影响定量分析,故优化为0.1%甲酸水溶液-甲醇和0.1%甲酸水溶液-0.1%甲酸甲醇溶液,以不同流速、配比和梯度程序分离待测物。结果表明,采用0.1%甲酸水溶液-0.1%甲酸甲醇溶液进行梯度洗脱,10种水溶性维生素在6 min内获得良好的分离及峰形。
2.3.3 基质效应由于分析物与基质中非挥发性样品提取物的相互作用会产生一定的信号增强或抑制。本研究发现,采用ESr源测定保健食品中的水溶性维生素时有较强信号抑制的基质效应,按照Matuszewski等[28]建立的数学模型评定基质效应的影响,采用提取后添加法:比较2种不同条件下的信号峰面积平均值,其中Sl为标准品溶液的色谱峰面积,S2为样品基质提取后添加标准溶液的色谱峰面积,绝对基质效应(ME)/%=S2/Sl×100。当ME为100%时,表明没有绝对基质效应;当ME大于100%时,表明有信号增强;当ME小于100%时,表明有信号抑制。本试验测定维生素时的ME在70% ~ 125%,存在较强的基质效应,故采用基质匹配标准溶液绘制标准曲线来减小基质效应对定量结果的影响。
2.3.4 质谱条件的选择在电喷雾质谱、正离子检测方式下,烟酸、烟酰胺、维生素B2、叶酸、生物素的母离子峰均为[M+H]+峰;维生素B12断裂成2个分子,形成[M/2+H]++双电荷峰。维生素C是一种含有6个碳原子的酸性多羟基化合物,在ESI+模式下,形成[M-6H+H]+峰,其响应值相对ESI-模式较低,相同浓度的维生素C在ESI+和ESI-模式下,峰面积相差1倍左右,如果样品中维生素C含量比较低,可以选择ESI-模式,但是保健食品中维生素C含量比较高,不影响最终定量,统一选择ESI+模式,可以避免正负模式转换导致瞬间信号不稳定,造成其他水溶性维生素响应值波动,影响最终定量。
试验考察了干燥器温度在200 ~ 350 ℃变化对离子强度的影响,结果表明,当在200 ~ 300 ℃时,随着温度的升高,各目标物的响应值随之增高,当温度在300 ~ 350 ℃时,部分维生素的峰响应值有所下降,分析原因为部分维生素在高温下分解所致毛细管电压考察试验发现,在2000 ~ 3500 V之间,待测物的离子强度随压力增高而显著增强,而继续升高电压对离子强度无明显影响;通过比较干燥气流速在3 ~ 7 L·min-1时各维生素的离子强度变化情况,得知,干燥气流速为5 L·min-1时目标物响应值均较高;雾化气压力经考察后发现对目标物的影响微乎其微,因此,经过优化后的主要参数为干燥气温度为300 ℃,毛细管电压为3500 V,干燥气的流速为5 L·min-1,雾化气压力为45 psi。各维生素液体保健食品样品空白加标的MRM色谱图见图 2。
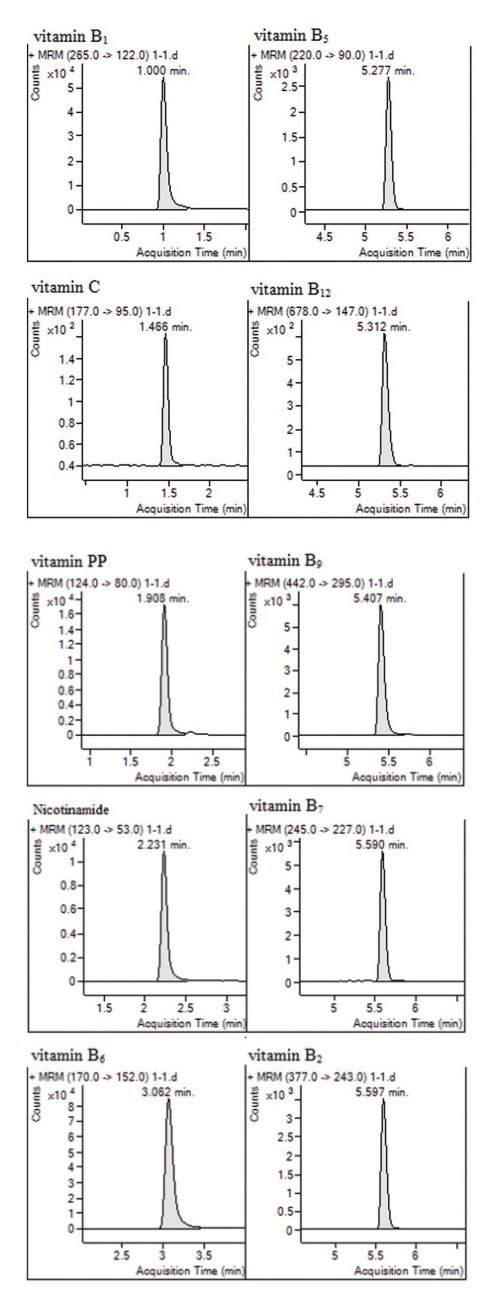
|
图 2 液体样品空白加标的MRM色谱图 |
采用基质匹配-外标法定量分析10种水溶性维生素。分别以保健食品固体类和液体类的空白基质溶液配制不同浓度范围的水溶性维生素混合标准溶液,在优化的方法条件下进行测定,以峰面积(y)为纵坐标,质量浓度(x,μg·mL-1)为横坐标,绘制标准曲线。所得回归方程表明,10种维生素均具有良好的线性关系(r≥0.9900),以3倍信噪比(S/N)确立方法的检出限(limit of detection, LOD)为5~250 μg·kg-1,结果见表 3。
|
|
表 3 不同基质10种水溶性维生素的基质匹配线性方程、相关系数和检出限(n=6) |
分别在空白基质溶液中添加3个浓度水平的标准溶液,每个浓度水平按照本方法分析6次,进行回收率和精密度试验。3个添加水平的回收率为85.9%~109.5%,RSD(n=6) 为1.09%~6.79%,结果见表 4。
|
|
表 4 不同基质保健食品中10种水溶性维生素的平均回收率与精密度(n=6) |
为考察方法的普遍适用性,本试验随机抽取市售的固体类和液体类维生素强化保健食品共8份,应用本方法(UPLC-MS/MS)及婴幼儿食品和乳品的国标检测方法(GB)分别进行测定,不同方法测定结果误差较小,相对误差(fractional error,FE)均在允许范围内,且与厂家标示范围基本吻合,结果见表 5。因此,本研究为此类保健食品市场监测及验证提供了可靠、快速的方法。
|
|
表 5 8种保健食品样品中水溶性维生素含量测定结果 |
本文建立了UPLC-MS/MS同时检测维生素强化类保健食品中10种水溶性维生素的分析方法,该法结果准确,操作简便,有效地提高了分析效率和灵敏度,排除了基质干扰,能够对水溶性维生素进行准确的定性及定量,适用于保健食品中水溶性维生素的确证分析检测。
| [1] |
王一红, 冯家力, 潘振球, 等. 液相色谱-串联质谱法分析10种水溶性维生素[J]. 中国卫生检验杂志, 2007, 17(7): 1160-1162. |
| [2] |
缪璐, 莫佳琳, 周红尖, 等. 液质联用仪同步检测婴幼儿配方食品中11种水溶性维生素[J]. 现代食品科技, 2015, 31(7): 347-353. |
| [3] |
Christopher J Blake. Analytical Procedures for Watersoluble Vitamins in Foods and Dietary Supplements:a Review[J]. Analytical and Bioanalytical Chemistry, 2007, 389(1): 63-76. DOI:10.1007/s00216-007-1309-9 |
| [4] |
刘源, 翟丽屏, 相有章, 等. 维生素分析方法的研究现状及进展[J]. 中国地方病防治杂志, 2006, 21(1): 29-31. |
| [5] |
中华人民共和国卫生部. GB 5413. 11-2010食品安全国家标准婴幼儿食品和乳品中维生素B1的测定[S]. 2010.
|
| [6] |
中华人民共和国卫生部. GB 5413. 12-2010食品安全国家标准婴幼儿食品和乳品中维生素B2的测定[S]. 2010.
|
| [7] |
中华人民共和国卫生部. GB 5413. 13-2010食品安全国家标准婴幼儿食品和乳品中维生素B6的测定[S]. 2010.
|
| [8] |
中华人民共和国卫生部. GB 5413. 14-2010食品安全国家标准婴幼儿食品和乳品中维生素B12的测定[S]. 2010.
|
| [9] |
中华人民共和国卫生部. GB 5413. 16-2010食品安全国家标准婴幼儿食品和乳品中叶酸的测定[S]. 2010.
|
| [10] |
中华人民共和国卫生部. GB 5413. 17-2010食品安全国家标准婴幼儿食品和乳品中泛酸的测定[S]. 2010.
|
| [11] |
中华人民共和国卫生部. GB 5413. 19-2010食品安全国家标准婴幼儿食品和乳品中游离生物素的测定[S]. 2010.
|
| [12] |
中华人民共和国卫生部. GB 5413. 15-2010食品安全国家标准婴幼儿食品和乳品中烟酸和烟酰胺的测定[S]. 2010.
|
| [13] |
中华人民共和国卫生部. GB 5413. 18-2010食品安全国家标准婴幼儿食品和乳品中维生素C的测定[S]. 2010.
|
| [14] |
A A Bendryshev, E B Pashkova, A V Pirogov. Determination of Water-soluble Vitamins in Vitamin Premixes, Bioactive Dietary Supplements, and Pharmaceutical Preparations Using High-efficiency Liquid Chromatography with Gradient Elution[J]. Moscow University Chemistry Bulletin, 2010, 65(4): 260-268. DOI:10.3103/S0027131410040103 |
| [15] |
蒲明清, 戴舒春, 张连龙, 等. 超高效液相色谱法测定保健食品中的多种水溶性维生素[J]. 现代食品科技, 2012, 28(7): 886-889. |
| [16] |
刘娜, 陈大舟, 汤桦, 等. 婴儿配方奶粉中8种水溶性维生素的高效液相色谱同时测定[J]. 分析测试学报, 2008, 27(4): 408-411. |
| [17] |
王浩, 刘艳琴, 杨红梅, 等. HPLC法同时测定婴幼儿配方奶粉中5种水溶性维生素[J]. 中国乳品工业, 2009, 37(10): 56-58. DOI:10.3969/j.issn.1001-2230.2009.10.015 |
| [18] |
崔蓉, 李皎, 王洪伟. 水溶性维生素的高效液相色谱法测定方法的研究[J]. 中国卫生检验杂志, 2005, 15(1): 55-57. |
| [19] |
周迅雷, 张志国, 褚庆环, 等. 食品中VB 12检测方法研究进展[J]. 食品与发酵工业, 2008, 34(11): 131-134. |
| [20] |
鲁杰, 杨大进, 王竹天. 固相萃取-高效液相色谱法测定保健食品中维生素B12的研究[J]. 中国食品卫生杂志, 2004, 16(4): 324-328. |
| [21] |
鲁杰, 杨大进, 王竹天. 维生素B 12化学分析法研究概况[J]. 中国食品卫生杂志, 2003, 15(3): 248-252. |
| [22] |
雷涛, 张辉, 韩惠雯, 等. 婴幼儿配方奶粉中水溶性维生素的检测方法研究[J]. 乳业科学与技术, 2007, 2: 81-83. DOI:10.3969/j.issn.1671-5187.2007.02.008 |
| [23] |
WANG Yi-hong, FENG Jia-li, PAN Zhen-qiu, et al. Analysis of 10 Water Soluble Vitamis by Liquid Chromatography-tandem Mass Spectrometry[J]. Chinese Journal of Health Laboratory Technology, 2007, 11(7): 1160-1162. |
| [24] |
夏静, 俞婧, 孙磊, 等. 功能性饮料中9种水溶性维生素的HPLC-MS-MS同步检测技术[J]. 食品科学, 2014, 35(12): 196-199. DOI:10.7506/spkx1002-6630-201412040 |
| [25] |
Baiyi Lu, Yiping Ren, Baifen Huang. Simultaneous Determination of Four Water-Soluble Vitamins in Fortified Infant Foods by Ultra-Performance Liquid Chromatography Coupled with Triple Quadrupole Mass Spectrometry[J]. Journal of Chromatographic Science, 2008, 46(3): 225-232. DOI:10.1093/chromsci/46.3.225 |
| [26] |
王叔淳. 食品卫生检验技术手册[M]. 北京: 化学工业出版社, 2002: 148-151.
|
| [27] |
郭兴会, 王丽丽, 仪宏. HPLC法有效测定发酵液中维生素B12的含量[J]. 中国食品添加剂, 2009(1): 152-156. |
| [28] |
MATUSZEWSKI B K, CONSTANZER M L, CHAVEZENG C M. Strategies for the Assessment of Matrix Effect in Quantitative Bioanalytical Methods Based on HPLC-MS/MS[J]. Anal Chem, 2003, 75(13): 3019-3030. DOI:10.1021/ac020361s |
 2017, Vol. 31
2017, Vol. 31 
