中药化学对照品是用于中药材(饮片)、提取物、中成药等检验的国家药品标准物质,在中药产品检验、科研及新药研发工作中发挥着重要作用。由于中药化学对照品原料来自天然,其特点是结构复杂,制备困难,标定难度大。目前,中药化学对照品采用国际通用的质量平衡法赋值以保证量值的准确性,同时采用外标法等进一步佐证;其中质量平衡法涉及纯度、水分、残留溶剂及无机杂质等诸多测定环节[1-2]。为更好地保障中药化学对照品结构与定值准确,首批品种尚需结构鉴定以及定量核磁共振等其他分析技术加以赋值佐证[3-4]。
本文针对中药化学对照品首批品种与换批品种在标定赋值试验过程中常见问题进行了总结分析,主要包括结构鉴定、纯度分析、水分测定、残留溶剂、无机盐及其他理化参数测定等项目,并针对不同检测项有关问题提出相应的解决办法,为中药化学对照品的标定和使用提供了有利的技术支持。
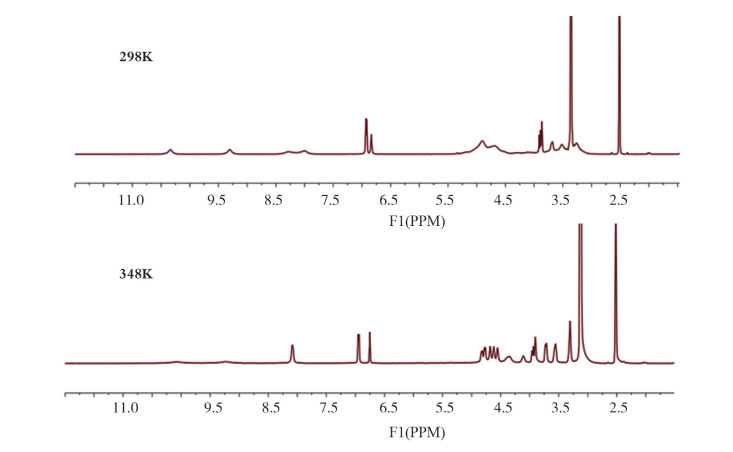
1 结构鉴定天然产物成分结构复杂多样,且存在立体异构、构造异构等多种异构形式,而中药化学对照品多从天然产物中提取精制获得,因此,结构鉴定工作尤为重要,是保证发放对照品准确的源头保障环节。鉴于中药化学对照品以已知化合物为主,因此,结构鉴定工作通常结合紫外光谱、红外光谱、质谱、1H NMR、13C NMR等谱学测试进行分析。但是,对于一些结构复杂的成分尚需进一步的谱学分析:1)对于地榆皂苷I、通光散苷A、巴戟天寡糖5聚糖等(结构见图 1)三萜皂苷、甾体皂苷和寡糖等类成分,还需要结合2D NMR(HSQC、HMBC、1H-1H COSY)、NOE、NOESY等核磁技术,以准确鉴定糖苷键连接位置及构型等信息。2)对于夏佛塔苷(结构见图 1)等黄酮碳苷类成分,由于碳苷黄酮结构中碳碳键旋转位阻,导致其常温核磁氢谱信号缺失,且无裂分,难以进行结构解析。采用升温核磁技术即可解决这一问题(图 2),这是由于测定温度升高,碳碳单键旋转能垒降低,从而可以获得清晰信号,便于结构鉴定[5]。3)对于亮蓝等色素类成分(结构见图 1),尽管水溶性好,但核磁测试过程中发现,相同测定条件下氘代甲醇较氘代水作溶剂获得的信号裂分更为明显。

|
图 1 中药化学对照品结构 |
|
图 2 夏佛塔苷1 H NMR谱图(298K和348K) |
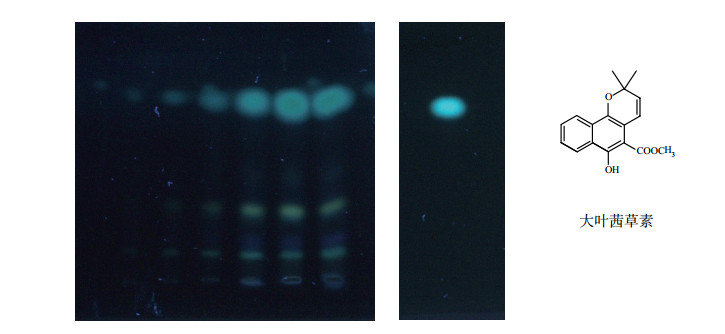
中药化学对照品纯度分析多采用薄层色谱(Thin Layer Chromatography, TLC)与高效液相色谱(High Performance Liquid Chromatography, HPLC)等进行。TLC法检测纯度试验过程中,发现个别品种如大叶茜草素和朝藿定C,在使用半自动薄层点样仪点样时会出现杂质斑点,而手动快速点样则无杂质斑点检出(图 3)。该现象表明这些杂质斑点并非样品本身所有,而是在仪器点样过程中产生,应予以关注。
|
图 3 大叶茜草素薄层色谱图(左:半自动点样仪点样;右:手动点样)及结构 硅胶G板,展开剂:石油醚(60~90℃)-丙酮(4 : 1),紫外366 nm下检视。 |
HPLC法分析纯度多采用紫外检测器与蒸发光散射检测器,分别适用于有紫外吸收与无紫外吸收化合物的分析。HPLC法进行纯度分析需要注意样品的溶解性,通常采用甲醇、水、甲醇-水。其中,黄酮类中药化学对照品溶解性相对较差,常需超声溶解;其他个别品种较为特殊,如靛蓝在N,N-二甲基甲酰胺/N,N-二甲基乙酰胺中溶解性较好。
3 水分测定水分测定采用库仑法卡氏水分仪,需要注意的是极具引湿性样品测定时要注意除湿以避免环境湿度影响测定结果。此外,对于结晶性样品若滴定过程中发现溶解不好应研磨后测定,以缩短滴定时间,保证测定结果准确,如水苏糖、耐斯糖等品种。
4 残留溶剂残留溶剂的测定采用气相色谱法(Gas Chromatography, GC)。需要指出的是,对于残留溶剂未知的样品,可以采用热重分析-气质联用技术(Thermo Gravimetric Analysis-Gas Chromatography-Mass Spectromety, TGA-GC-MS/MS)快速鉴定。该法可直接对固体样品进行测定,大大减少了有机溶剂的使用,更为简便、高效、环境友好,且对多种残留溶剂样品优势更为显著[6]。
5 无机杂质无机杂质参照炽灼残渣法(《中国药典》 2015年版四部)测定。对于无机盐形式存在的样品,还需结合更为准确的离子色谱等技术测定无机离子实际含量。
6 其他理化参数其他重要理化参数还包括熔点、比旋光度等。其中,样品结晶与否或晶型差异均可导致熔点测定结果出现一定偏差。比旋光度测定时应注意测试溶剂与浓度,有利于准确判断测定结果。
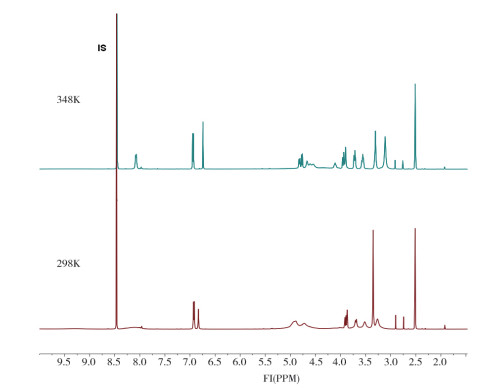
7 定值目前,中药化学对照品采用国际通用的质量平衡法赋值,计算公式:含量% =纯度%×(1-水分%-残留溶剂%-炽灼残渣%)×100%。此外,换批品种通常采用外标法进一步佐证定值;首批品种须其他方法佐证,尤以定量核磁共振技术(quantitative nuclear magnetic resonance,qNMR)最为常用,如夏佛塔苷采用升温定量核磁技术(图 4)测定结果与质量平衡法赋值结果基本一致。
|
图 4 夏佛塔苷氢核磁定量分析测试谱图(298K和348K, IS为内标) |
定量核磁共振技术具有测定时间短、样品需用量少、高灵敏度等优势,可以一步测定中药化学对照品绝对含量,不受水分、残留溶剂和无机杂质的影响,操作相对简单,近年来在标准物质与药品质量控制研究领域应用广泛[7-10]。目前,qNMR法已收载于《中国药典》2015年版四部[11]、美国药典35版[12]、欧洲药典7.8版[13]和日本药局方16版第一增补本[14]。由于中药化学对照品结构种类繁多,复杂纯化工艺获得,特别是对于三萜皂苷、甾体皂苷及寡糖等类成分而言,由于氢信号重叠较为严重,无法选择定量信号,此时,难以应用此法对首批品种进行辅助定值加以佐证。
协作标定也是中药化学对照品标定赋值的重要手段,过程中应对协作标定的组数,每组测定的次数,以及对结果误差进行统计分析,以确保结果的准确性。
中药化学对照品是一类具有法定意义的国家标准物质,在中药产品检验、科研、新药研发等工作中发挥着极为重要的作用。因此,需要经过严格的鉴定和分析,保障结构鉴定与标定赋值的准确性。本文通过总结分析上述常见问题,为中药化学对照品的准确使用以及中药检验有关问题的解决提供了科学借鉴与实际参考。
| [1] |
马玲云, 马双成. 中药标准物质的发展现状与展望[J]. 中国药事, 2010, 24(12): 1232-1235. |
| [2] |
刘静, 胡晓茹, 王明娟, 等. 金丝桃苷对照品的定值研究[J]. 药物分析杂志, 2015, 35(3): 524-527. |
| [3] |
Wu Yan, He Yi, HE Wenyi, et al. Application of Quantitative 1H NMR for the Calibration of Protoberberine Alkaloid Reference Standards[J]. J Pharm Biomed Anal, 2014, 90: 92-97. DOI:10.1016/j.jpba.2013.11.018 |
| [4] |
马康, 苏福海, 王海峰, 等. 有机纯度标准物质定值技术研究进展[J]. 分析测试学报, 2013, 32(7): 901-908. |
| [5] |
Liu Jing, Liu Yang, Dai Zhong, et al. Structural and Quantitative Analysis of Three C-glycolsylflavones by Variable Temperature Proton Quantitative Nuclear Magnetic Resonance[J]. J Anal Methods Chem, 2017. DOI:10.1155/2017/4934309 |
| [6] |
刘静, 何轶, 戴忠, 等. 热重-气质联用法快速鉴别熊果酸对照品原料中残留溶剂[J]. 分析试验室, 2016, 35(10): 1144-1146. |
| [7] |
刘阳, 周颖, 张才煜, 等. 核磁共振定量法测定脒基吡唑含量[J]. 药物分析杂志, 2014, 34(6): 1087-1090. |
| [8] |
Wang Wenguang, Ma Xiaoli, Guo Xiaoyu, et al. A Series of Strategies for Solving the Shortage of Reference Substances for Multi-components Determination of Traditional Chinese Medicine Mahoniae Caulis as a Case[J]. J Chromat A, 2015, 1412: 100-111. DOI:10.1016/j.chroma.2015.08.015 |
| [9] |
Shen Shi, Yao Jing, Shi Yaqin. Quantitative Proton Nuclear Magnetic Resonance for the Structural and Quantitative Analysis of Atropine Sulfate[J]. J Pharm Biomed Anal, 2014, 89(4): 118-121. |
| [10] |
许磊, 温时媛, 王跃飞, 等. NMR法同时测定注射用丹参多酚酸中的迷迭香酸、紫草酸、丹酚酸B和甘露醇[J]. 中成药, 2015, 37(10): 2185-2189. |
| [11] |
中国药典: 四部[S]. 2015.
|
| [12] |
USP 35-NF30[S]. 2012:761.
|
| [13] |
EP 7.7[S]. 2013:2.2.33.
|
| [14] |
JP ⅩⅥ[S]. 2011:SupplementⅠ2564.
|
 2017, Vol. 31
2017, Vol. 31 
