乙型肝炎病毒(H B V)、丙型肝炎病毒(HCV)及人类免疫缺陷病毒(HIV)等传染病病原体感染是威胁全球人类健康及血液安全的重大问题。由肝炎病毒感染引起的病毒性肝炎是目前我国最常见和发病率最高的传染病,而感染HIV引起的艾滋病是目前我国年致死人数最多的传染病。中国疾病预防控制中心统计数字显示,截至2018年,我国约有9300万乙肝病毒携带者,占全球乙肝病毒携带者总数的1/3,丙肝病毒携带者约760万,存活艾滋病病毒感染者和病人约86万,新报告的艾滋病病例约14万,艾滋病死亡病例达3.8万[1]。通过实施“预防为主”的乙肝疫苗免疫接种策略,乙肝在我国的发病率已明显降低[2]。但是,由于疫苗和药物广泛应用,导致肝炎病毒突变率居高不下,这对肝炎病毒的检测和肝炎的防治带来了新挑战[3]。对于艾滋病的预防,目前还没有有效的疫苗,尽管我国已实施多种防治措施,但是,艾滋病发病率仍在快速增长,并呈现流行范围广、地区差异大、发病和死亡严重、疫情从高危人群向一般人群传播等特点[4],使得艾滋病防治难度进一步加大,HIV病毒检测也面临严峻挑战。输血传播是艾滋病和肝炎等传染病传播的重要途径之一,应用有效的检测试剂对血源进行病原体筛查,以便及时甄别被感染者是目前预防和控制肝炎、艾滋病及其他输血传染病的关键,也是保证血液质量和安全用血的基础。
世界卫生组织(World Health Organization,WHO)于2009年发布了《血液筛查建议书》(以下简称“《建议书》”)[5],建议对所有捐献的全血和单采血液在批准放行供临床使用或血液制品生产前,都必须经过输血传播感染筛查;强制要求对HIV、HBV、HCV和梅毒螺旋体进行筛查。我国自1998年10月1日起施行《中华人民共和国献血法》 [6],其中第十条规定血站对采集的血液必须进行检测,未经检测或者检测不合格的血液,不得向医疗机构提供。我国对血源筛查检测方法的规定最早见于卫生部1997年8月20日发布实施的《输血技术操作规程(血站部分)》(卫医发〔1997〕第28号)[7],要求对采集的血液进行HBV表面抗原、HCV抗体、HIV抗体检测,及梅毒试验(RPR法或TRUST法)。
用于病原体检测的试剂分为血清学检测和核酸检测两大类。血清学检测是通过抗原抗体特异性结合的免疫反应,对病原体进行定性和定量检测,主要包括酶联免疫吸附法(Enzyme Linked Immunosorbent Assay,ELISA)和化学发光免疫分析法(Chemiluminescent Immunoassay,CLIA)。采用血清学检测试剂进行血源筛查是WHO公认的判断病原体感染的重要手段,也是目前临床上应用最多的检测方法。我国血源筛查主要采用的是ELISA法,并取得了很好的效果。然而,血清学检测具有很大局限性,首先是对一些复制水平低,以及基因突变造成表面抗原构象变化的隐匿性病毒,血清学检测试剂的抗体不能有效识别,导致检测假阴性[8]。而一项检测真实临床患者样本的研究[9]显示,中国人群中HBV B基因型和C基因型的突变率分别高达73%和67%。另外,病原体感染存在“窗口期”,即病毒进入人体以后,需要经过一段时间后才能出现抗体反应,在此期间病毒数量迅速扩增,却不会被血清学抗体检测试剂检出,造成漏检。尽管多项研究[10-12]报道,CLIA法对病毒感染具有优异的检出能力,但是单纯采用血清学抗原抗体检测试剂进行血源筛查,不足以有效识别病原体突变株、“窗口期”感染及隐匿性病毒感染,需要更灵敏的核酸检测,以进一步降低输血传播疾病的风险。
核酸检测技术可以直接扩增病原体核酸(DNA或RNA)或其附带信号,通过将极微量的核酸信号转化成光电或可视信号,实现对病原体的检测。核酸检测技术包括转录介导的核酸扩增(Transcription-mediated Amplification,TMA)和实时荧光聚合酶链式反应(Real-time Fluorescence Quantitative PCR,荧光-PCR)。通常核酸检测试剂需与检测仪器专机专用,组成一个配套的检测体系。2011年12月31日,卫生部发布了《血站技术操作规程(2012年版)》 [13],首次将核酸检测列入血源筛查方法,提出对HIV、HBV、HCV的检测可采用2个不同厂家的血清学试剂或者采用1种血清学试剂和1种核酸检测试剂进行,对2种检测技术组合的选用,血站可根据技术和资源条件决定。随着血站核酸检测的全面覆盖,现行《血站技术操作规程(2015年版)》[以下简称“《规程》(2015年版)”](自2016年3月1日起实施)[14]进一步细化了血源检测策略,要求血源检测应用血清学试剂的同时还应进行1遍核酸检测,这标志着我国血源筛查核酸检测规范基本完善。本文对血源筛查用核酸检测(以下简称“核酸血筛”)技术进行概述,梳理核酸检测试剂及仪器的发展及在血源筛查中的应用现状,并对血源筛查核酸检测体系研发、应用和监管提出思考建议。
2 血源筛查用核酸检测技术概况荧光-PCR法模拟DNA复制的过程,在PCR反应体系中加入荧光染料,荧光染料可以特异性掺入到DNA复制成的双链中并发射荧光信号,而没有掺入DNA双链的荧光染料不会发射荧光信号,通过实时检测荧光信号的增加实现对核酸扩增的实时监测。TMA法是将化学发光基团标记到寡核苷酸引物上,通过模拟DNA转录成RNA的过程,将寡核苷酸探针加到扩增后的RNA产物上,并通过化学发光对靶病毒核酸进行检测。与荧光-PCR法不同,TMA法只能在病毒核酸扩增反应完成后进行终点检测。
核酸检测在病毒感染后数天即能检出病原体核酸,可进一步缩短检测“窗口期” [15]。研究表明通过核酸检测试剂,可将乙肝、丙肝和艾滋病病毒检出的平均“窗口期”由原来的56天、70天和22天,分别缩短25天、59天和11天左右[16]。研究还表明,核酸检测与酶联免疫检测联合应用能进一步提高病毒检出率,降低相关传染性病毒感染的漏诊率或误诊率[17-18],而且对于血清学试剂无法检测的病毒突变株和隐匿性病毒感染,核酸检测试剂也可以作为有效补充[19]。
3 核酸检测试剂及仪器发展概况随着科学研究的不断发展,血源筛查技术也取得了长足的进步,尤其是核酸血筛试剂及配套的检测仪器,近年来一直在不断改进和升级换代,现就核酸检测体系的发展现状进行概述。
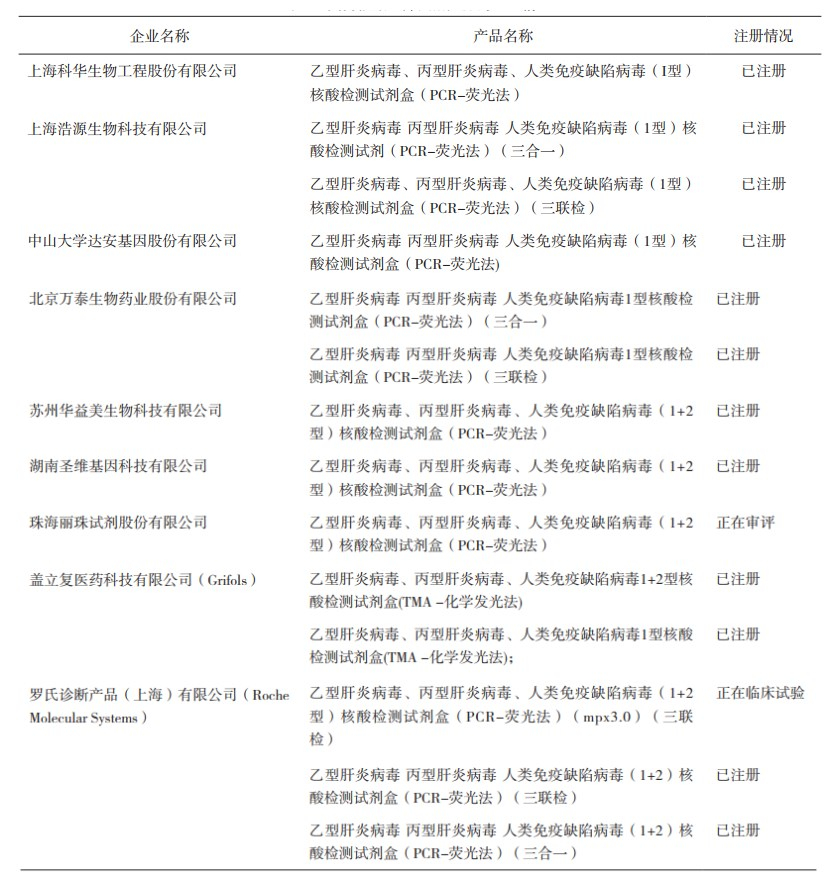
3.1 核酸检测试剂的发展核酸检测试剂的发展主要体现在检测灵敏度和检测效率的提高,可以分为三个阶段[20]。最早的核酸检测试剂基于PCR-ELISA技术,通过酶催化底物显色反应对病原体核酸扩增产物进行终点检测,代表性产品为罗氏诊断研发“Cobas AmpliScreen HBV/HCV/HIV tests”。第二个阶段是以罗氏诊断“CobasTaqScreen MPX Test”为代表的,通过实时荧光定量PCR技术对HBV DNA、HCV RNA和HIV RNA的扩增采用同一种荧光信号进行实时检测的技术,虽然此方法提高了检测灵敏度,但是却不能判别阳性检测结果是源于哪(几)种病原体感染。第三个阶段是通过多色荧光对不同病毒核酸进行标记,并在同一个反应中对HBV DNA、HCV RNA和HIV RNA同时进行实时荧光检测,并判别出阳性病毒感染源,这种方法的病毒检出率和检测效率都有显著提高。我国上海浩源生物技术有限公司研发的五色荧光多重PCR法核酸检测试剂是全球第一个获批的多重PCR法核酸检测试剂。目前,共有6家国产企业的8个核酸检测试剂获得国家药品监督管理局(以下简称“国家药监局”)批准注册,国外企业有2家的4个产品获批注册,另有1个国产和1个进口产品正在申请注册中(具体的试剂注册情况见表 1)。研究表明,国产核酸检测试剂与进口核酸检测试剂在病毒检出率上没有显著统计学差异[21]。
|
|
表 1 国内核酸血筛试剂产品的注册情况 |
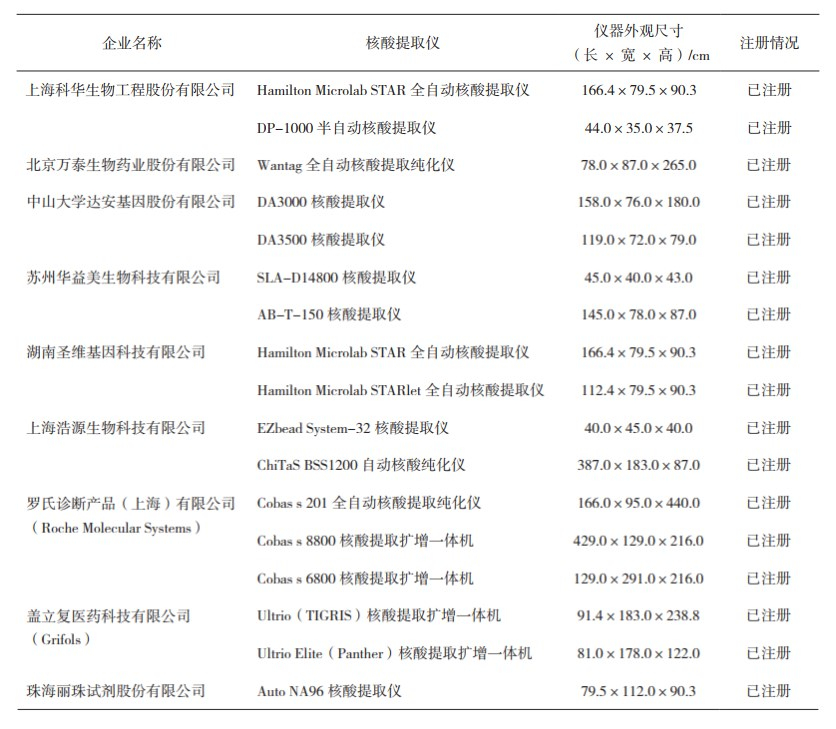
通常核酸检测试剂的使用需配套专用的检测仪器,从样品处理、加样、扩增到数据分析等端口均不能共享。随着检测技术的提升,检测仪器也在不断改进,主要体现在检测模式和自动化程度的更新。为降低检测成本并缩短检测耗时,多数国家血源筛查时使用合并/混样检测。早期的检测模式是采取样本汇集提取核酸后,分3个反应管对HBV DNA、HCV RNA和HIV RNA分别进行核酸扩增检测,再对阳性反应的汇集样品用相应的阳性病原体检测试剂进行拆分检测。新的检测模式可在一个反应管中对汇集的样本核酸进行扩增检测,并且通过全自动体系对汇集的样本用不同的荧光探针进行拆分检测,一次实验即可直接判别出阳性样本及感染病原体类型。在自动化程度方面,无论是荧光-PCR法还是TMA法的配套仪器都已从手动操作向半/全自动化迈进。目前,已有9家企业的核酸检测仪器设备在我国获批注册,包括2家进口企业和7家国产企业(具体情况见表 2)。
|
|
表 2 国内已获批的核酸血筛试剂检测仪器情况 |
对于核酸检测的应用,WHO于2009年发布的《血液筛查建议书》 [5]提到,许多国家已经实行HIV RNA筛查。HIV RNA是HIV感染后最先出现在血循环中的标志物,从检出HIV RNA到检出HIV P24抗原之间的窗口期可能较短,HIV RNA筛查价值与所使用的血清学筛查试验以及献血者HIV感染发生率有关。因此,WHO建议综合评价HIV RNA筛查所能提高的血液安全程度和增加的成本与物流[22]。
早在20世纪九十年代,国外就已开始应用核酸检测技术进行血液及原料血浆的筛查[23-24],其中,日本是世界上最早在全国范围内进行HBV、HCV和HIV筛查的国家(1997年1月起对原料浆,1999年初起对采供血站)。德国和荷兰在1997年开始在全部血站推广实施核酸检测筛查,美国也在1999年开始在全部血站使用核酸检测试剂进行常规血源筛查。另外,将核酸检测试剂用于血源筛查的国家还有韩国、澳大利亚、法国、意大利和新加坡等。目前,美国采供血站血源筛查用的核酸检测试剂主要是罗氏诊断(Roche Molecular Systems)生产的COBAS MPX系列荧光-PCR试剂和盖立复(Grifols Diagnostics)生产的Procleix Ultrio系列TMA试剂,用于原料血浆筛查的是美国遗传学究院(National Genetics Institute)生产的UltraQual Multiplex PCR核酸检测试剂。在检测模式上,多数国家采用合并/混样检测。也有国家,如新加坡,采用的是单人份检测。
4.2 核酸检测在我国血源筛查中的应用情况为推广核酸检测技术的应用,我国卫生部于2000年3月开始在12个省市的15个血液中心进行核酸检测试点工作,并发现应用核酸检测后血液安全性大幅提高[25]。2002年,我国开始了将核酸检测技术用于HBV表面抗原阴性、抗HIV阴性和抗HCV阴性的原料血浆筛查的研究工作[26]。2012年10月,国务院《卫生事业发展“十二五”规划》 [27]要求到2015年底血液筛查核酸检测基本覆盖全国。为贯彻落实国务院要求,2015年2月13日,原国家卫生和计划生育委员会(以下简称“原卫生计生委”)和财政部办公厅联合发出《关于做好血站核酸检测工作的通知(国卫办医发〔2015〕11号)》 [28],要求各地要按照《卫生事业发展“十二五”规划》等有关文件要求,为全面推进血站核酸检测工作,进一步保障血液安全,充分总结前期核酸检测试点工作的经验,根据实际情况,狠抓落实,确保2015年血站核酸检测覆盖全国。4月26日,卫生计生委又在总结前段工作的基础上,发布了《全面推进血站核酸检测工作实施方案(2013—2015年)》 [29],进一步明确了全面推进血站核酸检测工作的实施方案。为进一步提高血液安全,2015年12月17日,原卫生计生委发布《规程(2015版)》规定[14],对HIV、HBV和HCV感染标志物的血液检测,应至少采用核酸和血清学试剂各进行1次,对血清学检测反应阳性的标本可不再进行核酸检测。近十多年来,国内一些血液制品生产企业及多数采供血机构都开展了病原体核酸检测[30],包括北京、深圳、上海等地的血液中心或中心血站,使用的试剂盒既有国产的也有进口的。
5 对血源筛查核酸检测体系研发、应用和监管的思考及建议 5.1 血源筛查核酸检测体系研发尽管我国核酸检测技术起步较晚,但是发展迅猛,近年来,检测试剂灵敏度及仪器自动化程度都有显著提升。同时还要看到我国核酸检测体系还存在很多不足,检测试剂和仪器都还有进步空间。
5.1.1 核酸检测试剂的研发对病原体高突变率导致的隐匿性病毒感染及对“窗口期”病毒感染的检测是全世界血源筛查面临的难题。随着我国医疗改革的深入,国民对于临床用血的需求日益增多,对保证临床用血安全的要求也不断提高,因此,对检测试剂的灵敏度也提出了更高的要求。另外,我国地域辽阔,人口众多,存在一些特有的病原体基因型,急需研发针对我国特有病原体基因型的核酸检测试剂。尽管进口试剂在检测灵敏度等方面表现优异,但是进口试剂一方面价格较高,另一方面缺少对于我国特有基因型病原体的检测。因此,国产试剂需进一步提高检测灵敏度、发挥价格优势,并尽快研发出适合我国国情要求的核酸检测试剂。
核酸检测试剂研发除了要关注试剂本身的检测性能外,还应着重提高病毒核酸提取效率,以最大程度地检测样本中的核酸。生产企业还需加大核酸提取方法研发投入,以便建立高效且易于自动化的核酸提取方法。
5.1.2 核酸检测仪器的研发目前,我国已有多家核酸检测仪器获得注册,但是总体看,国产的核酸提取设备多为半自动化,而进口仪器如罗氏的Cobas 6800/8800体系和盖立复的Procleix Ultrio体系已经实现了从混样/加样、核酸提取到PCR扩增/检测的全自动化。因此,国产企业在检验仪器研发上应进一步优化核酸提取和扩增检测流程,以缩短检测时间并提高检测效率。另外,我国部分地区如西藏,地处高原气候,气压和气温低,空气稀薄,对检测仪器稳定性会有一定影响,需建立适合我国特殊气候要求的核酸提取和扩增检测体系。
5.2 血源筛查核酸检测体系的应用核酸检测技术操作步骤复杂,检测结果的准确性不仅受检测试剂的性能影响,还与试剂终末期的稳定性、仪器设备维护的状态、人员操作、结果判定规则等紧密相关,因此,需对检测体系的使用人员和实验室环境等都进行严格管理。各血站及浆站应加强实验室的标准化、规范化和科学化建设,对血液检测全过程(前、中、后)的关键点和支持性过程进行质量监测和有效控制,并加强对检验操作人员的专业知识和技术水平的培训管理,以最终保障采供血液质量[25, 31]。
5.3 血源筛查核酸检测体系的监管我国已注册的核酸检测试剂和仪器性能存在较大差异,而且不同地区间经济发展水平和病原体流行形势也存在差异。监管部门应该统筹规范检测模式、检验标准和检验参考品。
首先,要科学评估检测模式对检验结果准确性的影响。混和样本检测时,受检测的样本混样数越多,受检样本被稀释的倍数就越高。尽管增加混合样本数可降低检测成本,但同时也降低了对单个受检样本的检测灵敏度,因此,需根据我国病原体的流行病学现状和特点制定符合我国实际情况的灵敏度标准。要在保障检测灵敏度和血液供应速度的前提下,综合评估核酸检测费用及工作强度等因素,建立合理的血液标本汇集检测允许限度。
其次,要加快和完善核酸检测体系的标准化建设,制定统一的国家标准,以便统一审批尺度并进一步提高产品的质量。加大对核酸检测试剂检验工作的投入,加强检验人员技术能力和检验水平建设,确保检验工作的科学性和公正性。加大对标准的宣传贯彻,为改进检测试剂质量提供依据。
最后,生产企业在试剂生产过程中会用到企业参考品和国家参考品进行质控和性能验证。检验机构对核酸血筛试剂进行检验时也需要使用国家参考品。目前,企业参考品和国家参考品研制中都存在阳性血浆来源受限的问题,尤其是一些特殊基因型的阳性血浆更不易获得,这对产品质量控制影响很大,已成为制约核酸血筛试剂行业发展的瓶颈之一,应当引起监管部门关注并予以解决。
6 结语随着我国经济和医疗水平的不断发展,临床用血的要求也在不断提升,输血安全还面临很多问题和挑战。尽管目前我国已经拥有了较先进的血液筛查核酸检测技术,但是,国产核酸检测体系质量和性能还有很大进步空间。相关监管部门应尽快改进和完善相关的标准、规范和法规,生产企业应进一步提升产品性能,采供血部门应有效保证实验室的检测质量并提高检测水平,通过共同努力确保人民用血安全。
| [1] |
中国疾病预防控制中心.我国乙肝病毒携带者约9000万[EB/OL].(2018-07-31)[2019-06-20]. http://epaper.bjnews.com.cn/html/2018-07/31/content_727643.htm.
|
| [2] |
曾藓惠, 谢志春. 我国乙肝疫苗接种预防成就及面临的挑战[J]. 应用预防医学, 2018, 24(6): 496-498. DOI:10.3969/j.issn.1673-758X.2018.06.027 |
| [3] |
Caligiuri P, Cerruti R, Icardi G, et al. Overview of Hepatitis B Virus Mutations and Their Implications in the Management of Infection[J]. World J Gastroenterol, 2016, 22(1): 145-54. DOI:10.3748/wjg.v22.i1.145 |
| [4] |
唐琪, 卢洪洲. 艾滋病流行现状及防治策略探讨[J]. 复旦学报(医学版), 2017, 44(6): 744-751. DOI:10.3969/j.issn.1672-8467.2017.06.010 |
| [5] |
Organization W H. Screening Donated Blood for Transfusion-Transmissible Infections: Recommendations[S]. 2009. https://www.ncbi.nlm.nih.gov/pubmed/23741773
|
| [6] |
中华人民共和国主席令第九十三号中华人民共和国献血法[S]. 1997.
|
| [7] |
中华人民共和国卫生部.输血技术操作规程(血站部分)[S]. 1997.
|
| [8] |
张丽, 邓雪莲. 隐匿性乙肝病毒感染与血液安全[J]. 中国输血杂志, 2011, 24(12): 1102-1104. |
| [9] |
Kim H S, Chen X, Xu M, et al. Frequency of Hepatitis B Surface Antigen Variants(HBsAg)in Hepatitis B Virus Genotype B and C infected East-and Southeast Asian Patients:Detection by the Elecsys(R)HBsAg Ⅱ assay[J]. J Clin Virol, 2018, 103: 48-56. DOI:10.1016/j.jcv.2018.04.005 |
| [10] |
Servant Delmas A, Mercier Darty M, Ly T D, et al. Variable Capacity of 13 Hepatitis B Virus Surface Antigen Assays for the Detection of HBsAg Mutants in Blood Samples[J]. J Clin Virol, 2012, 53(4): 338-45. DOI:10.1016/j.jcv.2012.01.003 |
| [11] |
Leary T P, Gutierrez R A, Muerhoff A S, et al. A Chemiluminescent, Magnetic Particle-based Immunoassay for the Detection of Hepatitis C Virus Core Antigen in Human Serum or Plasma[J]. J Med Virol, 2006, 78(11): 1436-40. DOI:10.1002/jmv.20716 |
| [12] |
林树波, 郑泽旋, 张锐. 化学发光免疫分析试验在血液筛查中的应用及评价[J]. 中国实验血液学杂志, 2019, 27(2): 569-572. |
| [13] |
中华人民共和国卫生部.血站技术操作规程(2012年版)[S]. 2011.
|
| [14] |
国家卫生和计划生育委员会.血站技术操作规程(2015年版)[S]. 2015.
|
| [15] |
蔡丽娜, 陈宝安. 核酸扩增技术(NAT)在献血者血液初筛中的应用现状[J]. 中国实验血液学杂志, 2014, 22(4): 1171-1177. |
| [16] |
Roth WK B S, Drosten C, et al. NAT and Viral Safety in Blood Transfusion[J]. Vox Sanguinis, 2000, 78(2): 257-259. |
| [17] |
赵红娜, 王艺芳, 葛文超, 等. 郑州地区无偿献血者中核酸检测的初步应用[J]. 中国输血杂志, 2014, 27(9): 923-926. |
| [18] |
曹华琳, 刘亚军. 核酸检测与酶联免疫检测对输血相关传染性疾病的检测效果对比分析[J]. 心脑血管病防治, 2019, 19(2): 171-173. DOI:10.3969/j.issn.1009-816x.2019.02.021 |
| [19] |
曾劲峰, 许晓绚, 李活, 等. 核酸血筛在献血者常规筛查中的应用研究[J]. 中国输血杂志, 2011, 24(7): 556-559. |
| [20] |
许四宏, 王佑春. HBV/HCV/HIV核酸血筛试剂的研究及应用进展[J]. 临床输血与检验, 2018, 20(6): 581-585. DOI:10.3969/j.issn.1671-2587.2018.06.008 |
| [21] |
梁启忠, 程玉根. 核酸检测技术在献血者血液筛查中的应用[J]. 国际检验医学杂志, 2015, 36(22): 3265-3267+3270. DOI:10.3969/j.issn.1673-4130.2015.22.018 |
| [22] |
郭永建, 池泉, 涂东晋, 等. WHO血液筛查建议书主要内容介绍[J]. 中国输血杂志, 2010, 23(1): 66-72. |
| [23] |
Roth W K. History and Future of Nucleic Acid Amplification Technology Blood Donor Testing[J]. Transfus Med Hemother, 2019, 46(2): 67-75. DOI:10.1159/000496749 |
| [24] |
周海云, 杨庆梅, 张云涛. 核酸扩增检测技术用于血液和原料血浆筛查的进展[J]. 微生物学免疫学进展, 2005(1): 67-71. DOI:10.3969/j.issn.1005-5673.2005.01.017 |
| [25] |
马书章, 田晓娟, 佟利家. 血源筛查核酸检测应用现状及研发中应关注的问题[J]. 首都医药, 2012, 19(24): 6-7. DOI:10.3969/j.issn.1005-8257.2012.24.002 |
| [26] |
白坚石, 王威. 原料血浆病原体核酸检测技术应用的现状与思考[J]. 中国药事, 2006(10): 624-627. DOI:10.3969/j.issn.1002-7777.2006.10.021 |
| [27] |
国务院.国发[2012] 57号国务院关于印发卫生事业发展"十二五"规划的通知[S]. 2012.
|
| [28] |
国家卫生和计划生育委员会和财政部办公厅.国卫办医发[2015] 11号关于做好血站核酸检测工作的通知[S]. 2015.
|
| [29] |
国家卫生和计划生育委员会.全面推进血站核酸检测工作实施方案(2013-2015年)[S]. 2015.
|
| [30] |
Li L, Li K Y, Yan K, et al. The History and Challenges of Blood Donor Screening in China[J]. Transfus Med Rev, 2017, 31(2): 89-93. DOI:10.1016/j.tmrv.2016.11.001 |
| [31] |
王露楠. 血站实验室能力建设[J]. 中国输血杂志, 2018, 31(2): 99-100. |
 2019, Vol. 33
2019, Vol. 33