2. 沈阳药科大学亦弘商学院, 北京 100010
2. School of Yeehong Business, Shenyang Pharmaceutical University, Beijing 100010, China
生物提取分离类和菌体制剂类产品都属于早期的治疗用生物制品。前者实际上是最早的生物药物,在基因工程还没有出现的时期,从生物样本中提取有效的成分进行治疗是最直接有效的手段,尤其是血液制品[1],如人血白蛋白、各种免疫球蛋白等等,至今为止仍然不可替代,这一点无论是国产、进口还是美国市场的境况都是一致的。从批准的时间来看,绝大部分生物提取分离类产品都是在二三十年前,甚至更早时期批准上市的。生物提取分离类产品又可以分成两大类,一类是从人或动物血液提取的单纯血液制品,另一类是生物体组织或器官提取的多组分生化药物。菌体制剂又称为微生态制剂[2],是含活菌和(或)死菌、包括其组分和代谢产物的生物制品,经口或经由其它粘膜途径给药,旨在改善粘膜表面微生物或酶的平衡,或者刺激特异性或非特异性免疫机制,从而达到治疗效果的一类生物制品[3]。国产的菌体制剂除了传统的口服或粘膜给药微生态制剂,还有一些注射给药的品种。本文就提取分离和菌体制剂两大类已上市的治疗用生物药物进行分析。
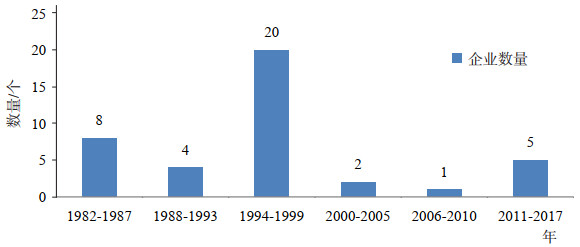
1 已上市提取分离类产品分析 1.1 血液制品类 1.1.1 我国已上市血液制品类产品分析国产治疗用生物制品中的血液制品是占据文号数量最多的一大类品种,一共有522个批准文号,几乎占整个国产治疗用生物制品所有批件数量的一半,而总的品种数量只有34个[4],文号的数量远远大于品种数量,意味着这一领域有大量的同品种重复申报。从时间轴来看,在2003年之前,重复申报主要贡献是不同企业的重复申报,由于这类产品技术门槛相对较低,利润相对较高,导致在1994年到1999年之间企业扎堆进入该领域,目前拥有血液制品批件的国内企业一共有40家,而在这期间新进入血液制品领域并获得批件的企业就有20家,一半的血液制品企业是在这5年间发展起来的,如图 1所示。这5年间一共颁发了183个生产批件,相应的品种数量却只有8个,由图 2可见,绝大多数的批准文号都是企业重复申报所形成的。而在2000年-2010年,受政策影响,虽然颁发的批件数量仍达到了259个之多[5],但只有3家新的生产企业进入血液制品领域获得批件,在2003年到2010年之间,甚至只有1家新的生产企业进入该领域获得生产批件,可见在2010年前,血液制品领域的生产企业重复申报问题非常严重。2010年之后,申报情况趋于正常,平均每年的批件数量仅有6个,主要是不同规格产品。这类产品的另一个特点就是相对分散,40个企业中拥有10个以上批件的企业就有25家,并没有垄断型企业。
|
图 1 不同年代获取血液制品批件的新企业 |
|
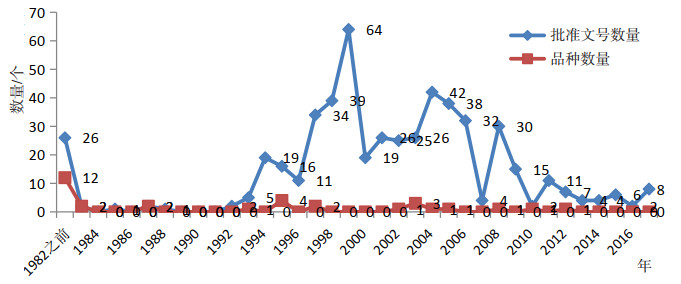
图 2 国产历年批准上市的血液制品批准文号和品种数量 |
从国产上市品种来看,血液制品中几乎没有创新产品。除了一个品种是2012年批准上市外,其它所有品种都是在2010年之前批准的,2012年之后没有新品种批准上市,如图 2。
进口企业在这一领域的竞争优势并不明显,虽然上世纪四十年代美国就有人血白蛋白等血液制品上市使用[6],一直到1999年才有第一个血液制品获批进入中国市场,并且在2013年以后就没有新的进口企业获得过批准文号。总的进口批件数量只有32个,对应品种也只有3个,分别是人血白蛋白、兔抗人胸腺细胞免疫球蛋白和抗人T细胞兔免疫球蛋白,虽然品种数量和批准文号数量很少,然而拥有批准文号的生产企业却达14家。其中人血白蛋白是最主要的进口血液制品,14家企业中的13家有该产品,批件数量有25个。国内拥有人血白蛋白的生产企业也多达28家,表明这一产品至今仍是血液制品里最为重要的产品[5],同时也是国产和进口生物制品中重复度最高的产品。
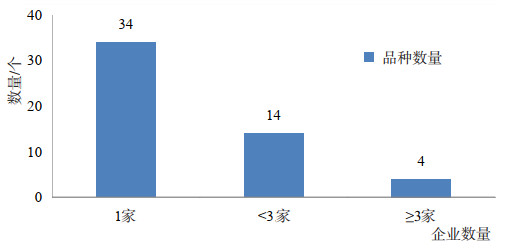
1.1.2 FDA批准血液制品类产品分析尽管进入中国市场的血液制品品种数量非常少,但FDA[7]批准的血液制品品种数量却并不少,有52个之多。其中34个品种只有1家生产企业生产,14个品种不超过3家生产企业,仅有4个品种有3家以上的生产企业,如图 3,生产企业最多的品种是人血白蛋白,也只有9家企业,这与国内企业形成鲜明对比,国内企业有超过一半的品种有3家以上生产企业。
|
图 3 FDA批准上市的血液制品生产企业数量 |
绝大部分已上市的多组分生化药物都是早期开发的生物药物,技术含量相对较低,当年在我国有不少是按化学药品注册管理的,按照生物制品管理的品种数量并不多,至今为止国产一共只有9个品种20个生产批准文号,涉及的相关企业却有16家之多,所有文号均是在2010年6月之前批准的,在这之后未再有新的批准文号,表明这类产品基本处于静止期了。批准文号和企业最多的是人胎盘组织液,有6家企业8个批准文号;其次是鼠神经生长因子,有4家企业对应4个生产批准文号。前者是老品种,大多数是在上世纪80年代批准上市的,后者到目前仍是一个市场很大的品种,4家企业2016年的市场销售额超过30亿元人民币,并且还在不断开发新适应证[5]。
进口产品在这一类中有限,仅有3家企业的3个品种上市,分别是螨变应原注射液、屋尘螨变应原制剂和牛痘疫苗接种家兔炎症皮肤提取物片,相应的上市批件也只有7个,均是在2005年10月之前批准的[5],在这之后就没有此类进口品种上市了。
1.2.2 FDA批准多组分生化药产品分析FDA上市的多组分生化药品种数量也不多,主要是蜂毒蛋白、花粉过敏原提取物、生化酶类提取物等产品,有一部分早期产品也是按照化药批准的,FDA批准的这类产品没有在国内批准上市的,国内批准的进口品种均是欧洲或日本等法规市场的上市产品。
总的来看国产提取类多组分生化药品比较混杂,产品不多却从抗炎、抗过敏、抗病毒到抗肿瘤辅助治疗等领域都有涉及,一方面也说明这类产品的作用机制并不明确,近十年来都没有新产品上市了,表明临床价值有限。进口和国外产品也同样长期没有新的上市产品,正在逐渐退出市场。加上组分复杂,潜在的不良反应发生率高,是需要慎重考虑的一类产品。
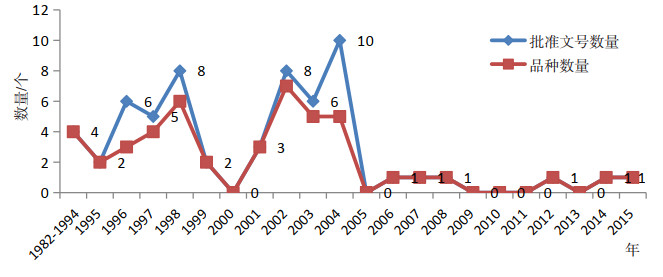
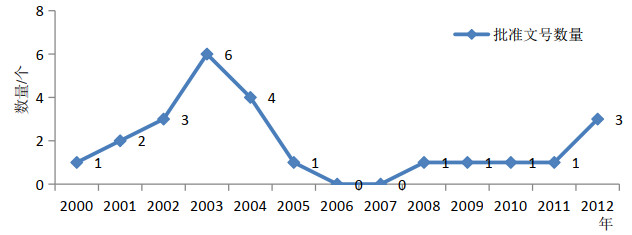
2 已上市菌体制剂类产品分析 2.1 已上市国产菌体制剂类产品菌体制剂包括活菌、灭活菌以及菌体提取物等一大类产品。国产菌体制剂一共有60个批准文号,包括39个品种,涉及34家生产企业,绝大多数产品是在2005年之前批准上市的,其中24个批准文号是在2002-2004三年内颁发的,而2005年之后只颁发了6个批准文号[5],如图 4。
|
图 4 国产历年批准上市的菌体制剂批准文号和品种数量 |
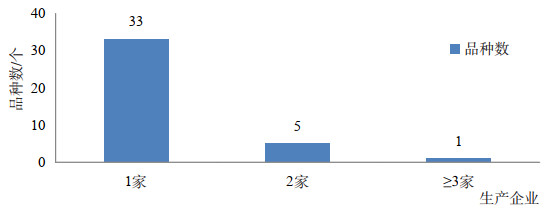
这类产品是文号数、品种数之比相对较小的一类品种,只有1.5,表明这类产品的重复申报情况较少。这类国产产品中,绝大部分品种都不超过3家生产企业,33个品种为1家生产企业独家生产,5个品种有2家生产企业生产,只有1个品种(卡介菌多糖核酸注射液)生产企业超过3家,如图 5。
|
图 5 国内批准上市的菌体制剂生产企业数量 |
进口菌体制剂产品数量不多,2000年才有第一个进口产品在国内获批上市,所有产品都是在2000到2012年之间批准的,一共有24个批准文号,包括12个品种的9家相关生产企业。和国产品种类似,有超过一半的批件(13个)是在2002-2004年批准的(如图 6),其生产企业也比较集中[5],所有品种均分别只有1家生产企业生产,这也是这类制剂比较特殊的地方,几乎没有竞争企业。生产企业主要以日韩企业为主。FDA批准上市的菌体制剂相关产品也非常之少,至今为止只有6家企业的6个品种批准上市,没有可替代企业产品。
|
图 6 国内进口批准上市的菌体制剂批准文号数量 |
进口菌体制剂的临床适用范围主要是改善肠道菌群和胃肠道紊乱,个别产品用于呼吸道感染(细菌溶解物)或神经性疾病(注射用A型肉毒毒素)。国产菌体制剂大部分品种也是用于胃肠道紊乱的治疗,但还有很多品种用于各种适应证,如抗结核、抗肿瘤、抗感染、抗肿瘤辅助治疗和抗支气管炎症等。
3 小结根据不同的技术特点对已上市治疗用生物制品的分析,可以发现不同技术含量的产品在批准的时间阶段方面不太相同。技术水平偏低的生物提取类产品,包括血液制品和多组分生化药物几乎都是在2010年之前首次批准的;菌体制剂类产品多数是在2005年前批准的。这两类产品都是早期的治疗用生物制品,血液制品仍发挥着重要的临床价值,但重复申报情况却最为严重。提取类多组分生化药品作用机制并不明确,近十年来没有新的产品上市,是需要慎重考虑的一类产品。
多组分生化药物和菌体制剂虽然重复申报情况很少,很多品种却在临床上应用很少。这两大类产品近年来几乎没有新的批件,更不用说创新产品,说明技术上已不是主流产品,从FDA的批准数量看就可见一斑。
致谢
本文来自亦弘商学院组织开展的“我国生物制品产品目录分析及建立我国‘紫皮书’的必要性和可行性研究课题”,该课题由国家药品监督管理局药品注册管理司委托。感谢研究期间课题委托单位及业界专家同仁给予的大力支持!
| [1] |
王燕波, 孙钟毓, 李杰, 等. 我国血液制品生产监管法律法规历史沿革及发展建议[J]. 食品与药品, 2017, 19(6): 459-465. |
| [2] |
刘华. 微生物制药研究进展与发展趋势[J]. 黑龙江科学, 2017, 8(2): 74-75. DOI:10.3969/j.issn.1674-8646.2017.02.030 |
| [3] |
任凤兰, 崔凤珍. 微生物制剂的开发及应用[J]. 河南科技, 1999(7): 23. |
| [4] |
刘志磊, 张彦彦, 李小芳. 我国生物制品的注册历程分析[J]. 中国新药杂志, 2018, 27(21): 2584-2587. |
| [5] |
刘志磊, 张彦彦, 李洁, 等. 已上市生物制品的批准情况及创新性浅析[J]. 中国生物制品学杂志, 2018, 31(10): 1160-1162. |
| [6] |
郝铄. 美国:引领全球血液制品行业发展[J]. 科学新闻, 2016(4): 59-60. |
| [7] |
FDA. Purple Book[EB/OL].(2018-12)[2019-04-24]. https://www.fda.gov/drugs/therapeutic-biologicsapplications-bla/purple-book-lists-licensed-biologicalproducts-reference-product-exclusivity-andbiosimilarity-or.
|
 2019, Vol. 33
2019, Vol. 33 
