2. 沈阳药科大学亦弘商学院, 北京 100010
2. School of Yeehong Business, Shenyang Pharmaceutical University, Beijing 100010, China
单克隆抗体药物[1-3]在生物技术制药中占有重要地位,并逐渐成为生物医药领域发展的主要方向。从全球市场来看,抗体药物成了国际制药业争夺的焦点,并成为国际制药业巨头快速切入抗体产业的捷径。目前单抗药物在全球生物制药中所占市场份额从2000年的10%增长至当前的约50%,是现代生物制药行业中占比最大、增长最快的细分领域。截至2017年底,FDA合计批准上市销售的单抗药物达78个,2018年销售额已接近1200亿美元,占整个生物药的市场份额已超过50%[4]。可以说,抓住了单抗类药物,就基本抓住了当前生物药物的发展关键,占据创新药物研发的制高点。本文就我国已批准上市的单抗类药物进行分析总结。
1 已上市单抗类产品整体情况分析 1.1 我国已上市单抗类产品整体情况分析从1986年全球第一个鼠源性单抗[5]批准以来,单抗已经成为重磅炸弹的主要来源。国产单抗的起步并不算太晚,我国在1999年批准了国内第一个治疗用单抗产品——注射用抗人T细胞CD3鼠单抗上市,比进口单抗产品在国内上市时间还要早一年,但国内企业并没有抓住单抗发展的最佳时机,到2017年底只有10个批准文号对应的6个品种上市。相对于国产单抗上市步伐的迟滞,全球单抗在近10年来迎来了飞速发展。从2009年起,FDA每年批准的单抗产品都超过3个,2012年以后更是逐年递增,到2017年批准的单抗产品达18个,创历史新高,单抗产品已经占据了生物药物的半边天[6]。
进口单抗产品对于国产单抗的上市不足是个很好的补充,虽然批准数量不多,一共是14个品种,32个批准文号,仅在2010年和2017年相对较多,其它年份均比较平均,每年不超过2个(如图 1)。虽然上市品种数量有限,但2017年全球销售排名前10位的单抗产品已有6个在国内上市,这对于国内一些临床未满足的重大疾病尤其是癌症的治疗起到了有力的推动作用。
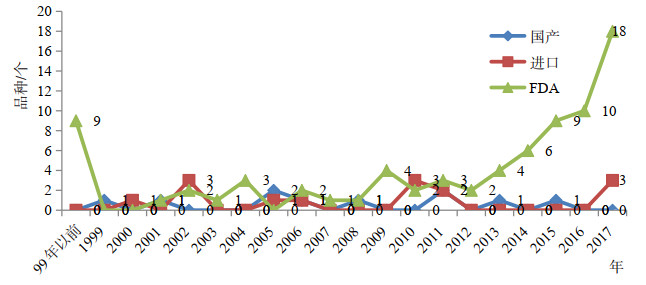
|
图 1 国产、进口和FDA历年批准上市的单抗类产品品种数量 |
全球范围内,单抗类产品依旧是药物研发的重点[7]。FDA近年来批准的单抗产品逐年递增,从2012年开始,每年批准的数量几乎均以50%的速度递增,2017年创下历史新高,批准的单抗类产品达18个(含单抗生物类似药),几乎占据2017年FDA全年批准新药的半壁江山[8]。截至2017年12月,FDA批准的78个治疗用抗体药物中,包括27个全人源单抗、28个人源化单抗、8个嵌合单抗、3个鼠源单抗、4个抗体偶联、1个双特异性抗体和7个抗体类似物。可以看出FDA批准的单抗中,主要集中在人源化和全人源化技术的单抗产品,创新技术很快就应用到产品开发中并获得批准。而国产单抗自2009年到2017年间只有4个品种获批上市,可见我们和国际先进水平的差距非常明显。
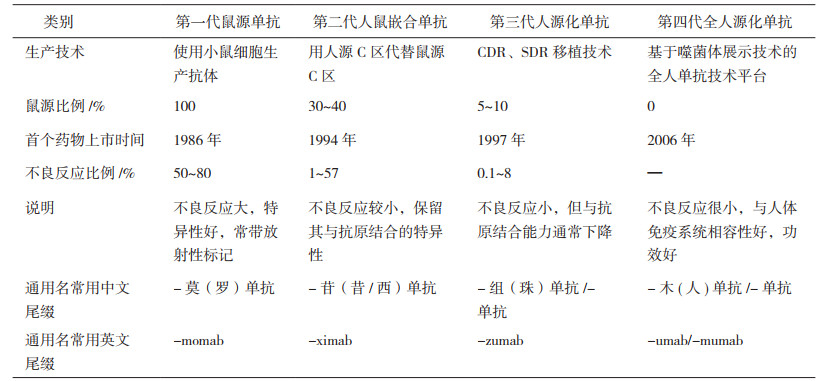
2 已上市单抗类产品代次分析 2.1 已上市单抗类产品的发展历程单抗类药物[9]从全球第一个鼠源性单抗1986年上市以来,已经发展到了第四代全人源化产品。按照其技术特点及人源化程度可以分为四代[10]:第一代鼠源抗体、第二代人鼠嵌合抗体、第三代人源化抗体和第四代全人源化抗体,每更新一代,技术水平就提高一个层次,相应的疗效有明显提升,而不良反应有明显下降。每一代单抗产品的技术特点见表 1。从第一代产品上市到第四代产品上市,仅用了20年时间,几乎每5~10年就有新一代技术产品出现,是目前制药技术发展最为迅猛的一个技术领域。
|
|
表 1 不同代次单抗产品的技术特点 |
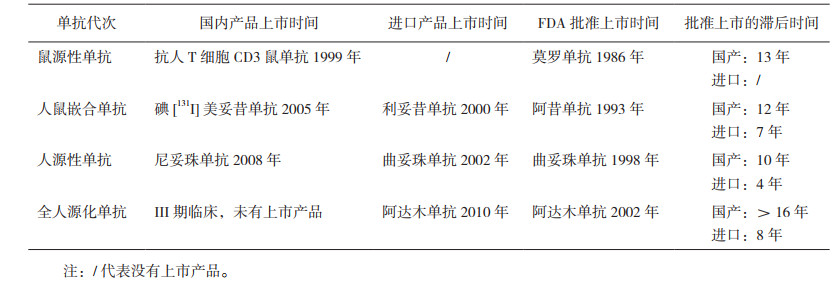
对比国产单抗、进口单抗和FDA批准的单抗在每一代首个上市产品的批准时间,国产产品较FDA批准的单抗产品不仅在数量上远远滞后,所有代次产品批准时间上的滞后也达10年以上。尤其是全人源化单抗,甚至还没有国产产品上市,其滞后时间超过16年。进口产品对于国产单抗研发上市的不足起到了较好的补充,但其平均上市滞后时间也超过5年[6]。不同代次首个代表性产品上市时间数据见表 2。
|
|
表 2 不同技术更新代次首个单抗代表性产品上市时间 |
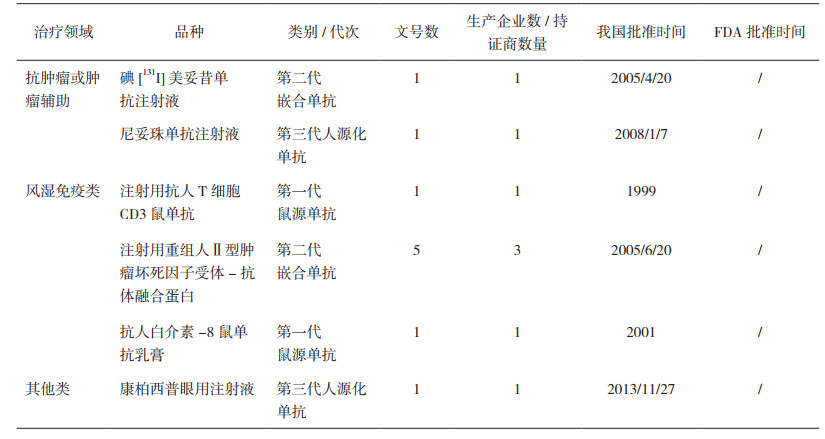
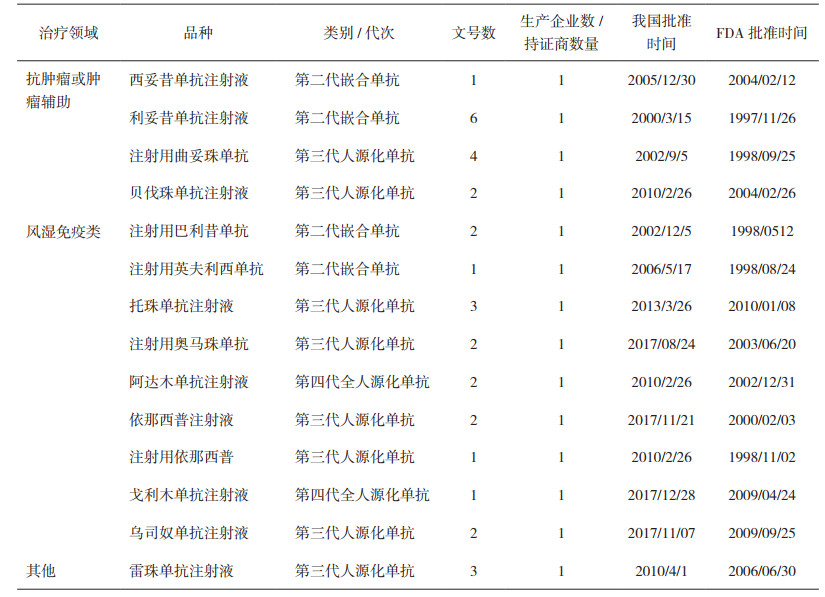
从整个国内上市的单抗品种来看,1999年国产第一代单抗产品上市,至今为止上市的6个单抗品种中,有2个第一代单抗、2个第二代和2个第三代品种,还没有第四代国产化单抗产品上市。批准进口的14个单抗品种中,第二代有4个,第三代8个,第四代2个。在治疗领域上,不论是国产还是进口产品,除了有一个产品是眼科产品,其它产品的治疗领域均是抗肿瘤和风湿免疫类产品,如表 3及表 4所示。已上市品种,除了国产的注射用人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白这个品种有3家生产厂家,其它所有品种均只有1个生产厂家,表明从已上市的情况来看,抗体类药物还没有明显的重复申报情况。不过,近年来由于“抗体热”,从事抗体药物研发的企业数量超过100家,可以预见在今后的一段时间内,将出现国产抗体产品的扎堆申报。
|
|
表 3 我国已批准的国产单抗产品 |
|
|
表 4 我国已批准的进口单抗产品 |
从已批准的治疗用抗体上市产品来看,国产抗体类药物不管是批准数量还是技术先进程度,都与进口品种差距较大,虽然进口产品为丰富国内的临床用药发挥了一定的补充作用,但进口品种在国内的上市时间比FDA批准的上市时间平均滞后达6年,先进的单抗治疗药物并不能及时引入到国内解决临床需求。此外,和国际先进技术相比,无论是国产还是进口单抗品种,与同期FDA批准的抗体类产品比较,在数量和技术水平上均差距较大。
值得欣慰的是国内企业早就意识到单抗的巨大市场价值和潜力,纷纷布局抗体药物的研发领域,近年来有大量海外科学家回国创业,很多都聚焦在开发新一代的抗体类药物,新成立的抗体药物研发企业数量和新申报的抗体药物都在爆炸式增长,并且开始渐见成效。2018年底君实生物和信达生物的两款PD-1单抗产品批准上市,加上今年复宏汉霖的第一个生物类似物利妥昔单抗以及恒瑞的又一款PD-1单抗获批上市,这是继2013年康柏西普批准之后,在长达5年的真空期后又有国产单抗产品的陆续上市,开启了国产单抗产品的新时代。目前市场上75%的抗体药物都于2015年前后专利到期,国家在审评审批方面给予很多政策扶持,这些给我国生物制药公司提供了抗体药物研发的最佳时机。但从目前批准的结果来看,对国内抗体类药物的用药市场产生变革性影响还需要积累,药物研发是个长期而艰巨的系统工程,短期内要想实现所谓的弯道超车并不容易,期待国内产业界能够抓住机遇,早日实现突破。
致谢
本文来自亦弘商学院组织开展的“我国生物制品产品目录分析及建立我国‘紫皮书’的必要性和可行性研究课题”,该课题由国家药品监督管理局药品注册管理司委托。感谢研究期间课题委托单位及业界专家同仁给予的大力支持!
 2019, Vol. 33
2019, Vol. 33