2. 复星医药万新医药科技(苏州)有限公司, 苏州 215123;
3. 沈阳药科大学亦弘商学院, 北京 100010
2. Vonsun Pharmatech Co Ltd, Suzhou 215123, China;
3. School of Yeehong Business, Shenyang Pharmaceutical University, Beijing 100010, China
生物医药技术及产品[1]在全球医药领域中已成为重要的支撑元素,也逐步成为行业及国家竞争力的核心要素之一。2018年全球生物药物市场规模超过2600亿美元,其中治疗用生物药物[2-4]在近十年来逐渐成为全球医药产业的发展重心,全球年销售排名前10位的重磅产品中有8个是治疗用生物药物[5]。与发达国家相比,我国治疗用生物药物的研发和产业化相对较晚,市场规模较为有限,但增速显著高于全球水平。一方面,我国慢性疾病患病率[6-8]上升,居民支付能力及保健意识增强,对高品质生物药物的需求与日俱增;另一方面,医药政策鼓励生物药物研发,制药企业也不断加大对生物药物的研发投入,助推我国生物药物市场驶入快车道。
本研究整合了目前分布在原国家食品药品监督管理总局信息中心、原国家食品药品监督管理总局专网、原国家食品药品监督管理总局外网的已批准治疗用生物制品信息,以品种为主线,进行了不同维度的全方位深入分析,包括已批准上市产品的发展历程、创新程度和技术类别等方面,旨在摸清我国已上市治疗用生物制品的整体情况,提炼出存在的问题,为行业提供参考信息,同时为完善我国治疗用生物制品注册管理制度体系提供数据支持。
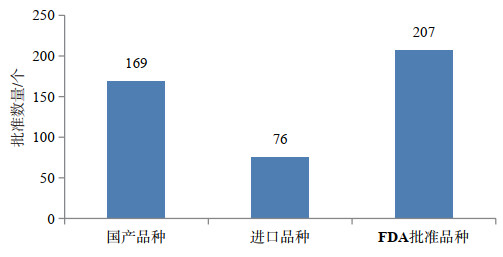
1 我国已上市的治疗用生物制品的品种数量总体分析从我国实行批准文号管理以来,截至2017年12月31日,共计批准了1401个治疗用生物制品文号,其中国产治疗用生物制品1084个,进口317个。从批准的品种(按活性成分与剂型计)来看,国产治疗用生物制品有169个品种,进口76个。获得治疗用生物制品批件的国内生产企业有156家,进口产品的持证商有42家。单个企业批件的数量上国产企业平均为6.9个,略低于进口企业的7.5个,但单个企业上市品种的数量上,国产企业平均不到1.1个,进口企业则达到1.8个[9]。上市产品的品种数量是反映产品创新的一个方面,从这点而言,国内企业在品种创新能力上要明显弱于进口企业。
作为对比,截至2017年底,美国FDA的药品评价和审评中心(CDER)及生物制品评价和审评中心(CBER)共计批准品种207个。CDER批准治疗用生物制品总计137个品种,其中含9个按照生物类似物批准的生物制品;CBER批准了70个治疗用及预防用生物制品[10]。我国批准的品种数量和FDA批准的品种数量对比如图 1所示,单从品种数量上看,我国批准的品种数量与FDA批准数量的差距并不大。
|
图 1 我国批准上市和FDA批准上市的治疗用生物制品品种数量对比 |
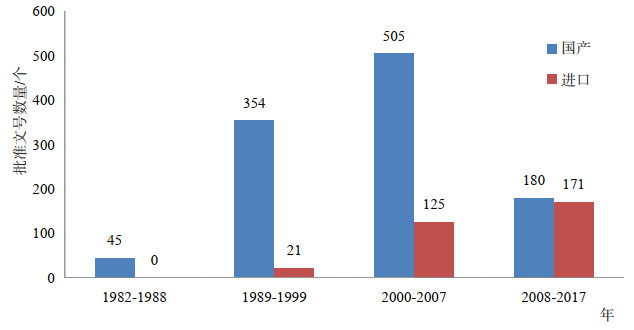
相比于化学药品,我国治疗用生物制品的研发起步较晚,根据数据库显示的批准文号信息,我国生物制品最早的批准时间为1982年(1982年之前批准的品种,批准文号也显示为1982年)。在此之后的35年时间里,治疗用生物制品的发展经历过快速增长期,也经历过阵痛低迷期。按照这类药物时代发展的特点,可以从四个阶段进行分析,1982- 1988年、1989-1999年,2000-2007年以及2008- 2017年。四个阶段各有特点,批准上市的产品数量也有很大差别,如图 2所示。从1989年以后,治疗用生物制品开始快速发展,尤其在2000-2007年的8年中,一共颁发了505个国产治疗用生物制品生产批准文号,几乎占所有上市批准文号的40%[11]。然而,在2007年以后,国产产品的批准数量急剧下降,10年期间批准的文号数量只有前8年的三分之一多一点。但此消彼长,进口治疗用生物制品的批准文号数量在这一阶段反而比前8年增长了近40%,这一格局基本奠定了在今后很长一段时间内是国产的治疗用生物制品还是进口制品占主导地位,国产治疗用生物制品要想占领市场主导地位,还有很长的路要走。下面就四个不同的历史阶段进行分析总结。
|
图 2 不同历史阶段国产和进口治疗用生物制品的批准文号数量 |
1982-1988年是国产治疗用生物制品起步的时期。FDA在二十世纪40年代已开始了治疗用生物制品的使用,1942年美国就批准了人血清白蛋白上市,1982年我国第一个国药准字号治疗用生物制品—抗狂犬病血清的上市,开启了我国治疗用生物制品的时代。1989年之前,一直没有进口治疗用生物制品获批进入中国市场,因此,这段时期是我国治疗用生物制品单纯的自我发展时期。7年间一共批准了45个治疗用生物制品上市文号,涉及20个品种,主要集中在血液制品,如人血白蛋白、免疫球蛋白、各种血液提取的抗血清或抗毒素等,这些血液制品有17个品种,共33个批准文号,由6家生产企业生产,表明这一阶段治疗用血液制品生产企业相对集中;其余3个品种分别是短棒杆菌制剂、布氏菌制剂和人胎盘组织液,前两者属于菌体制剂、后者属于多组分生化药品,分别由8家生产企业拥有批准文号[11]。具体情况如图 3所示。

|
图 3 1982-1988年期间上市品种、生产批准文号及生产企业分布情况 |
在此阶段还没有进口产品,治疗用生物制品在国内还是起步阶段,因此产品是以技术含量不高的提取类生物制品为主导,尚没有创新产品,但这些产品为我国治疗用生物制品的发展奠定了一定基础,并解决了很大的临床需求,尤其是白蛋白、免疫球蛋白以及各种毒蛇的抗血清等产品,使得很多以前无药可治或临床需求未得到满足的病症得以治疗,具有重要的意义。此外,这些产品的生产企业很集中,大部分生产企业,包括兰州生物制品研究所、长春生物制品研究所、武汉生物制品研究所、成都生物制品研究所等,后来都成为了我国生物制品的重点生产企业,在很长一段时间内承担了我国大部分生物制品的研发和上市产品的生产重任。
在此期间,原卫生部于1985年颁布了《新生物制品审批办法》 [12]。此法规颁布后,治疗用生物制品的临床申请和上市申请,均需向国家一级的审批机构申请并报送有关资料。1982年前后,原卫生部开始逐步对各省批准的治疗用生物制品通过换发文号方式,逐步统一替换成国药准字的批准文号。直至2002年,才基本完成各地方药品监督管理部门批准的治疗用生物制品转换成国家统一批准文号的工作。1982-2002年,一共有556个地方文号通过文号换发升级成为国药准字[11]。
这一阶段国外的新一代治疗用生物制品,即基因工程重组技术产品,已经开始进入历史舞台了。1982年第一个利用该技术生产的治疗用生物制品—重组人胰岛素由美国礼来公司申报获得了FDA批准上市,然而一直到1996年该产品才在我国获得批准上市,滞后了近15年时间。
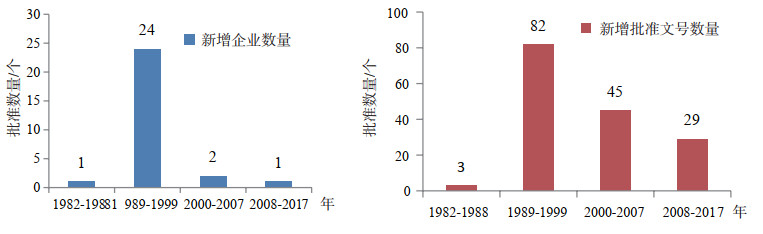
2.2 我国治疗用生物制品的快速发展时期1989-1999年的10年间,是我国治疗用生物制品快速发展时期。这期间77家国内企业获得了354个国产治疗用生物制品批准文号,共54个品种。最初的几年集中在以血液制品为主的治疗用生物制品,尤其是人血白蛋白在这一阶段大量集中申报。人血白蛋白是我国现有上市的治疗用生物制品中批准文号最多的品种,到目前为止,共有28家企业159个批准文号,而在这一时期的集中申报尤为突出,有24家企业获得了82个生产批准文号,近90%的人血白蛋白生产企业的批准文号是在这一时期首次获得批准的,批准文号数量也超过现有人血白蛋白产品的50%。而在1999年以后,仅有3家新的人血白蛋白生产企业产品上市,其余均为已批准上市产品的增加规格[11]。可以说,这一时期的人血白蛋白基本上形成了之后近30年国内生产企业的格局。具体情况如图 4所示。
|
图 4 人血白蛋白不同时期生产企业和批准文号数量分布情况 |
1989年,默沙东公司的重组人干扰素α-2b注射液成为第一个批准上市的进口治疗用生物制品,开启了进口生物制品进入中国市场的篇章。此后的10年中,有8家国外制药公司共计获得了21个进口生物制品批准文号,包括9个品种[11]。这个期间外企的治疗用生物制品还没有在国内市场上占据主导,9个品种中,一个提取类生物制品(螨变应原注射液),一个血液制品(人血白蛋白),剩余7个均为基因工程重组技术生产的蛋白类生物制品,分别是重组人干扰素α-2b、重组人干扰素α-2a、重组人胰岛素及其相关制剂、重组人促红细胞生成素和重组人粒细胞集落刺激因子等。
基因工程重组技术是生物制品生产和制造的一个里程牌,这一技术也将生物制品的安全性和有效性提升到了一个新的里程碑。国产首个重组人干扰素α-1b、α-2a和α-2b的相关产品均在1990年获得批准,这是国内企业获批的第一批重组生物技术产品,在这之后,国内的重组技术产品开始了飞速发展,在1996-1999年的3年内,先后又有重组人白介素-2、重组人集落细胞刺激因子、重组链激酶、重组人促红素、重组人粒细胞巨噬细胞刺激因子、重组人干扰素γ、重组人粒细胞刺激因子、重组人胰岛素和重组人生长激素共9个重组生物制品批准上市。1999年,国内还批准了首个第一代单抗产品——注射用抗人T细胞CD3鼠单抗,标志着国产生物制品在技术上的一个重大突破[11]。
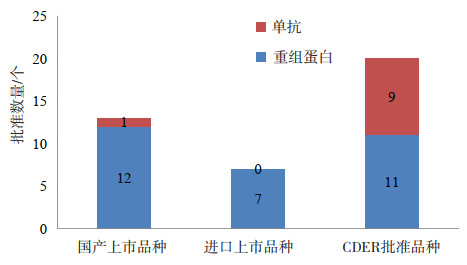
这一阶段,尤其是二十世纪的最后几年,国内的治疗用重组生物制品蓬勃发展,上市品种完全能涵盖进口品种,这一阶段国产的治疗用重组生物制品发展并不逊于进口产品,但和整个国际水平还有一定差距。这一期间,FDA的CDER一共批准了20个重组生物制品的上市,其中值得注意的是单抗产品开始崭露头角,从1986年第一个单抗产品获批开始,全球一共有9个单抗产品在这一时期获批上市。此阶段国产品种和国际水平的差距,主要还是体现在单抗产品上,在FDA已经有第三代人源化单抗产品获批上市,而国产只有1个第一代鼠源性单抗产品上市,进口产品中尚无单抗产品获批上市,单抗方面国际先进水平几乎领先我国一个时代。具体情况如图 5所示。
|
图 5 1989-1999年国产、进口和CDER批准的治疗用重组生物制品上市品种类别数量比较 |
2000-2007年的8年中,是国内生物制品研发跳跃式发展的一段时期,批准治疗用生物制品99个品种、505个注册批准文号,获得批准文号的企业数量共有106家,较前一阶段的77家有明显增长。进口产品在这一时期的申报批准也进入了快速发展时期,共有43个品种125个注册文号获得上市批准[11]。从国内企业获批文号的数量来看,这段时期是国内新药研发的一个黄金时期,从获批的99个国内品种分析上看,有超过一半是已有上市产品的新生产企业,或是增加剂型或规格;有43个品种是国内首次批准的新品种,约占总批准品种数量的43%,尽管是国内首次批准,但真正属于创新产品的并不多,其中有3个单抗产品,抗人白介素-8鼠单抗乳膏、注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白和碘[131I]美妥昔单抗注射液,技术上分别是第一代的鼠源性单抗和第二代的人鼠嵌合单抗。进口产品的43个品种中,有26个品种是原研产品首次进入中国获批,约占总批准数量的60%,见图 6。
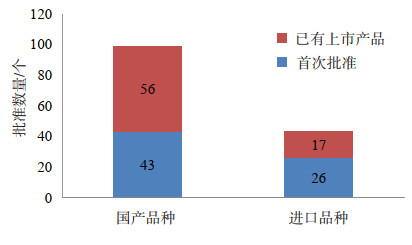
|
图 6 2000-2007年间批准上市的品种创新情况 |
FDA在这一期间批准数量并不算多,共有46个品种获批,其中除了16个血液制品相关产品外,其余30个均为首次上市的创新产品,除了17个重组蛋白外,单抗继续保持着稳定的发展,共有11个单抗产品获批上市,包括全球第一个全人源化单抗—阿达木单抗于2002年获FDA批准上市[10]。值得一提的是,尽管国产单抗产品的上市时间和技术水平均远远落后于国际先进水平,但进口单抗为我国的临床用药起到了很好的补充。第一个进口单抗利妥昔单抗,在FDA批准3年后(2000年)就在国内获批上市,此后在这一期间又陆续批准了5个进口单抗产品,包括人源化技术的曲妥珠和达利珠单抗。
2007年,原国家食品药品监督管理局颁布了《药品注册管理办法》 [13],将生物制品按照15类进行划分,这一版药品注册管理办法对随后10年来的药品注册有着深刻的影响。我国的新药研发也更加理性,在更加平稳的道路上发展和创新。
2.4 我国治疗用生物制品的稳定发展时期在经历了前一阶段的跳跃式发展后,国内治疗用生物制品的研发和申报进入了稳定发展的阶段。2008-2017年的10年期间,国内产品的批准文号剧减到180个,涉及58个品种,国内首次上市批准的新品种也只有28个,是各个阶段国产新产品获批上市最少的一个时期。这一时期的产品减少主要有两个影响因素:一个重要因素是审评资源有限,导致审评审批滞纳较为严重,加之技术要求提升、监管更加严格,2008-2010年的3年内批准的文号数量只有74个,同比时间内仅占2005年到2007年批准总数145个的一半左右;另一个重要因素是受2015年原国家食品药品监督管理局启动临床试验核查的影响,有超过90%的企业撤回了产品上市申请,在2015年7月22日之后的近两年半时间内,仅颁发了45个批准文号[11]。
进口产品在这一期间共批准了53个品种,171个批准文号,其中有25个是原研产品首次在中国获批上市[11],从批准品种和批件数量上看稳中有升,并没有受到政策或行业环境太大的影响。
然而,这段时期却是全球生物药物突飞猛进的发展时期,FDA在这10年期间,一共批准了109个治疗用生物创新药物,超过FDA所有上市创新生物制品的一半以上(57%),可见这10年中我国在治疗用生物制品方面的差距不但没有缩小,反而在进一步加大。此外,FDA批准上市的创新药物,在这一期间进入到国内市场的品种数量却不到10个[10]。见图 7。
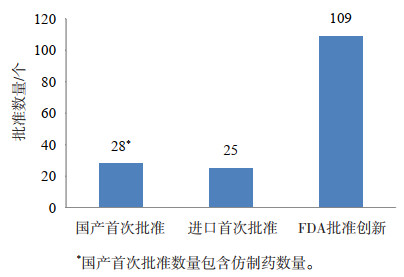
|
图 7 2008-2017年国产、进口和FDA批准的治疗用生物制品品种数量 |
进一步分析已上市治疗用生物制品的创新性,可以发现国内企业的自主创新产品非常有限。截至2017年底,属于完全自主创新的品种数量仅有11个,且一半为国外已上市产品具有相同靶点的改良型创新产品,真正属于First-in-Class的创新产品很少。
反观FDA[10]批准上市的治疗用生物制品,以CDER批准的生物制品为例,批准的143个品种中,仅有9个按生物类似物批准,其余的134个批准上市产品均为创新产品,创新药物比例超过90%。而我国截至2017年底批准上市的治疗用创新生物制品只有11个,创新药物的比例占所有批准上市品种不到7%,对比整体的创新能力,我国企业和国际领先水平的差距还是很明显。批准数量和创新药对比分布如图 8。

|
图 8 我国批准的国产创新药和FDA CDER批准的创新药比重对比 |
除了创新药物在数量上的差距,创新品种在临床应用价值上也存在着较大的差距。FDA批准的创新生物制品,销售额排名前5位的在2017年全球销售额合计超过500亿美元,平均每个品种超过100亿美元,而我国批准的创新生物制品,目前还没有单品种年销售额超过10亿元人民币的产品(截至2017年底),有的品种,还因为上市后临床疗效并不确定,市场逐渐萎缩甚至淡出市场,并未达到新药应有的价值[14]。
3.2 进口生物制品的创新性分析尽管国产的治疗用生物制品的创新不尽人意,但进口的创新治疗用生物制品在满足国内临床需求方面起到了很好的补充作用。从1989年第一个进口治疗用生物制品重组人干扰素α-2b注射液(甘乐能)被我国监管部门批准上市以来,截至2017年底我国批准的进口治疗用生物制品批准文号共有318个(涉及76个品种),其中222个批准文号为原研创新产品在国内的上市许可,即接近70%的产品在批准之时国内尚没有同类品种的仿制药物,在222个原研创新产品的批准文号中,至今仍然有62%的文号产品国内没有仿制品[11]。此外,按照品种,在已批准的76个品种中,到目前为止,仍然有48个品种为进口企业独家创新产品,国内还没有同类仿制产品上市,进口独家品种占到了60%以上,如图 9。虽然进口药品为我国创新药物起到了重要的补缺作用,但由于我国过去的审批政策,国外创新药不能在国内进行全球同步注册申报和临床研究,最终在国内批准上市的时间往往滞后国外上市多年,某种意义上这些进口创新药也就不那么“新”了。

|
图 9 进口生物制品的创新性分析 |
在国内上市的治疗用生物制品中还有一类特殊产品,即我国的特有品种。这些品种仅有国内企业生产,国外没有类似产品上市,属于有中国特色的生物制品。这类药物有的是提取类多组分生化产品,如抗乙型肝炎胎盘转移因子注射液、猪免疫球蛋白口服液和注射用鼠神经生长因子等;也有具有较高技术要求的重组蛋白产品,如重组人表皮生长因子、重组人碱性成纤维细胞生长因子等,但是这些重组表达的蛋白类品种开发的制剂大多为外用制剂、凝胶剂、滴眼剂等,无一品种有注射剂产品,重组蛋白类产品作为外用制剂,生物利用度变异性大,应当继续关注其临床价值的明确性。还有一部分国内企业的改良型创新生物制品,主要是独创剂型。国内独创剂型的治疗用生物制品主要是重组人干扰素α-1b,α-2a和α-2b三个品种,主要是外用制剂,如凝胶剂、栓剂、滴眼液、乳膏剂等。这类改良的创新意义并不大,多数是因为企业已有注射剂了,为了增加临床适用科室而进行的变更,此外,蛋白类产品通过外用给药的方式能否达到有效的治疗作用还值得探究。
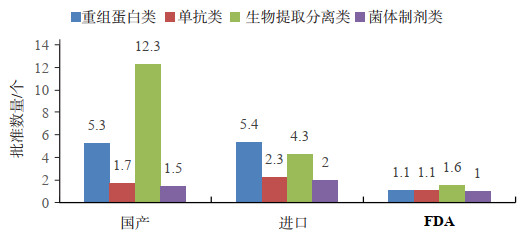
4 已上市治疗用生物制品的技术类别分析 4.1 不同技术类别生物制品的批准文号情况按照不同技术类型,可将已上市治疗用生物制品分为四个主要类别:重组蛋白类、单抗类、生物提取分离类以及菌体制剂类,个别特殊品种不适宜分到这四类,作为其它类别。在国产产品的批准文号中,技术要求相对较低的生物提取分离类产品的批准文号达到了543个,超过了所有批文的50%,第二位的是重组蛋白类,470个批准文号占比也超过了40%。而当前最为热门、技术含量相对最高的单抗类产品,截至2017年底只有10个批准文号(2018年新批准3个),仅占所有批准文号数量不到1% [11]。
对比进口产品情况,重组蛋白类产品的批准文号数量最多,共有220个,占所有批准文号数量的近70%。技术含量较低的生物提取分离类产品批准文号数量不多,仅有40个,占比不到13%,说明进口产品的技术含量相对较高。单抗类产品的批准文号数量有32个,虽然数量也不算多,但数量和比重远远超过国产产品,占比超过10%[11],对我国的单抗类治疗产品起到了一定补充作用。整体情况如图 10所示。从整个批准文号分布可以看出,我国已上市的治疗用生物制品在技术水平上还处于相对早期阶段,低技术含量的产品占主导,高技术高附加值的产品还没有成为主流。
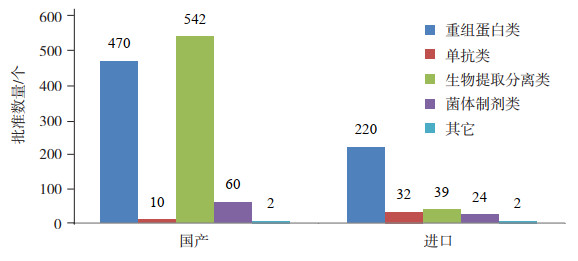
|
图 10 已上市国产和进口治疗用生物制品不同类别的批准文号数量分布 |
对已获批上市的治疗用生物制品品种数量进行统计分析,可以发现批准的品种数量要远少于批准文号数量。国产的重组蛋白类、生物提取分离类和菌体制剂类产品要明显多于进口产品,国产重组蛋白类和菌体制剂类的品种数量甚至超过FDA的批准品种数量,如图 11。我国重组蛋白类产品基本能跟上国际步伐,虽然创新品种很少,绝大多数都是仿制国外已上市产品,但都能达到快速跟进满足国内市场的用药需求。国内批准上市的抗体类药物,品种和数量均明显落后,国产已上市的品种只有6个[11],不足FDA批准品种(71个)的十分之一[10]。此外,进入中国的单抗类药物也并不多,只有14个进口品种,绝大多数抗体类药物并没有进到国内,这与目前国际用药市场抗体类药物占据越来越重要的地位不相匹配。
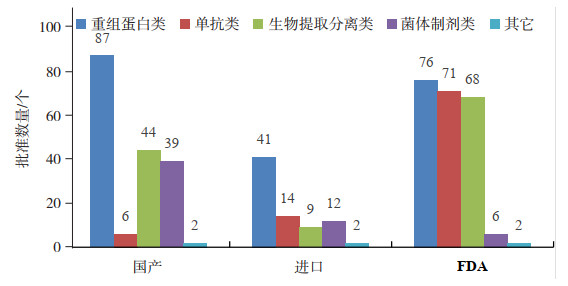
|
图 11 国产、进口和FDA批准的不同技术类别已上市治疗用生物制品品种数量对比 |
国内的菌体制剂是一类很特殊的产品,在FDA批准数量非常少,只有6个,而且都是10年前批准的,可以说这类产品在美国市场份额几近萎缩,国内的进口产品也只有12个,而国产的品种数量却多达39个,虽然90%以上的品种也都是2007年以前批准上市的,但这类品种批准的适应症非常广泛,治疗领域从抗肿瘤到抗菌抗感染等,但实际的临床效果却查不到相关统计数据。
4.3 不同技术类别生物制品的重复申报情况我国治疗用生物制品的上市批准文号中绝大多数都是重复申报,从批准文号数量与品种数量的比值可以反映一定程度的重复度。国产批准文号数量最多的生物提取分离类产品,批准文号的数量是品种数量的12倍之多,重组蛋白类产品也有5倍之多,进口品种则分别为4.4和5.4倍,而FDA批准的上市产品这两类的比值只有1.6和1.1,远远低于国产产品,如图 12。批准文号数量大大高于产品数量主要有两个因素,一是该品种重复申报的企业过多,即大量企业重复申报;二是该品种的上市规格很多,而每一个规格都对应一个批准文号。从技术上看,国产产品重复申报的密集区主要还是集中在低技术含量的生物提取类产品上,尤其是血液制品,包括人血白蛋白、各种免疫球蛋白等产品,这类产品的重复有其自身品种的技术原因,在上世纪90年代批准了一大批血液制品生产企业,而血液制品随着分离纯化技术的进步,本身就会得到多个产品,每个企业都不会把这些产品浪费掉,而是利用起来进行申报,导致这一大类产品成为重复申报的重灾区。此外,一些重组技术产品也存在较为严重的重复申报问题,如重组人促红细胞生成素、重组人粒细胞刺激因子、重组人粒细胞巨噬细胞刺激因子、重组人白介素-2、重组人生长激素和重组人干扰素α-2b等,这些产品的批准文号数量均超过20个,都有不少于5家生产企业,且绝大部分企业的首次批准都是在1999-2005年获得的,说明这一时期的重复申报相对突出。
|
图 12 国产、进口和FDA批准的不同技术类别已上市治疗用生物制品批件数与品种数之比 |
整体上,我国治疗用生物制品经过30多年的发展,从最初的血液提取类生物制品,到重组蛋白类产品[15]以及最新的单抗类产品[16],技术发展上有很大的进步,在不同时期为满足我国的临床用药起到了重要作用。同时也看到我们在创新上的差距,国内已上市的创新产品主要是仿制性创新和改良型创新,还有些没有被国际上广泛认可的国内特有品种,缺少新靶点、新机制、新技术方面等真正意义上的创新产品。近十年来,我们对单抗寄予厚望,这是我们最有可能进行弯道超车的一个领域,然而从目前上市的产品看,如果不是进口产品提供了一定补充,国产的已上市的单抗产品和国际先进水平相比,不论从数量上还是技术水平上,都落后了不止一代,要想在创新上实现突破,还需要政府、科研机构、产业界共同努力。
致谢
本文来自亦弘商学院组织开展的“我国生物制品产品目录分析及建立我国‘紫皮书’的必要性和可行性研究课题”,该课题由国家药品监督管理局药品注册管理司委托。感谢研究期间课题委托单位及业界专家同仁给予的大力支持!
| [1] |
姜德建, 王全军, 杨威, 等. 生物类似药研发法规与评价技术策略[J]. 中南药学, 2016, 14(8): 785-787. |
| [2] |
阿丽塔, 穆鑫, 唐小利, 等. 1984-2014年治疗性生物药物发展历程及展望[J]. 中国药理学通报, 2015, 31(10): 1356-1362. DOI:10.3969/j.issn.1001-1978.2015.10.007 |
| [3] |
王学恭, 杨杰荣. 我国医药产业转型升级的方向和重点[J]. 中国医药工业杂志, 2019, 50(6): 681-686+693. |
| [4] |
闫庆松.新药研发热浪滚滚三大热门依然后劲足[N].医药经济报, 2019-06-24(005).
|
| [5] |
谢华玲, 陈芳, CynthiaLiu, 等. 全球生物制药领域研发态势分析[J]. 中国生物工程杂志, 2019, 39(5): 1-10. |
| [6] |
江先文, 唐宏川, 贾伊伶. 慢性病危险因素控制伦理的理念与原则[J]. 成都医学院学报, 2019(4): 1-5. |
| [7] |
丁晶晶, 刘吴瑕, 徐仲卿. 慢性病管理现状[J]. 中国临床保健杂志, 2019, 22(4): 439-442. DOI:10.3969/J.issn.1672-6790.2019.04.003 |
| [8] |
冯晶晶, 刘宇飞, 靖瑞锋. 慢性病管理的国际经验及启示[J]. 中国药房, 2017, 28(8): 1009-1012. |
| [9] |
刘志磊, 张彦彦, 高恩明, 等. 关于完善生物制品批准文号格式的考虑[J]. 中国生物制品学杂志, 2018, 31(9): 1047-1048. |
| [10] |
FDA.Purple Book[EB/OL].(2018-12)[2019-04-24]. https://www.fda.gov/drugs/therapeutic-biologics-applications-bla/purple-book-lists-licensed-biologicalproducts-reference-product-exclusivity-andbiosimilarity-or.
|
| [11] |
刘志磊, 张彦彦, 李小芳. 我国生物制品的注册历程分析[J]. 中国新药杂志, 2018, 27(21): 2584-2587. |
| [12] |
卫生部.新生物制品审批办法[S]. 1985.
|
| [13] |
国家食品药品监督管理局.局令第28号药品注册管理办法[S]. 2007.
|
| [14] |
药事纵横.重磅药品销售额排名[EB/OL].(2018-2)[2019-04-24]. https://mp.weixin.qq.com/s/m1B3uipolj_5IRm8sGZqQw.
|
| [15] |
曲耀成, 姚雪静. 重组蛋白类药物蛋白含量测定方法研究进展[J]. 药学研究, 2018, 37(3): 174-177. |
| [16] |
董健. 单抗类药物的免疫原性问题及其控制[J]. 中国执业药师, 2012, 9(9): 15-20. DOI:10.3969/j.issn.1672-5433.2012.09.004 |
 2019, Vol. 33
2019, Vol. 33 
