宣肺止嗽丸和消炎栓是甘肃省中医院科研制剂中心生产的医院制剂,临床已使用多年。其原质量标准依据2010年版《中华人民共和国药典》(以下简称《中国药典》)拟定[1],未进行微生物限度检验方法学适用性升级。为保证产品质量,确保安全用药,本文按照《中国药典》2015年版四部[2]通则进行微生物方法学验证。根据制剂抑菌活性的强弱和对不同菌种抑菌程度的大小,选择适当的检查方法,在供试品溶液中分别加入5种验证试验菌株:金黄色葡萄球、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉用于需氧菌总数及霉菌和酵母菌总数计数验证,通过回收率,确定检出方法;宣肺止嗽丸通过加入大肠埃希菌、耐胆盐革兰阴性菌、沙门菌3种验证试验菌株进行检出试验,建立控制菌检查方法;消炎栓通过加入2种验证试验菌株:金黄色葡萄球菌、铜绿假单胞菌进行检出试验,建立控制菌检查方法。
1 试验材料 1.1 试验样品宣肺止嗽丸,规格:9 g/丸,批号:20170205、20170301、20170321;消炎栓,规格:2.95 g/枚,批号:20170222、20170316、20170420;均由甘肃省中医院科研制剂中心生产。
1.2 验证用培养基及稀释剂pH 7.0的氯化钠-蛋白胨缓冲液(批号:20161220)、胰酪大豆胨琼脂培养基(批号:20170106)、胰酪大豆胨液体培养基(批号:20170425)、沙氏葡萄糖琼脂培养基(批号:20161226)、沙氏葡萄糖液体培养基(批号:20161111)、麦康凯液体培养基(批号:20170405)、麦康凯琼脂平板(批号:20170228)均来源于青岛高科园海博生物技术有限公司。其他试剂均为分析纯或化学纯。
1.3 菌种大肠埃希菌CMCC(B)44102、铜绿假单胞菌CMCC(B)44104、枯草芽孢杆菌CMCC(B)63501、金黄色葡萄球菌CMCC(B)26003、白色念珠菌CMCC(F)98001、黑曲霉CMCC(F)98003购于中国食品药品检定研究院。以上菌株传代次数均不超过5代。
1.4 设备超净工作台(BBS-SSC,济南鑫贝西生物技术有限公司)、生化培养箱(LRH-250F,上海一恒)、霉菌培养箱(MJ-250-Ⅱ,上海一恒)、压力蒸汽灭菌锅(BKQP-75L,山东博科生物产业有限公司)、振荡仪(HTY-K,浙江泰林生物技术股份有限公司)、匀浆仪(HTY-761,浙江泰林生物技术股份有限公司)等。
2 方法与结果 2.1 菌液的制备接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物至胰酪大豆胨液体培养基中,培养18~24小时,用pH7.0氯化钠-蛋白胨缓冲液稀释制成每毫升含5000~10000 cfu、500~1000 cfu、50~100 cfu的菌悬液;接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基中,培养24~48小时,用0.9%无菌氯化钠溶液稀释制成每毫升含5000~10000 cfu、500~1000 cfu、50~100 cfu的菌悬液。接种黑曲霉的新鲜培养物至沙氏葡萄糖液体培养基中,培养5~7天,加入3~5 mL0.9%无菌氯化钠溶液,将孢子洗脱,吸出孢子悬液至无菌试管内,用0.9%无菌氯化钠溶液稀释制成每毫升含5000~10000 cfu、500~1000 cfu、50~100 cfu的孢子悬液。所有菌种为第3代,菌悬液为第4代[3-4]。
2.2 供试品溶液的制备宣肺止嗽丸供试液:取宣肺止嗽丸10 g加到灭菌的三角瓶中,加入pH7.0氯化钠-蛋白胨缓冲液100 mL,溶解,混匀,制成1:10供试液。
消炎栓供试液:取消炎栓10 g加到灭菌的三角瓶中,加入45℃的pH7.0氯化钠-蛋白胨缓冲液100 mL,溶解,混匀,制成1:10供试液。
2.3 计数方法适用性试验 2.3.1 需氧菌总数、霉菌和酵母菌总数测定方法的建立及验证1)常规平皿法
试验组:取制备好的供试品溶液10 mL,加入金黄色葡萄球菌菌液0.1 mL,混匀,使每1 mL供试液中含菌量不大于100 cfu,取上述供试液1 mL至无菌平皿中,立即倾注胰酪大豆胨琼脂培养基。同法制备含枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌、黑曲霉的供试液,各取1 mL至无菌平皿中,立即倾注胰酪大豆胨琼脂培养基。再分别取含白色念珠菌和黑曲霉的供试液1 mL至无菌平皿中,立即倾注沙氏葡萄糖琼脂培养基。每种试验菌株各平行制备2个平皿。培养,逐日观察结果并记录菌落数。
供试品对照组:取制备好的供试品溶液,用稀释液代替菌液同试验组操作。
菌液对照组:取稀释液替代供试品溶液,按试验组操作加入试验菌并进行回收试验。
阴性对照组:用同批配制、灭菌的胰酪大豆胨液体培养基1mL替代供试品溶液,用稀释液代替菌液同试验组操作。
以上试验重复进行独立的3次平行试验。
需氧菌总数、霉菌和酵母菌计数方法分别按如下公式进行计算, 菌落回收率(R)=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数。若0.5≤R≤2, 可认为该稀释液制备方法和计数方法可用于该样品的菌落计数。若任一次试验中比值低于0.5,应采用适宜的方法重新进行方法学验证[5-7]。
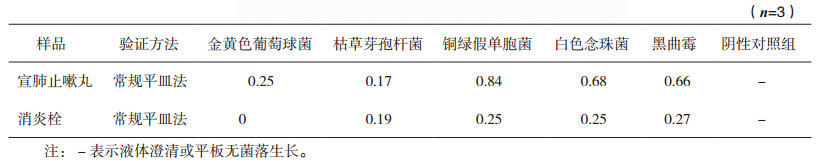
宣肺止嗽丸试验组中金黄色葡萄球菌和枯草芽孢杆菌试验组菌数回收率低于0.5,其他试验菌株的回收率均高于0.5,说明该方法可用于霉菌和酵母菌总数计数,但无法有效检测需氧菌总数,必须重新建立新的需氧菌总数计数方法。消炎栓试验组中各组菌数回收率均低于0.5,说明该方法不能用于其需氧菌总数、霉菌和酵母菌总数计数,必须重新建立新的计数方法。试验结果见表 1、表 2。
|
|
表 1 常规平皿法需氧菌总数计数方法适用性试验回收率 |
|
|
表 2 常规平皿法霉菌和酵母菌总数计数方法适用性试验回收率 |
2)培养基稀释法
试验组:取“2.2”节下的宣肺止嗽丸供试品溶液10 mL,加入金黄色葡萄球菌菌液0.1 mL,混匀,使每1 mL供试液中含菌量不大于100 cfu,取上述供试液0.2 mL至无菌平皿中,立即倾注胰酪大豆胨琼脂培养基。同法制备含枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌、黑曲霉的供试液,各取0.2 mL至无菌平皿中,立即倾注胰酪大豆胨琼脂培养基。每种试验菌株各平行制备10个平皿。培养,逐日观察结果并记录菌落数[8]。供试品对照组、菌液对照组及阴性对照组同“常规平皿法”操作,测定菌落数,计算回收率。
结果宣肺止嗽丸试验组的金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、白念珠菌、黑曲霉回收率依次为0.76、0.69、0.88、0.80、0.74,均高于0.5,说明可以用培养基稀释法(0.2 mL/皿)进行需氧菌总数计数。
3)供试液稀释法
试验组:取“2.2”节下的1:10消炎栓供试品溶液1 mL,加入到100 mL 45℃的pH7.0氯化钠-蛋白胨缓冲液中,混匀,制成1:1000供试品溶液。取制备好的1:1000供试品溶液10 mL,加入金黄色葡萄球菌菌液0.1 mL,混匀,使每1 mL供试液中含菌量不大于100 cfu,取上述供试液1 mL至无菌平皿中,立即倾注胰酪大豆胨琼脂培养基。同法制备含枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌、黑曲霉的供试液,各取1 mL至无菌平皿中,立即倾注胰酪大豆胨琼脂培养基。
取“2.2”节下的1:10消炎栓供试品溶液1 mL,加入到10 mL 45℃的pH7.0氯化钠-蛋白胨缓冲液中,混匀,制成1:100供试液。再分别取含白色念珠菌和黑曲霉的供试液1 mL至无菌平皿中,立即倾注沙氏葡萄糖琼脂培养基。每种试验菌株各平行制备2个平皿。培养,逐日观察结果并记录菌落数。供试品对照组、菌液对照组及阴性对照组同“常规平皿法”操作,测定菌落数,计算回收率[9]。
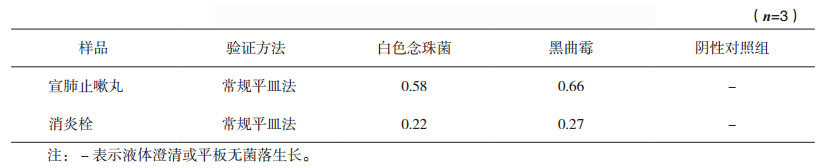
采用1:1000的消炎栓供试液进行消炎栓需氧菌总数计数方法适用性试验,5种菌株回收率均高于0.5,结果见表 3,表明该法可用于消炎栓需氧菌总数计数。
|
|
表 3 消炎栓需氧菌总数计数方法适用性试验回收率 |
采用1:100的消炎栓供试液进行消炎栓霉菌和酵母菌总数计数方法适用性试验,白色念珠菌和黑曲霉回收率分别为0.76、0.75,均符合要求,表明该法可用于消炎栓霉菌及酵母菌总数计数。
2.4 控制菌方法适用性试验 2.4.1 宣肺止嗽丸取“2.2”节下的宣肺止嗽丸1:10供试品溶液进行大肠埃希菌、耐胆盐革兰阴性菌及沙门菌方法适用性检查,结果按常规法进行试验,可以检出试验菌。
2.4.2 消炎栓取“2.2”节下的1:10消炎栓供试品溶液10 mL,加入金黄色葡萄球菌菌悬液1 mL,混匀,使每1 ml供试液中含菌量不大100 cfu,再加入500 mL胰酪大豆胨液体培养基,按《中国药典》2015年版四部金黄色葡萄球菌检查项进行试验,可以检出试验菌;取“2.2”节下制备的1:10消炎栓供试品溶液10 mL,加入铜绿假单胞菌菌悬液1 mL,混匀,使每1 mL供试液中含菌量不大100 cfu,再加入300 mL胰酪大豆胨液体培养基,按《中国药典》2015年版四部铜绿假单胞菌检查项进行试验,可以检出试验菌,方法可行[10]。
试验结果表明,宣肺止嗽丸控制菌可用常规法进行检验,消炎栓的抑菌作用较强,需要采用培养基稀释法检查金黄色葡萄球菌(500 mL)及铜绿假单胞菌(300 mL)。
3 讨论2015年版《中国药典》比2010年版在微生物限度检验部分做了较多修订。变更了试验培养基,选用的菌种及在回收率的计算和控制范围等方面做了较大调整。2010年版《中国药典》规定的回收率不低于70%为合格[1];而2015年版《中国药典》在计数方法适用性试验时,试验组菌落数减去供试品对照组菌落数的值与菌液对照组菌落数的比值应在0.5~2为合格[2]。依据新版药典进行检验品种微生物限度检查方法适用性研究对保证这两个医院制剂的质量具有重要意义。
供试品溶液制备过程中,由于消炎栓是非水溶性供试品,可采用45℃的pH7.0氯化钠-蛋白胨缓冲液溶解,若供试品难溶,可使用匀浆仪低速档混溶或均质器混匀,使供试品充分溶解。此方法较加入助溶剂便捷可靠。
医院制剂作为药品的一种特殊补充形式,长期以来,因其便捷、有效等特点,在临床诊疗服务中发挥着重要作用[11]。中药制剂处方成分复杂,且原料来源主要是植物的根、茎、叶,其微生物污染情况不易控制,如果没有适用的微生物检验验证方法,可能导致微生物限度检查结果误判[12]。因此,通过方法学验证来确定微生物限度检查方法,对于医院制剂的安全性和有效性是非常必要的。
| [1] |
中国药典: 一部[S].北京: 中国医药科技出版社, 2010: 附录79-88.
|
| [2] |
中国药典: 四部[S].北京: 中国医药科技出版社, 2015: 140-149.
|
| [3] |
王永智, 吴宏斌, 邱文娜, 等. 人工牛黄微生物限度检查方法适用性实验[J]. 医药导报, 2017, 38(3): 380-383. |
| [4] |
张婧娴, 黎向阳, 谢芳, 等. 三种医院制剂微生物限度检查方法验证[J]. 海峡药学, 2018, 30(9): 68-71. DOI:10.3969/j.issn.1006-3765.2018.09.025 |
| [5] |
陆定艳, 杨健, 宋菲, 等. 乳没活络散微生物限度检查方法适用性研究[J]. 贵州医科大学学报, 2018, 43(17): 1174-1177. |
| [6] |
刘康连, 庞云娟, 周晓婷. 5种同名异型中药制剂微生物限度检查法的建立与结果分析[J]. 中成药, 2017, 29(7): 1515-1518. DOI:10.3969/j.issn.1001-1528.2017.07.042 |
| [7] |
刘冬玲, 李芳, 冯震, 等. 林可霉素利多卡因凝胶微生物限度检查方法的探究[J]. 药物分析杂志, 2018, 38(5): 838-843. |
| [8] |
檀巧婷, 严佳, 周欣, 等. 4种糖浆剂微生物限度检查方法的建立[J]. 医药导报, 2015, 34(12): 1652-1654. DOI:10.3870/j.issn.1004-0781.2015.12.026 |
| [9] |
古丽巴哈尔·托乎提, 艾山·艾比布勒, 张明君, 等. 5种蒙药医院制剂微生物限度检查方法建立及探讨[J]. 食品安全质量检测学报, 2018, 9(10): 2522-2526. DOI:10.3969/j.issn.2095-0381.2018.10.042 |
| [10] |
陈媛, 吴楣, 蓝红梅, 等. 3种医院软膏剂微生物限度检查方法学研究[J]. 中国医药科学, 2014, 4(12): 105-107. |
| [11] |
张文燕, 郭福庆. 天津市医院制剂抽检微生物限度检查结果及质量分析[J]. 中国药事, 2019, 33(1): 100-107. |
| [12] |
宏伟, 杨开金. 药品微生物限度检查误差分析及应对措施[J]. 实用药物与临床, 2018, 15(10): 182-183. |
 2019, Vol. 33
2019, Vol. 33