2. 国家药品监督管理局, 北京 100037
2. National Medical Products Administration, Beijing 100037, China
为加强对进口药材的监督管理,保障进口药材质量,国家药品监管部门组织对2005年发布并于2006年施行的《进口药材管理办法(试行)》 [1](以下简称《试行办法》)进行修订和完善。2019年5月16日,国家市场监督管理总局发布了修订后的《进口药材管理办法》 [2](以下简称《办法》),并将自2020年1月1日起施行。新发布的《办法》全文共七章35条,对进口药材申请、审批、备案、口岸检验以及监督管理等各方面予以规范,在进口药材管理上,在便利进口单位进口药材的同时,落实“四个最严”要求,严格药材执行的标准,加强溯源管理。本文对《办法》及《试行办法》进行对比分析,以期为相关人员提供参考。
1 进口药材情况简介我国常用中药材近600种,约有十分之一需要进口。进口药材是我国中药材资源的重要组成部分,也是我国中药制药工业的重要支撑,在充实国内药材资源、保证人民用药方面发挥了重要作用[3]。目前,进口药材可大致分为四部分:第一部分属于我国没有药用植物资源分布或分布量较少,历史上一直依赖进口(如乳香、没药、血竭、苏合香、胖大海等);第二部分为我国传统使用的中药材,但近年来国内资源日益减少,从周边国家大量进口以补充临床用药和制药工业的需求(如甘草、石斛、肉苁蓉、北豆根、穿山龙、防风等);第三部分为各少数民族习用药材,其进口数量较少,但品种复杂,基础研究薄弱(如藏紫草、大托叶云实、印度獐牙菜、司卡摩尼亚脂、破布木果等);第四部分为我国已批准的新药制剂中需从国外进口的植物药材原料(如狭叶金光菊、蓝棕果、弗朗鼠李皮等)。
近些年,人口增长、工业发展以及由此带来的自然与社会发展的不和谐因素,使许多在我国原本是大宗、常用的资源变成了短缺资源,因此,进口药材成为短缺中药材资源的有效补充。尤其近年来,受野生资源枯竭的影响,部分进口品种从某种程度上形成了中药资源的补充或替代,典型如沉香、檀香等,迄今,临床使用仍以外来输入为主[4]。
此外,近年来,由于我国自然环境以及农业生产结构的变化,致使我国部分自产药材资源急剧减少;生活水平的提高,也扩大了医药保健品的消费规模,从而使中药材市场供求矛盾不断加剧。中国医药保健品进出口商会数据[5]显示,自2004年以来,中药饮片行业整体增长率保持在30%以上,大大超过了医药加工行业的平均增长速度。据调查了解,现不但通过越南、老挝、缅甸、土库斯曼、塔吉克斯坦、尼泊尔等周边国家大量进口传统药材,非传统进口药材,如西洋参、甘草、人参、石斛、番红花、肉苁蓉等品种的进口量也排在进口药材前列。商务部发布的《2017年中药材流通市场分析报告》 [6]显示,参类药材如高丽红参、朝鲜红参、西洋参数量最多,金额最大;另外,石斛、甘草、乳香、没药、血竭等也为常见品种,亦为大宗的药材品种。
鉴于进口药材在我国中医药体系中的重要作用,国家药品监督管理部门一直十分重视对进口药材的监管。
2 进口药材标准药品标准是检测药品质量是否达到用药要求,并衡量其质量是否稳定均一的技术规定[7]。确定进口药材质量标准也是监管的一项重要研究内容。自1960年由原卫生部签署印发《进口药材标准规格资料》,终结了进口药材无质量标准、不进行检验的历史后,原卫生部和国家药品监管部门先后颁布了多项进口药材标准,历年颁布的进口药材标准详见表 1。
|
|
表 1 历年颁布的进口药材标准 |
20世纪90年代以来,国务院药品监督管理部门对进口药材不断加强监管,取得了积极的成效。自1999年5月1日起,按照原《进口药品管理办法》,以办理批文方式对进口药材进行审批管理。2001年11月7日,原国家药品监督管理局发布了《关于加强进口药材管理有关事宜的通知》 [8],对进口药材的申报资料及通关检验等提出了初步要求,进一步规范了进口药材的监督管理。由于当时批准的药品进口口岸均为城市口岸,边疆地区进口药材存在通关难等问题,2005年3月25日,原国家食品药品监督管理局允许黑河等20个边境口岸作为中药材进口通关口岸[9]。同年11月,原国家食品药品监督管理局颁布了《试行办法》,并于2006年2月1日起施行[1]。《试行办法》中,将进口药材分为首次进口药材和非首次进口药材两类,实施分类管理。《试行办法》试行期间,国家药品监管部门先后发布2批《非首次进口药材品种目录》 [10-11],包括73个品种,目录中涉及药材名称、执行标准以及药材的产地,如加拿大、美国的甘草,马来西亚产的西洋参,印度、尼泊尔的决明子。新发布的《办法》对首次进口药材和非首次进口药材进行了明确:列入目录的品种且从相应产地进口的药材,以及申请人、药材基原以及国家(地区)均未发生变更的,均按非首次进口药材管理;首次进口药材,是指非同一国家(地区)、非同一申请人、非同一药材基原的进口药材。首次进口药材和非首次进口药材的分类管理,在中药材进口监管中发挥了重要作用。
4 进口药材管理办法解读即将实施的《办法》全面落实“放、管、服”改革要求,推进进口药材的管理,保证进口药材质量,缩短进口审批时间,促进药材贸易便利化,惠及广大制药企业和老百姓。下面对《办法》中首次进口药材申请与审批、备案与口岸检验几部分进行梳理,形成流程图,见图 1,方便相关人员查阅。
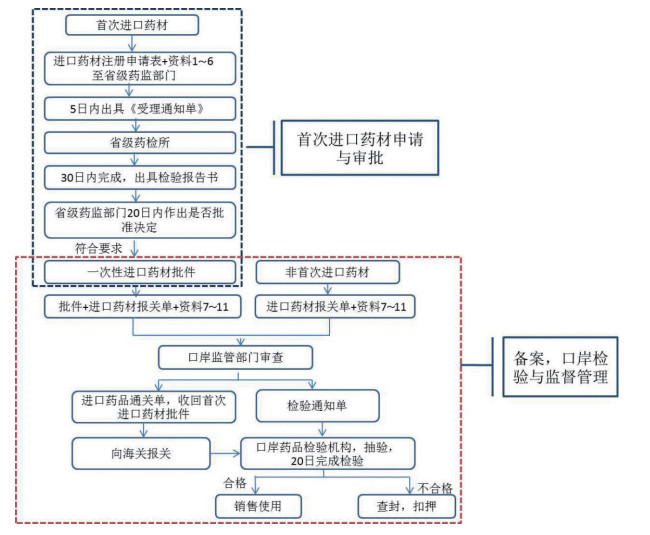
|
资料1.药品生产许可证或者药品经营许可证或药品批准证明文件复印件;资料2.出口商主体登记证明文件复印件;资料3.购货合同及其公证文书复印件;资料4.药材产地生态环境、资源储量、野生或者种植养殖情况、采收及产地初加工等信息;资料5.药材标准及标准来源;资料6.基原鉴定证明原件;资料7.产地证明复印件;资料8.药材标准及标准来源;资料9.装箱单、提运单和货运发票复印件;资料10.转口的进口药材,应提交产地到转口地的全部购货合同、装箱单、提运单和货运发票复印件;资料11.若为濒危野生动植物,应提供允许进出口证明书复印件。 图 1 进口药材管理办法图解 |
首次进口药材,应当取得进口药材批件后,向相关部门办理备案。非首次进口药材,可直接向相关部门办理备案。
《办法》将首次进口药材的审批,通过委托,由《试行办法》的国家食品药品监督管理局下沉至申请人所在地省级药品监督管理部门,原来由中国食品药品检定研究院承担的样品检验,相应地调整至省级药品检验机构。此外,根据风险级别,对非首次进口药材的进口管理进行了简化,由原来的国家食品药品监督管理局进行技术审评和行政审查,颁发《进口药材批件》,调整到口岸或者边境口岸所在地负责药品监督管理的部门进行备案,办理进口药品通关单。《办法》实施后,预计首次进口药材的审批时间将会缩短至20个工作日,非首次进口药材则免去了审批手续,只需备案即可。大量进口药材都是通过边境口岸进口,审批下沉后,相关企业无需专程到北京办理进口审批手续,大大方便了中药材进口企业,也大大缩短了药材进口周期。
4.2 鼓励进口,体现互联互通为鼓励药材进口,《办法》取消了“允许药材进口的边境口岸,只能进口该口岸周边国家或者地区所产药材”的限定,落实“一带一路”倡议,体现“互联互通”精神。中药材进口额较大的品种主要有西洋参、乳香、没药及血竭等,这几类品种占进口总额的70%以上。据了解,进口药材的输出国多为“一带一路”沿线国家和地区,90%以上的进口药材都来自亚洲[5]。药材进口程序的简化将会让境外的优质药材更快、更便捷地进入我国市场,服务于中医药。
4.3 落实“四个最严”要求,严格药材执行标准《办法》规定申请进口的药材应当符合国家药品标准,明确了申请进口的药材应当是《中华人民共和国药典》(以下简称《中国药典》)现行版、进口药材标准及部颁标准等收载的品种。同时,考虑维药、藏药等少数民族药传统上多依赖进口药材,为保障少数民族地区用药,规定少数民族地区进口当地习用的少数民族药药材,尚无国家药品标准的,应当符合相应的省、自治区药材标准。《办法》中标准执行顺序为现行版《中国药典》标准、进口药材标准、其他国家药品标准、省或自治区药材标准。
目前,执行的进口药材质量标准汇编发布于2004年[12],国家食品药品监督管理局委托中国食品药品检定研究院组织口岸药检所,在2012-2015年对部分进口药材标准开展了标准提高研究工作。目前,已明确我国药品标准是以《中国药典》为核心的标准体系,对《中国药典》已收录,且进口药材基原与《中国药典》相同的品种,不再单列进口药材标准,已完成的标准提高工作,由国家药典委员会按照工作程序进行审评,收入《中国药典》2020年版。《中国药典》未收载,或者药典收载的基原与进口药材不同的品种,继续保留进口药材标准。同时,针对无法定标准的进口药材,《办法》取消了“无法定标准的进口药材,自拟药材质量标准”,应按照新药材进行注册申报。
4.4 加强事中事后监管,强化溯源管理针对监管实践中存在的问题,进一步明确进口药材须经口岸检验合格后,方可上市销售使用的要求;明确药品使用、生产方采购进口药材时,应当查验口岸药品检验机构出具的进口药材检验报告书复印件和注明“已抽样”并加盖公章的进口药品通关单复印件,严格执行药品追溯管理的有关规定。同时,提高信息化水平,通过建立统一的信息平台,药材进口申请受理、审批结果、口岸检验情况、有关违法违规的情形及其处罚结果在国家药品监督管理部门网站公开,实现数据共享、社会共治。
由于药材储存有特殊的要求,应避免发霉、虫蛀,为保证药材质量,《办法》进一步规范了进口药材进口单位资格,生产经营范围与中药无关的企业将不能申请进口中药材。按照《试行办法》,进口药材单位,只要是中国境内取得《药品生产许可证》或者《药品经营许可证》的药品生产企业或者药品经营企业即可。而《办法》则规定,进口单位应当是中国境内的中成药上市许可持有人、中药生产企业,以及具有中药材或者中药饮片经营范围的药品经营企业。
此外,在《试行办法》中规定:国家食品药品监督管理局根据需要,可以对进口药材的生产现场进行考察。但是,在《办法》中,明确国家药品监督管理局可根据需要,对进口药材的产地、初加工等生产现场组织实施境外检查;同时,明确药材进口单位应当协调出口商配合检查。该规定对于强化溯源管理具有重要意义。
5 结语《办法》的实施,使得进口程序大大简化,将会让境外的优质药材更好地为中医药所用,满足临床需求。同时,严格执行药品追溯管理,避免了不合格中药材的上市流通,有效保障了药材质量,并可进一步促进进口药材贸易的良性、规范化发展。
| [1] |
国家食品药品监督管理局令第22号进口药材管理办法(试行)[S]. 2005.
|
| [2] |
国家市场监督管理总局令第9号进口药材管理办法[S]. 2019.
|
| [3] |
魏爱华, 田金改. 进口南药(药材)质量标准与药用安全监管现状[J]. 中国药事, 2012, 26(8): 806-808. DOI:10.3969/j.issn.1002-7777.2012.08.004 |
| [4] |
朱建光, 段金廒, 李文林, 等. 外来输入短缺中药材质量监管现状与思考[J]. 中国中药杂志, 2018, 43(12): 2628-2632. |
| [5] |
李得运, 于志斌. 2017年中药材进出口贸易分析[J]. 中国现代中药, 2018, 20(3): 345-348, 354. |
| [6] |
商务部. 2017年中药材流通市场分析报告[EB/OL].[2019-06-15]. http://www.mofcom.gov.cn/article/i/dxfw/nbgz/201806/20180602759461.shtml.
|
| [7] |
王平, 王国荣. 浅析我国药品标准及其在新时期的地位与作用[J]. 中国药事, 2006, 20(1): 22-25. DOI:10.3969/j.issn.1002-7777.2006.01.011 |
| [8] |
国家药品监督管理局.国药管注[2000] 622号关于加强进口药品管理有关问题的通知[S]. 2000.
|
| [9] |
海关总署, 国家食品药品监督管理局.署监发[2005] 130号关于开放黑河等20个边境口岸作为中药材进口通关口岸的通知[S]. 2005.
|
| [10] |
国家食品药品监督管理局.国食药监注[2006] 39号关于施行进口药材管理办法(试行)有关事宜的通知[S]. 2006.
|
| [11] |
国家食品药品监督管理局.国食药监注函[2011] 106号关于将决明子等10个品种列入非首次进口药材品种目录的批复[S]. 2011.
|
| [12] |
国家食品药品监督管理局.国食药监注[2004] 144号关于颁布《儿茶等43种进口药材质量标准的通知》[S]. 2004.
|
 2019, Vol. 33
2019, Vol. 33 

