2. 河北省眼科医院, 邢台 054001;
3. 内蒙古锡林郭勒盟医院, 锡林郭勒 026000
2. Hebei Eye Hospital, Xingtai 054001, China;
3. Xilinguolemeng Hospital of Inner Mongolia, Xilinguolemeng 026000, China
甲状腺相关性眼病(ThyroidAssociated Ophthalmopathy,TAO),也有人称为Graves’眼病(Graves Ophthalmopathy,GO),这是一种常见的与甲状腺相关的器官特异性自身免疫性疾病。可发生于甲亢、甲减、甲功正常的患者。临床表现主要有眼球突出、眼睑挛缩、眶周水肿、球结膜水肿,以及眼球活动障碍,严重者可出现角膜暴露、复视,以及可致失明的压迫性视神经病变[1],会对患者的生活质量产生极大的影响。治疗方法主要包括药物治疗、放射治疗及手术治疗;而药物治疗则是先以大剂量糖皮质激素(Glucocorticoid,GC)冲击治疗,后序贯为口服激素治疗,这是目前指南中推荐的中重度甲状腺相关性眼病一线治疗方案[2]。糖皮质激素全身给药尤其是大剂量冲击治疗可能会导致各系统不良反应,如血糖升高、血压升高、精神兴奋、心律失常、骨质疏松、消化道出血等情况,患者需要在住院监护下治疗,并同时给予相应的药物预防。目前,文献中对糖皮质激素冲击治疗时各不良反应的发生率以及预防用药的选择、疗程等有少量报道[1-2]。本文拟对北京同仁医院使用大剂量糖皮质激素冲击治疗TAO患者的不良反应发生及预防用药情况展开回顾性研究。
1 对象与方法 1.1 对象通过医院病案系统,收集出院日期为2013年1月1日-2018年10月30日的甲状腺相关性眼病患者病例。病例纳入标准:(1)住院期间使用甲泼尼龙冲击治疗;(2)数据齐全、病例相对完整。病例排除标准:(1)高血压患者激素冲击治疗前血压控制未达标(老年人≥150/90 mmHg,青年人及中年人≥140/90 mmHg);(2)糖尿病患者激素冲击治疗前血糖控制不稳定、未达标(根据患者情况制定的个体化控制目标);(3)青光眼患者激素冲击治疗前眼压(Intraocular Pressure,IOP)控制不达标(IOP>21 mmHg);(4)数据或病例信息不完整者。
1.2 方法采用回顾性的调查分析方法。制备TAO患者用药调查表,通过查阅病例,录入以下内容,包括患者基本信息(编号、病历号、性别、年龄、临床诊断、住院时间、住院日)、用药情况(糖皮质激素用法用量、预防消化道损伤药物、预防骨质疏松药物、保肝药、保钾药、降糖药、安眠药等)、不良反应发生情况(血糖升高、血压升高、白细胞升高、眼压升高、肝功能异常、低钾、其他不良反应)等。针对应用GC治疗的患者,对预防用药病例中记录的不良反应进行统计分析。
利用SPSS 22.0软件,针对使用不同预防用药方案,对患者实际不良反应发生率进行组间卡方检验,P<0.05有显著性差异。
2 结果 2.1 基本情况97例患者,男性58例,女性39例。年龄最小者17岁,最大为69岁,平均年龄(47.66±9.54)岁。住院时间最短为3天,最长为22天,平均住院时间为(10.02±3.37)天。
2.2 药物使用情况 2.2.1 糖皮质激素治疗方案97例患者中,96例应用500 mg注射用甲泼尼龙琥珀酸钠+500 mL 0.9%氯化钠注射液静脉滴注3天,第4天改为口服醋酸泼尼松片30 mg qd(早8点)、10 mg qd(下午4点),住院时间为(10.07±3.35)天;另1例患者的给药方案为500 mg注射用甲泼尼龙琥珀酸钠+500 mL 0.9%氯化钠注射液静脉滴注1天,第2天改为口服醋酸泼尼松片30 mg qd(早8点)、10 mg qd(下午4点),共治疗5天。
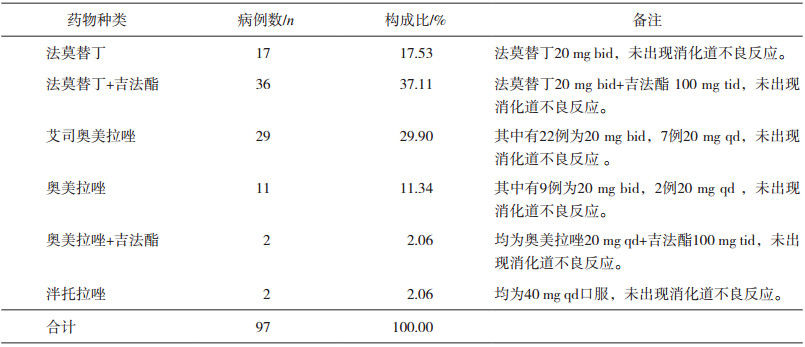
2.2.2 预防消化道损伤的用药所有应用糖皮质激素的患者均使用预防消化道损伤的药物,单用质子泵抑制剂(Proton Pump Inhibitor,PPI)及联合其他胃黏膜保护剂组共44例,占45.36%;单用H2受体拮抗剂(H2-receptor Antagonists,H2RA)及联合其他胃黏膜保护剂组共53例,占54.64%。所有应用预防消化道溃疡药物的患者住院期间均未发生消化道损伤,比较应用PPI与H2RA预防用药的两组患者,两组间实际不良反应发生率无显著性差异(P>0.05),结果如表 1所示。
|
|
表 1 GC治疗预防消化道溃疡用药种类、例数及构成比 |
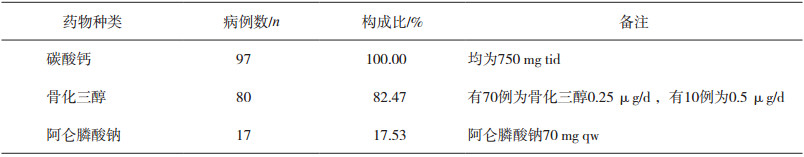
预防骨质疏松的药物,包括基础补充剂如钙剂、维生素D及其活性成分的药物(如骨化三醇、α-骨化醇),抗骨质疏松类药物如双膦酸盐类、鲑降钙素等。97例患者全部补充了碳酸钙片,维生素D制剂的补充主要以骨化三醇为主,仅80例,占比82.47%;另有17例给予阿仑膦酸钠口服预防,占比17.53%。因糖皮质激素诱导的骨质疏松多是长期用药的结果,通常为应用GC 6~12个月后复查骨密度,故本研究中无骨质疏松、骨折等骨相关不良反应发生情况的数据。结果如表 2所示。
|
|
表 2 GC治疗预防骨质疏松用药种类、例数及构成比 |
97例使用糖皮质激素治疗患者中,有3例使用保肝药预防肝脏损害,构成比为3.09%,主要为葡醛内酯及复方益肝灵;另有5例是发生肝脏损害后给予复方益肝灵进行保肝治疗;无预防性补钾药使用。
2.3 不良反应发生情况GC冲击治疗后,96例患者的血糖有所升高(本研究中的升高定义为激素冲击治疗后空腹血糖或餐后血糖高于激素治疗前的基础值即为升高)。发生特点为以餐后血糖升高为主,尤其是午餐和晚餐后血糖,与文献报道一致[3]。如果对GC用药前未诊断为糖尿病患者、以使用GC后任意血糖点≥11.1 mmoL·L-1为诊断糖皮质激素性糖尿病的标准[4],则其发生率为74.63%(50/67)。GC冲击治疗后白细胞升高发生率为15.94%(11/69),白细胞升高的平均数值为(6.86±3.25)×109·L-1,变化幅度最大的是由7.74×109·L-1上升到19.05×109·L-1。其他不良反应发生率为眼压升高11.27%(8/71)、睡眠障碍10.31%(10/97)、低钾血症9.38%(9/96)、肝功能损害5.21%(5/96)。其中血钾平均降低0.47±0.13 mmoL·L-1;肝脏功能损害患者特点是以丙氨酸氨基转移酶升高为主,平均升高(35.00±8.88)U·L-1,天门冬氨酸氨基转移酶平均升高(12.60±5.41)U·L-1。以上不良反应均考虑与糖皮质激素的使用有关。
3 讨论目前,甲状腺相关性眼病的发病机制尚不清楚,治疗也相对比较复杂。尽管临床中不断有新药以及新的治疗方案出现,但激素治疗仍然是其主要的治疗手段,并且取得了一定的疗效[5]。
本研究中糖皮质激素治疗甲状腺眼病的疗程多数在6~12个月,甚至更长。此治疗过程包括大剂量冲击治疗与中等剂量的长程治疗。有研究显示服用糖皮质激素的不良反应按照轻、中、重分类,其发生率依次为17%、61%、13%[6]。本研究中未发生严重不良反应,但是,激素性糖尿病的发生率高达74.70%,这可能与甲状腺疾病本身、既往有激素治疗史等危险因素有关。建议使用激素治疗之前,进行糖耐量检查,糖耐量异常的患者,激素治疗之前即开始干预,重点以生活方式干预为主,可辅以阿卡波糖或者二甲双胍治疗,以减轻胰岛负担。并应对患者的血糖持续关注,每3个月复查糖化血红蛋白,延缓糖尿病的进展。眼压升高的情况位于第2位,可见全身糖皮质激素的应用对眼部影响较大,对高眼压的高危人群应尤为关注,如有青光眼家族史的患者。白细胞增高的情况虽然不少,但导致更严重的不良反应可能性较小,故临床关注度较小。此外,本研究发现低钾血症的发生率为9.38%,程度较轻,这可能与联合应用了氨苯蝶啶或螺内酯有关。建议当患者血钾在4.0 mmoL·L-1以下时,应重点给予关注,警惕低钾血症的发生。本研究中糖皮质激素引起的肝损害,根据药物性肝损害防治指南[7],均评价为轻度肝脏损伤。糖皮质激素导致肝脏损害多为剂量相关性,考虑到GC冲击治疗时肝脏损害程度较轻,后续调整剂量后可能进一步减轻,故GC冲击治疗发现轻中度肝脏损害可不必停药,继续监测即可。
从本研究中可以看出,医生对预防用药重视程度较高,尤其对消化道溃疡的预防性用药达到100%应用,其中PPI的应用略少于H2RA(45.36% vs 54.64%),但是,仍远高于国外的7.5%~19.0% [8]。现有研究表明,糖皮质激素使用后消化道溃疡的发生率为0.4%~1.8% [9],胡建武[10]对应用糖皮质激素的急性慢性阻塞性肺病患者预防使用PPI的调查分析,显示GC与消化道溃疡的风险并无明确相关性,PPI治疗对于减少GC的胃肠道不良反应并没有充分证据支持。但是,在2016年欧洲Graves眼病专家组(European Group of Graves’Orbitopathy,EUGOGO)的眼病管理指南中,提到使用大剂量糖皮质激素冲击治疗Graves眼病时,应该同时使用PPI保护胃黏膜,预防消化道溃疡。也有研究[11]依据外源性GC致溃疡作用的危险因素,建议当激素的剂量高于0.5mg·(kg·d)-1(以泼尼松为例)时,应给予PPI预防胃黏膜损伤;当糖皮质激素联合非甾体类抗炎药(Nonsteroidal Anti-inflammatory Drugs,NSAIDs)时,无论糖皮质激素剂量多少,都应给予PPI预防胃黏膜损伤;如需长期服用,其剂量为2.5~15 mg·d-1(以泼尼松为例)的人群,应密切关注其胃肠道出血症状,必要时给予PPI。
根据中国2013年中国糖皮质激素诱导的骨质疏松防治建议[12],应用糖皮质激素患者,推荐每日摄入钙元素和维生素D总量(包括食物来源)分别为1200~1500 mg和800~1000 U。维生素D也可是活性维生素D,包括骨化三醇与阿法骨化醇,其推荐剂量为0.25~0.5μg·d-1与0.5~1.0μg·d-1。如服用糖皮质激素剂量≥7.5 mg·d-1且超过3个月,存在任何一项骨折风险因素(或用FRAX评估为低骨折风险),则建议应加用双膦酸盐治疗(证据水平1,推荐等级A)。2017年美国风湿病学会关于糖皮质激素诱发的骨质疏松症的预防和治疗中指出[13],将对于中危和高危骨折成人患者,推荐口服双膦酸盐为首选治疗;低危患者仅以钙剂和维生素D基础治疗。本研究中钙剂的预防性应用达到100.0%,而维生素D的应用仅82.46%,双膦酸盐类药物的应用比例更低,仅为17.53%。一方面可能与医生对使用双膦酸盐药物的重视程度不够有关,另一方面可能也与此类药物的应用注意事项较多有关,医生顾虑较多,患者依从性较差,导致此类药物应用较少。
结合本研究中糖皮质激素导致的不良反应发生特点及预防用药使用情况,笔者认为使用糖皮质激素治疗TAO时,预防骨质疏松的方案,除补充钙剂外,维生素D的补充以及双膦酸盐的应用亦有充分的循证支持,需要更多的关注;预防消化道溃疡方面,本研究的结果提示PPI与H2RA在预防糖皮质激素应激性溃疡的效果上无显著性差异,考虑到PPI长期使用可能导致肾脏功能异常、钙镁等微量营养素缺乏、骨质疏松风险增加等多种问题[14],建议没有应激性溃疡的高危因素时选择H2RA即可,如需使用PPI类药物预防,应尽量缩短疗程。而对于可能导致的低钾、肝脏功能异常,应给予更多的监测和关注,一般无需使用相关药物进行预防性治疗。
| [1] |
卫生部. 糖皮质激素类药物临床应用指导原则[J]. 中华内分泌代谢杂志, 2012, 28(2): 2-2. |
| [2] |
Bartalena L, Baldeschi L, Boboridis K, et al. The 2016 European Thyroid Association/European Group on Graves'Orbitopathy Guidelines for the Management of Graves'Orbitopathy[J]. Eur Thyroid J, 2016, 5(1): 9-26. DOI:10.1159/000443828 |
| [3] |
Clore JN, Thurby-Hay L. Glucocorticoid-induced Hyperglycemia[J]. Endocr Pract, 2009, 15: 469-74. DOI:10.4158/EP08331.RAR |
| [4] |
PerezA, Jansen-ChaparroS, SaigiI, et al. Glucocorticoidinduced Hyperglycemia[J]. J Diabetes, 2014, 6: 9-20. DOI:10.1111/jdb.2014.6.issue-1 |
| [5] |
屠晓芳, 张洪梅. 甲状腺相关性眼病的评估方法及激素治疗进展[J]. 中国全科医学, 2017, 20(18): 2294-2298. DOI:10.3969/j.issn.1007-9572.2017.04.y13 |
| [6] |
张鹤. 大剂量糖皮质激素联合免疫抑制剂治疗甲亢眼病的效果及其安全性分析[J]. 中国医学创新, 2018, 440(14): 125-128. |
| [7] |
中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 实用肝脏病杂志, 2017, 20(2): 1-18. |
| [8] |
Eom CS, Jeon CY, Lim JW, et al. Use of Acidsuppressive Drugs and Risk of Pneumonia:A Systematic Review and Meta-analysis[J]. CMAJ, 2011, 183(3): 310-319. DOI:10.1503/cmaj.092129 |
| [9] |
Dorlo TP, Jager NG, Beijnen JH, et al. Concomitant Use of Proton Pump Inhibitors and Systemic Corticosteroids[J]. Ned Tijdschr Geneeskd, 2013, 157(19): A5540. |
| [10] |
胡建武, 苏艳伟, 杜丽芬, 等. 某院应用糖皮质激素的AECOPD患者预防使用质子泵抑制剂的调查分析[J]. 中国药房, 2017(2): 161-164. |
| [11] |
高申. 质子泵抑制剂临床应用的药学监护[M]. 北京: 人民卫生出版社, 2013: 26-28.
|
| [12] |
中华医学会风湿病学分会. 糖皮质激素诱导的骨质疏松诊治的专家共识[J]. 中华风湿病学杂志, 2013, 17(6): 363-368. DOI:10.3760/cma.j.issn.1007-7480.2013.06.002 |
| [13] |
白炜, 冷晓梅. 2017年美国风湿病学会糖皮质激素诱发的骨质疏松症预防及治疗指南概要解读[J]. 中华临床免疫和变态反应杂志, 2017, 11(4): 313-317. DOI:10.3969/j.issn.1673-8705.2017.04.001 |
| [14] |
Freedberg DE, Kim LS, Yang YX. The Risks and Benefits of Long-term Use of Proton Pump Inhibitors:Expert Review and Best Practice Advice from the American Gastroenterological Association[J]. Gastroenterology, 2017, 152(4): 706-715. DOI:10.1053/j.gastro.2017.01.031 |
 2019, Vol. 33
2019, Vol. 33