2. 浙江海正药业股份有限公司, 台州 318000
2. Zhejiang Hisun Pharmaceutical Co., Ltd., Taizhou 318000, China
抗体偶联药物(antibody-drug conjugate,ADCs),是当前生物药研发的前沿领域,由单克隆抗体和强效细胞毒性化合物通过连接子偶联而成,被称为生物药“制导系统” [1]。药物进入体内以后,抗体发挥靶向指引作用寻找到肿瘤细胞,微环境下释放出小分子化合物杀伤肿瘤细胞,而不杀伤正常细胞,从而有效降低药物对人体伤害。目前,我国也成功研制出一种针对HER2靶点的ADC药物,即注射用重组抗HER2人源化单克隆抗体偶联美登素衍生物DM1。药物在体内通过与HER2受体Ⅳ亚区结合被细胞内化,经溶酶体内的蛋白酶作用降解释放出细胞毒素DM1,DM1通过与微管蛋白结合破坏细胞微管网络,抑制细胞分裂和诱导凋亡,从而抑制肿瘤生长[1-3]。
通常情况下,对抗体类药物开展试验研究时,相关种属只有灵长类动物。抗体偶联药基于结构组成,既有生物药因素,也有化学药因素。所以,在开展研究时,需要采用啮齿类和非啮齿类动物,即大鼠和食蟹猴,应用两种属动物进行研究[4-5]。本文对我们已经开展的大鼠重复静脉注射给药毒性研究结果进行归纳和总结,以评价药物的安全性和可能发生的风险。研究内容包括动物给药后产生的不良反应及严重程度,主要毒性靶器官及损害可逆程度,无毒性反应剂量(NOAEL)等,为后续开展临床试验提供参考依据[4, 6]。
1 材料和方法 1.1 试药与仪器注射用重组抗HER2人源化单克隆抗体偶联美登素衍生物DM1(批号:20131101,浙江海正药业股份有限公司提供);空白对照品(含10 mmol·L-1琥珀酸钠,含0.02%的聚山梨酯20和60 mg·mL-1蔗糖,浙江海正药业股份有限公司);已知对照药品(ado-trastuzumab emtansine,商品名Kadcyla®,批号:578444,美国Genetech公司),放置2~8 ℃、避光保存。
流式检测用mouse anti-human CD8: FITC,CD4: PE和CD3: PerCP抗体(美国BD公司);血清生化检测试剂(北京中生生物工程公司);MINI AM4290尿分析仪(日本京都Aution公司);H-500FRS台式高速冷冻离心机(日本Kokusan公司);MICROX SPINNER离心涂片机(日本Onron公司);ADVIA 120血液学分析仪;Rapidchem 744电解质分析仪(德国拜耳公司);7060型全自动生化分析仪(日本日立公司);BD FACS Calibur流式细胞仪(美国BD公司);TEC5EMJ-2型自动包埋机,DRS-2000自动染色机和封片机(日本Sakura公司);Nikon 80i显微镜(日本Nikon公司)。
1.2 实验动物SPF级大鼠,雌雄各半(雌性144.9~170.3 g;雄性158.9~184.2 g),210只,7~8周龄;购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2012-0001。PC聚碳酸酯鼠盒饲养,2~3只/笼。饲料北京科澳协力饲料有限责任公司提供,饲料持续供给,不限量自由摄取,动物解剖前禁食过夜。饲养室控制温度20~26 ℃,湿度40%~70%,换气次数15次/小时,照明12 h/天。
1.3 试验方法受试物提供机构前期研究证明,其靶点及药理药效作用与上市药Kadcyla®相似,Kadcyla®临床建议初始剂量为3.6 mg·kg-1。因此,本研究中,设定低、中、高3个受试药组(即5、11和22mg·kg-1,折算成DM1给药量分别是85、187和373μg·kg-1)和1个已知对照药品组(22 mg·kg-1,Kadcyla®),受试物按照体重折算分别相当于临床拟用量1.39、3.06、6.11倍,按照体表面积折算分别相当于临床拟用量0.21、0.47、0.93倍。动物检疫结束后,根据体重随机分成5个试验组,包括空白对照组,供试品低、中、高剂量组和已知对照药品组,每组30只,雌雄各半;和5个对应的卫星组,每组12只,雌雄各半。动物采用尾静脉注射给药。每周给药1次,连续给药3次,末次给药后恢复3周[7-9]。
1.4 检测指标研究期间,每天观察动物的临床症状,每周称量2次动物体重。分别于每次给药后6 h内、给药后第2天、以及恢复期结束进行体温测定。卫星组动物,分别于第三次给药前、给药后0.5、4、8、24、72 h,末次给药后5、7、14、21天采血,采用桥联ELISA法测定血清针对受试物的特异性抗体[10]。给药结束时,每组解剖20只动物(雌雄各10只),恢复期结束时,每组解剖10只动物(雌雄各5只)。对解剖动物采血,进行血液学(含血凝)、血清生化检查、尿检查、并测定血液中CD4+/CD8+淋巴细胞比例。剖检动物进行骨髓涂片并镜检、脏器称重、大体病理学和组织病理学检查。
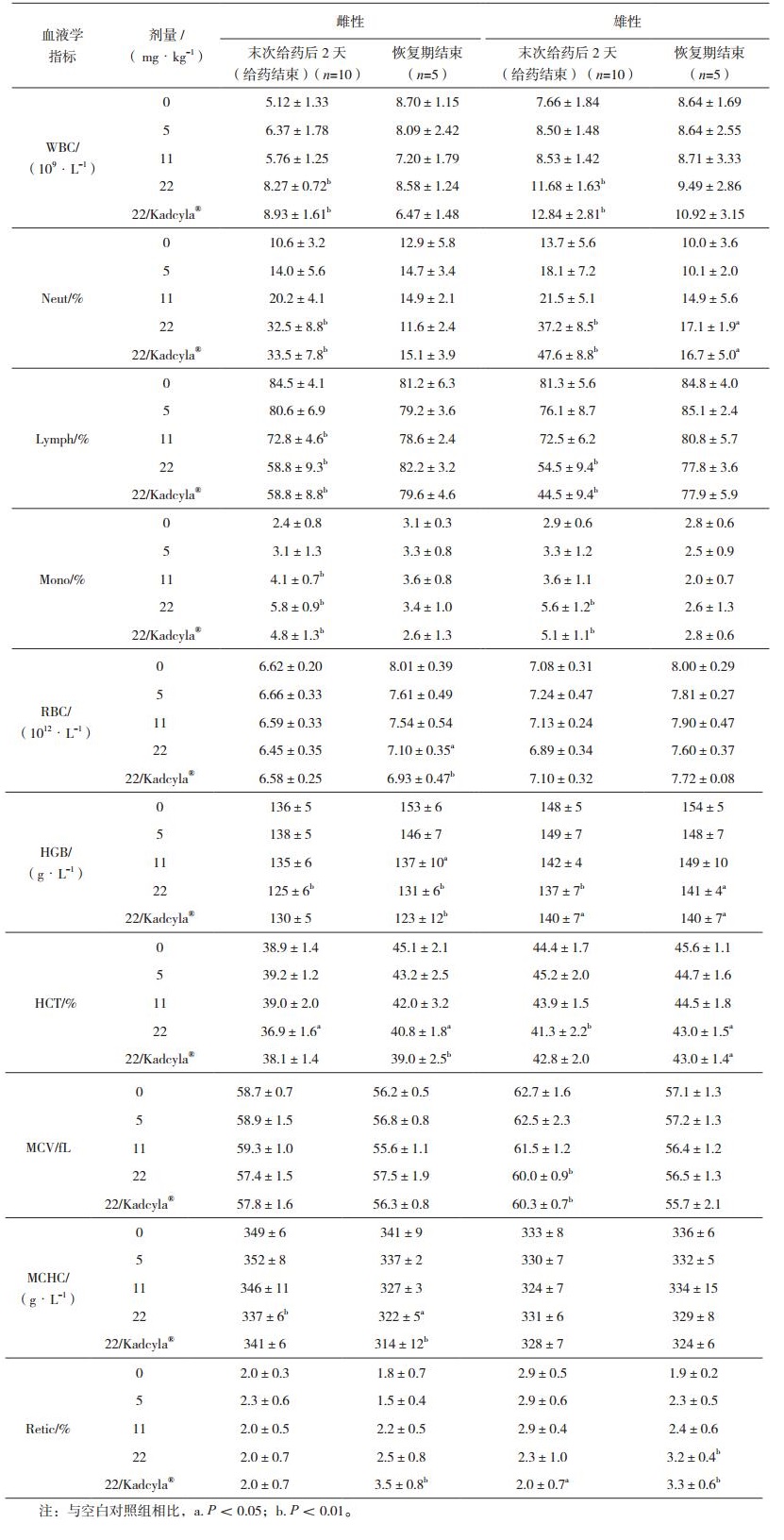
血液学(含血凝)检查指标包括:白细胞计数(WBC)、各类白细胞比例包括中性粒细胞(Neut)、淋巴细胞(Lymph)、单核细胞(Mono)、嗜酸性粒细胞(Eos)和嗜碱性粒细胞(Baso)、红细胞计数(RBC)、血红蛋白浓度(HGB)、红细胞比容(HCT)、平均红细胞容积(MCV)、平均血红蛋白量(MCH)、平均血红蛋白浓度(MCHC)、血小板数(PLT)、平均血小板容积(MPV)、网织红细胞比例(Retic),以及凝血酶原时间(PT)和活化部分凝血酶原时间(APTT)。
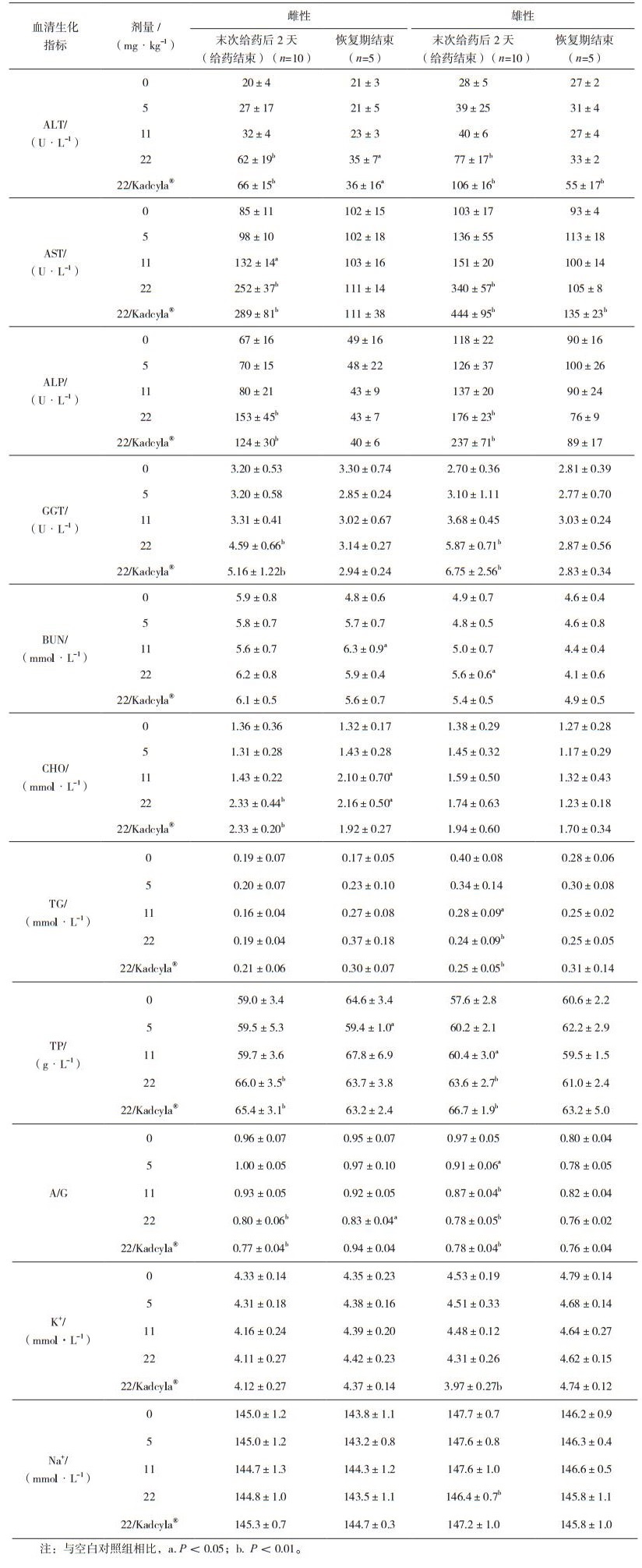
血清生化检查指标包括:丙氨酸氨基转换酶(ALT)、天门冬氨酸氨基转换酶(AST)、碱性磷酸酶(ALP)、肌酸磷酸激酶(CK)、γ-谷氨酰转肽酶(GGT)、乳酸脱氢酶(LDH)、总胆红素(TBIL)、尿素氮(BUN)、肌酐(CRE)、葡萄糖(GLU)、总胆固醇(CHO)、甘油三酯(TG)、总蛋白质(TP)、白蛋白(ALB)、白蛋白/球蛋白(A/G)、血清钾(K+)、血清钠(Na+)、血清氯(Cl-)。
1.5 统计学方法计量数据以均数±标准差(x±s)表示,对于两组数据的比较,即对不同实验组的检测结果与对照组的比较,应用t检验进行分析,当P<0.05时,表示两组比较的差异具有统计学意义。
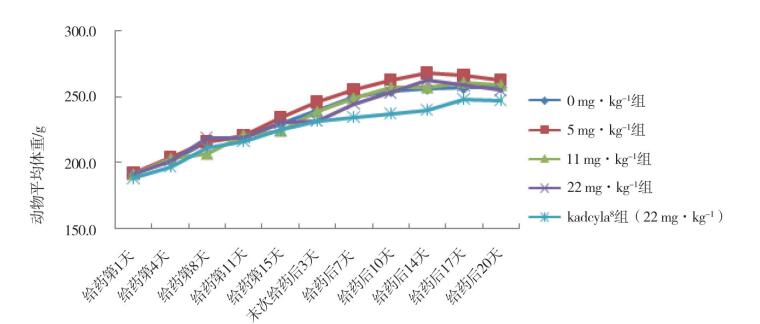
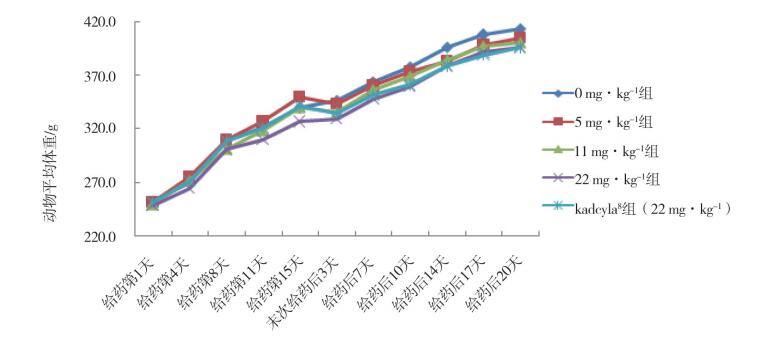
2 结果 2.1 一般状况研究期间,受试物低、中、高剂量组动物和对照药品组动物,临床症状均未见异常,受试物各剂量组动物和对照药品组动物,体重增长均无显著性差异(见图 1和图 2)。摄食量在受试物低、中剂量组,雌雄动物均无显著性差异;受试物高剂量组雌性,在给药第8天,摄食量显著下降(P<0.01);给药第15天,摄食量仍低于空白对照组,但两组比较无统计学差异;末次给药后7天,摄食量恢复无显著性差异。受试物高剂量组雄性,在给药第8天和第15天,摄食量均显著下降(P<0.05);给药后7天,摄食量恢复无显著性差异。对照药品组雌性和雄性动物,在给药第8天和第15天,均出现摄食量显著下降,末次给药后7天,摄食量均恢复。受试物低、中、高剂量组动物和对照药品组动物体温,均无显著性差异。
|
给药第1天~第15天(n=10);末次给药后3天~20天(n=5)。 图 1 注射用重组抗HER2人源化单克隆抗体偶联美登素衍生物DM1重复给药后雌性动物体重变化 |
|
给药第1天~第15天(n=10);末次给药后3天~20天(n=5)。 图 2 注射用重组抗HER2人源化单克隆抗体偶联美登素衍生物DM1重复给药后雄性动物体重变化 |
尿常规检查显示,在给药结束时,受试物和对照药品组动物,对雌性动物尿pH值有显著影响,对雄性动物无影响。恢复期结束,受试物和对照药品组雌性动物尿PH值均恢复到与空白对照组比较无显著性差异水平。
2.3 血液学分析血液学检查结果显示,在给药结束时,受试物低剂量组雌性和雄性动物各项血液学参数均无显著性差异;受试物中、高剂量组雌性和雄性动物,会引起Lymph、RBC、HGB、HCT、MCV、MCH、MCHC、APTT显著下降,WBC、Neut、Mono、Eos、Baso、Retic显著升高。在恢复期结束时,由受试物引起的上述大多数改变均恢复,与空白对照组相比无统计学差异。对照药品组雌性和雄性动物,在给药结束和恢复期结束时,血液学参数变化与高剂量组动物基本一致(见表 1)。受试物各剂量组和对照药品组动物,外周血CD3+/CD4+、CD3+/ CD8+淋巴细胞比例,与空白对照组相比无显著性差异。
|
|
表 1 注射用重组抗HER2抗体偶联药物重复给药毒性研究血液学分析(x±s) |
血清生化检查结果显示,在给药结束时,受试物低、中剂量组雌性和雄性动物,指标AST、TG、TP、A/G与空白对照组比较出现显著性改变。在恢复期结束,部分指标恢复到无显著性差异水平。受试物高剂量组雌性和雄性动物,在给药结束时,引起TG、A/G、Na+、K+显著下降,ALT、AST、ALP、GGT、CHO、LDH、BUN、TP显著升高。在恢复期结束,上述大多数指标的显著性改变均恢复到无显著性水平。对照药品组雌性和雄性动物,在给药结束和恢复期结束时,血清生化参数变化与高剂量组动物基本一致(见表 2)。血清抗体测定结果显示,各时间点动物血清中均未见对受试物的特异性抗体免疫反应。
|
|
表 2 注射用重组抗HER2抗体偶联药物重复给药毒性研究血清生化分析(x±s) |
骨髓检查分析结果显示,在给药结束时,受试物低、中剂量组雌性和雄性动物均无显著性改变。受试物高剂量组雌性和雄性动物,中晚幼红(Poly)、红系总数(Total)显著下降,原红(Pro)、原粒(Bl)、早幼粒(Pro)、中幼粒(Myelo)、成熟粒(Mature)、嗜酸粒(Eosi)、粒系总数(Total)、粒红比(M/E)显著升高。在恢复期结束时,上述改变均恢复。对照药品组雌性和雄性动物,在给药结束和恢复期结束时,也会引起上述指标发生同样的改变。
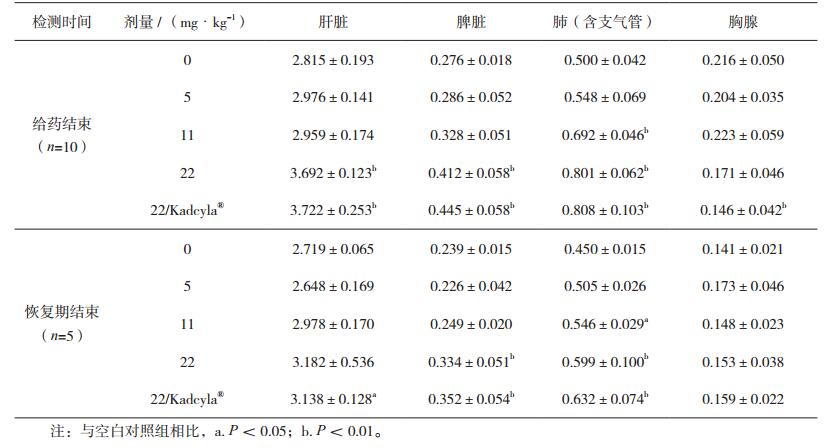
2.6 动物脏器重量分析试验结果显示,受试物低剂量组雌性和雄性动物各脏器重量均无显著性改变。在给药结束时,受试物中剂量组雌性动物肺(含支气管)重量增加;恢复期结束时,雌性动物肺(含支气管)重量仍然增加,雄性动物睾丸重量减少。在给药结束时,受试物高剂量组雌性和雄性动物肝脏、脾脏、肺(含支气管)重量增加,睾丸和附睾重量减少;在恢复期结束时,雌性和雄性动物肝脏、脾脏、肺(含支气管)重量仍然增加,睾丸重量减少,附睾重量虽然低于空白对照组但无统计学差异。对照品组雌性和雄性动物,在给药结束和恢复期结束时,脏器重量变化与高剂量组动物基本一致(见表 3和表 4)。
|
|
表 3 注射用重组抗HER2抗体偶联药物重复给药毒性研究雌性动物相对脏器重量(g/100g,x±s) |
|
|
表 4 注射用重组抗HER2抗体偶联药物重复给药毒性研究雄性动物相对脏器重量(g/100g,x±s) |
上述重量改变的脏器在组织病理学检查中发现:1)肝脏:肝细胞/枯否氏细胞有丝分裂相增加和/或肝细胞肥大;2)脾脏:网状内皮细胞有丝分裂相增加、红髓扩张;3)肺(含支气管):间质/被膜下炎性细胞浸润和/或泡沫细胞聚集;4)睾丸:生精细胞数目减少、生精细胞变性坏死;5)附睾:精子减少症、间质炎性细胞浸润以及间质纤维组织增生。上述改变,考虑与给予受试物或对照药品相关,建议临床密切观察。
2.7 组织病理学检查大体病理学检查发现动物肺(含支气管)灰白色斑块。给药结束时,空白对照组,受试物低、中、高剂量组及对照药品组,雄性动物的发生率分别为1/10、0/10、2/10、1/10、6/10;雌性动物仅在对照药品组发生,发生率为4/10。恢复期结束时,仅在对照药品组发现1只雌性动物出现灰白色斑块。镜下与之相应的组织病理学改变为间质/被膜下炎性细胞浸润。这项改变,对照药品组发生率明显高于空白对照组,因此,肺(含支气管)灰白色斑块与给予对照药品相关。
大体病理学检查还发现睾丸体积减小。给药结束时,受试物高剂量组和对照药品组各有1只雄性动物。恢复期结束时,该病变发生于中剂量组、高剂量组以及对照药品组,发生率分别是1/5、3/5、4/5。镜下与之相应的组织病理学改变为睾丸生精细胞数目减少、生精细胞变性坏死。该大体病理学改变与组织病理学及脏器重量密切相关,因此,考虑睾丸体积减小与给予受试物及对照药品相关。其他各组织器官,未见大体病理学改变。
受试物相关的组织病理学改变主要包括:肝脏的肝细胞/枯否氏细胞有丝分裂相增加;肾脏的肾小管上皮细胞有丝分裂相增加;脾脏的网状内皮细胞有丝分裂相增加;垂体、肾上腺的腺上皮细胞有丝分裂相增加;舌、皮肤、注射部位的鳞状上皮基底层细胞有丝分裂相增加;眼球的眼角膜上皮细胞有丝分裂相增加。对照药品组动物,在上述脏器中发生同样的组织病理学改变。这些病变均与DM1作用机制相关,认为与给予受试物及对照药品相关。
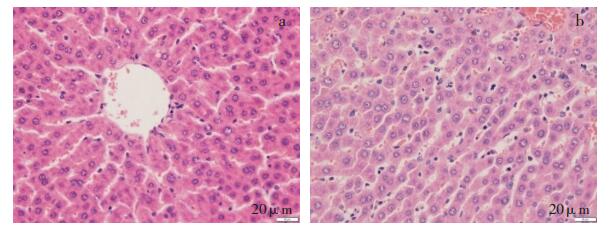
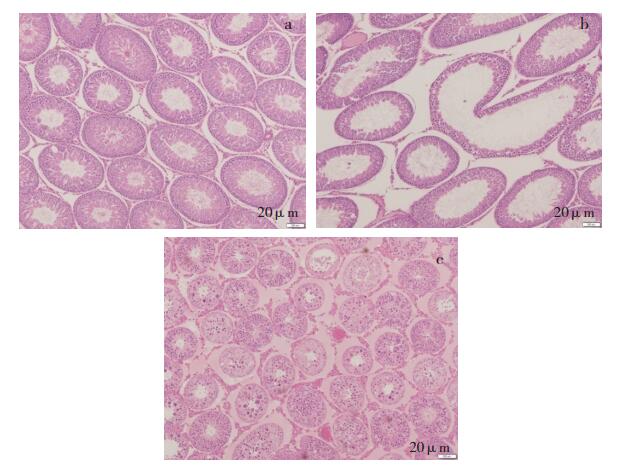
给予受试物后引起的呈剂量效应相关的肝脏枯否氏细胞单个细胞变性坏死(见图 3),肾脏肾小管上皮细胞变性坏死,胸腺皮质淋巴细胞变性坏死,十二指肠固有层腺上皮细胞变性坏死,脾脏白髓淋巴细胞数目减少、红髓扩张,肠系膜淋巴结皮质淋巴细胞数目减少,胸腺皮质淋巴细胞数目减少,睾丸生精细胞数目减少、生精细胞变性坏死(见图 4),附睾精子减少、间质炎性细胞浸润及间质纤维组织增生,胸骨(骨髓)骨髓细胞数目减少。对照药品组动物,在上述脏器中发生相同的组织病理学改变。这些改变与文献报道Kadcyla®(对照药)的病变相一致[9],认为与给予受试物及对照药品相关。
|
a.空白对照组,给药结束;b.受试物高剂量组,给药结束,肝脏肝细胞/枯否氏细胞有丝分裂相增加,枯否氏细胞单个细胞变性坏死。 图 3 注射用重组抗HER2人源化单克隆抗体偶联美登素衍生物DM1重复给药后动物肝脏变化 |
|
a.空白对照组,给药结束;b.受试物高剂量组,给药结束,睾丸生精细胞数目减少;c.受试物高剂量组,给药结束,睾丸生精细胞变性坏死。 图 4 注射用重组抗HER2人源化单克隆抗体偶联美登素衍生物DM1重复给药后动物睾丸变化 |
给予受试物及对照药品后,肺(含支气管)的间质/被膜下炎性细胞浸润发生频率及病变程度均高于空白对照组动物,且呈剂量相关性。该变化与在肺脏重量增加以及大体病理学发现肺脏灰白色斑块密切相关。因此,肺(含支气管)间质/被膜下炎性细胞浸润与给予受试物及对照药品相关。
恢复期结束,肝脏的肝细胞肥大、卵圆细胞增生,肺脏泡沫样细胞聚集,肾脏肾小管上皮细胞肥大的组织病理学改变发生频度较高并呈剂量效应关系,考虑为病变未完全恢复时或代偿性的组织病理学表现,认为与给予受试物及对照药品相关。
3 讨论研究结果表明,大鼠反复给予受试物后会出现一定程度的不良反应,且作用强度呈剂量依赖性递增。研究中平行设定对照药品组(Kadcyla®),给药剂量22 mg·kg-1,与受试物高剂量组一致,以考察两种药物的体内毒副反应是否一致。通过对动物一般状况、血液学、血清生化、组织病理学等指标测定,高剂量组动物出现的毒副反应作用及强度与对照药品组基本一致,证明两种药物的大鼠体内毒性试验结果具有相似性和可比性。本研究中,与受试物相关的毒性靶器官为肝脏、肾脏、脾脏、胸腺、肺(含支气管)、肠系膜淋巴结、十二指肠、睾丸、附睾、眼球、垂体、肾上腺、皮肤、注射部位、舌、胸骨(骨髓)。未见毒性反应剂量(NOAEL≤5 mg·kg-1)。建议受试物在临床使用时密切关注用药反应,必要时调整剂量。
ADC药物具有化药属性,所以需要使用啮齿类动物大鼠评价其中小分子结构的安全性。受试物结构为曲妥珠单抗上连接小分子化药美登素衍生物DM1。动物给予较高剂量为22 mg·kg-1,折算成DM1剂量是0.37 mg·kg-1,大鼠给药后表现出良好的耐受性。以往研究证明,化药DM1虽然有较强的抗肿瘤活性,但因毒性大,无法在临床上直接使用[2]。我们开展的一项剂量探索试验中发现,SD大鼠单次给予DM1后,最大耐受量为0.20 mg·kg-1。本实验结果证明,动物反复给予抗体偶联药后,耐受剂量可以达到0.37 mg·kg-1,大约2倍于单独给药DM1的最大耐受量,体内耐受性显著提高。由此可见,抗体偶联药物结构形式可以显著改善化学药的体内耐受性,提高临床应用性和安全窗[11]。ADC药物的设计理念,为高活性但因毒性较大无法在临床上直接使用的药物提供了新的开发途径和研究思路[12-13]。
| [1] |
Su D, Kozak KR, Sadowsky J, et al. Modulating Antibody-Drug Conjugate Payload Metabolism by Conjugation Site and Linker Modification[J]. Bioconjug Chem, 2018, 29(4): 1155-1167. DOI:10.1021/acs.bioconjchem.7b00785 |
| [2] |
王彦明, 郝伯钧, 李静, 等. 美登素类抗体药物偶联物研究进展[J]. 国际药学研究杂志, 2016, 43(3): 410-419. |
| [3] |
唐煜, 王相阳, 马小慧, 等. 抗体偶联药物内吞作用机制的研究进展[J]. 中国新药杂志, 2017, 26(10): 1130-1136. |
| [4] |
OECD. Guidance ICH S6(R1): Preclinical Safety Evaluation of Biotechnology-derived Pharmaceuticals[EB/OL]. (2011-07-01)[2019-03-21]. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Safety/S6_R1/Step4/S6_R1_Guideline.pdf.
|
| [5] |
闫莉萍, 王海学, 王庆利. 抗肿瘤抗体偶联药物非临床药理毒理研究的考虑要点[J]. 中国新药杂志, 2017, 26(16): 1894-1899. |
| [6] |
Blaich G, Baumann A, Kronenberg S, et al. Non-clinical Safety Evaluation of Biotherapeutics-Challenges, Opportunities and New Insights[J]. Regul Toxicol Pharmaco, 2016, 80S: S1-S14. |
| [7] |
国家食品药物监督管理总局药品评审中心.药物重复给药毒性研究技术指导原则[EB/OL]. (2015-10-11)[2019-03-21]. http://www.cde.org.cn/zdyz.do?method=largePage&id=192.
|
| [8] |
OECD. Guidance ICH S9 Q&As: Nonclinical Evaluation for Anticancer Pharmaceuticals Question and Answers: Current Step 4 Version[EB/OL]. (2016-08-27)[2019-03-21]. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Safety/S9/S9IWG_Document_Step4_QAs_CorrectedSecretariat_2018_0612.pdf.
|
| [9] |
Poon KA, Flagella K, Beyer J, et al. Preclinical Safety Profile of Trastuzumabemtansine(T-DM1):Mechanism of Action of its Cytotoxic Component Retained with Improved Tolerability[J]. Toxicol Appl Pharmacol, 2013, 273(2): 298-313. DOI:10.1016/j.taap.2013.09.003 |
| [10] |
Hock MB, Thudium KE, Carrasco-Triguero M, et al. Immunogenicity of Antibody Drug Conjugates:Bioanalytical Methods and Monitoring Strategy for a Novel Therapeutic Modality[J]. AAPS, 2015, 17(1): 335-343. |
| [11] |
Kamath AV, Lyer S. Preclinical Pharmacokinetic Considerations for the Development of Antibody Drug Conjugates[J]. Pharm Res, 2015, 32(11): 3470-3479. DOI:10.1007/s11095-014-1584-z |
| [12] |
Trail PA, Dubowchik GM, Lowinger TB. Antibody Drug Conjugates for Treatment of Breast Cancer:Novel Targets and Diverse Approaches in ADC Design[J]. Pharmacol Ther, 2018, 1(181): 126-142. |
| [13] |
Johmson MC, Scott CJ. Antibody Conjugated Nanoparticles as a Novel Form of Antibody Drug Conjugate Chemotherapy[J]. Drug Discov Today Technol, 2018, 12(30): 63-69. |
 2019, Vol. 33
2019, Vol. 33