羌活为我所承担的2018年国家中药材中药饮片抽检品种,现行标准为《中华人民共和国药典》2015年版一部。我所共收到抽检样品202批次,其中14批次样品标准检验不合格,并且14批次不合格样品中有部分批次样品性状颜色浅、香气弱、辛味弱、质地松泡,同时,羌活醇和异欧前胡素总量仅约为标准规定限度十分之一,怀疑此部分批次样品为提取过的药材残渣,因此,采用顶空气相色谱法对14批次不合格羌活饮片中甲醇、乙醇等13种溶剂残留[1-4]进行筛查研究,并进一步采用气质联用法进行验证。
1 溶剂残留初筛参照《国家药包材标准》 [5]YBB00312004-2015中“包装材料溶剂残留量测定法”进行甲醇等12种溶剂残留的筛查。
1.1 仪器与试药PE Clarus680气相色谱仪;BP-211D电子天平(赛多利斯)。
试样:1 4批次标准检验不合格羌活饮片(批号分别为171129、170401、170501、1641700601、170801、170617、151201、170501、170801、170301、170801、180301、180103、180101)、10批次标准检验合格羌活饮片(批号分别为20170101、171101、170318、20160701、CQ276171001、1705071、B703281、20170901、171013、1710101)。甲醇(色谱纯,德国Merck公司);正己烷(色谱纯,美国Sigma);丙酮、乙酸乙酯、丁酮、异丙醇、苯、甲苯、乙酸丁酯、乙苯、对二甲苯、间二甲苯、邻二甲苯(分析纯,国药集团化学试剂北京有限公司)。
1.2 供试品溶液的制备精密称取样品1 g,置顶空瓶中,压盖,密封,即得。
1.3 对照品溶液的制备分别取丙酮、乙酸乙酯、甲醇、丁酮、异丙醇、苯、甲苯、乙酸丁酯、乙苯、对二甲苯、间二甲苯、邻二甲苯12种有机试剂适量,加正己烷制成每1 mL含0.4 mg的溶液。分别吸取上述对照品溶液各5 μL,加正己烷10 μL,置于顶空瓶中,即得。
1.4 气相色谱条件HP-INNOWAX(60 m×0.32 mm×0.5 μm)毛细管色谱柱;FID检测器;柱温:起始50 ℃,保持5 min,再以10 ℃·min-1的速率升温至150 ℃;进样口温度200℃;检测器温度220 ℃;进样量1 μL;进样方式为分流进样,分流比10︰1;氢气40 mL·min-1,空气400 mL·min-1;顶空温度110 ℃,振摇60 min。
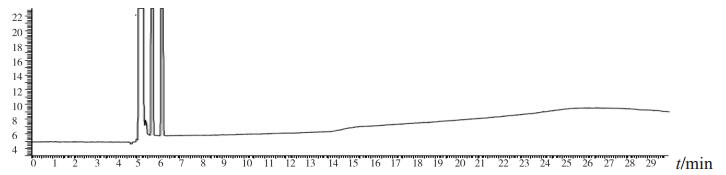
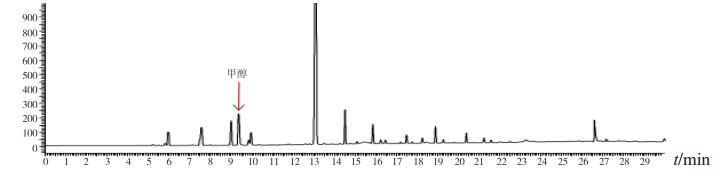
1.5 初筛结果3批次标准检验不合格样品(批号分别为170617、151201、170501)色谱图中,均出现与甲醇对照试剂保留时间相同的色谱峰,其余样品中均未出现与甲醇等12种有机溶剂保留时间一致的色谱峰(见图 1~3)。
|
图 1 正己烷空白溶剂 |

|
1.丙酮;2.乙酸乙酯;3.甲醇;4.丁酮;5.异丙醇;6.苯;7.甲苯;8.乙酸丁酯;9.乙苯;10.对二甲苯;11.间二甲苯;12.邻二甲苯。 图 2 12种有机溶剂气相色谱图 |
|
图 3 供试品(批号170501)气相色谱图 |
HP-INNOWAX(30 m×0.53 mm×1 μm)毛细管色谱柱;柱温:初始37 ℃,保持8 min;以5 ℃·min-1的速率升温至55 ℃,保持5 min;再以30 ℃·min-1的速率升温至220 ℃,保持10 min;进样口温度:230 ℃;检测器温度:250 ℃;分流比:20︰1,氢气40 mL·min-1,空气400 mL·min-1;顶空温度:80 ℃,振摇30 min。
2.2 仪器与试药岛津GC-2010Plus气相色谱仪、Agilent 6890N-5925B气质联用仪;MS-204S天平(METTLER TOLEDO)。14批次标准检验不合格羌活饮片;3批次符合规定的羌活样品(批号分别为180100171、18040301、20180401)。甲醇(色谱纯,德国Merck公司);乙醇(色谱纯,德国Merck公司);水为纯化水。
2.3 供试品溶液的制备 2.3.1 自制阳性样品的制备选取符合标准规定的3批样品(批号分别为180100171、18040301、20180401),进行模拟试验,各称取50 g,分别加甲醇300 mL,加热回流1 h,滤过,药渣置于阴凉处晾干,作为自制阳性样品。分别将3批自制阳性样品进行粉碎,各取1 g,精密称定,置顶空瓶中,立即密封,即得。
2.3.2 样品的制备精密称取各样品1 g,置顶空瓶中,压盖,密封,即得。
2.4 对照品溶液的制备取甲醇适量,加水制成每1 mL含1 mg的溶液;取乙醇适量,加水制成每1 mL含1 mg的溶液;分别精密吸取上述甲醇、乙醇对照试剂溶液2 mL,置于顶空瓶中,即得。
2.5 专属性考察取10批次标准检验合格的羌活样品,按照“2.1”节下色谱条件依法测定,结果表明:在甲醇对照试剂保留时间处,均无干扰,专属性良好。
2.6 耐用性使用岛津GC-2010Plus气相色谱仪,HPINNOWAX(30 m×0.53 mm×1μm)毛细管色谱柱和DM-5(30 m×0.32 mm×0.25 μm)毛细管色谱柱,均具有良好的分离度和塔板数,表明本方法耐用性良好。
2.7 检测限将甲醇对照试剂稀释1000倍,吸取2 mL置顶空瓶中,进样即得,结果方法检出限为1.656 μg·g-1。
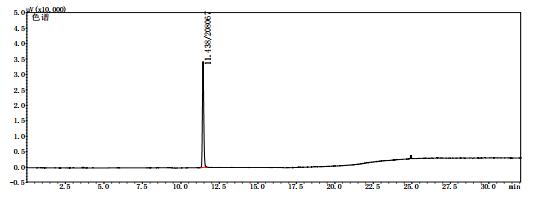
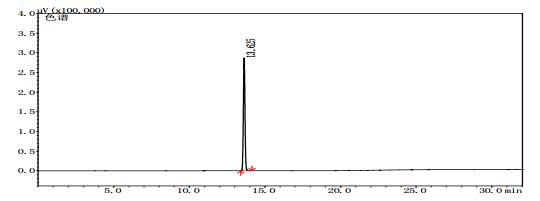
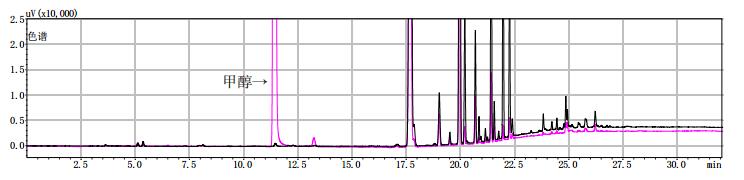
2.8 测定结果分别将甲醇对照试剂溶液、乙醇对照试剂溶液、3批自制阳性样品及14批次标准检验不合格羌活样品,按上述“2.1”色谱条件进行测定。结果:3批标准检验不合格样品(批号分别为170617、151201、170501)及3批自制阳性样品的气相色谱图中,均未出现与乙醇对照试剂保留时间一致的色谱峰,但均出现与甲醇对照试剂保留时间一致的色谱峰,且其他色谱峰(特别是保留时间段17~27 min)缺失严重(见图 4~11)。
|
图 4 甲醇对照试剂气相色谱图 |
|
图 5 乙醇对照试剂气相色谱图 |

|
图 6 疑似样品(批号170617)气相色谱图 |
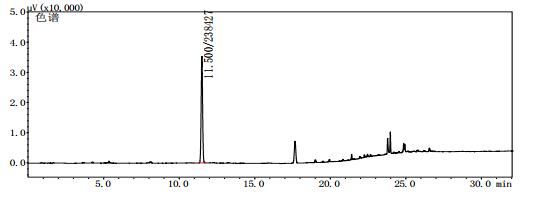
|
图 7 疑似样品(批号151201)气相色谱图 |
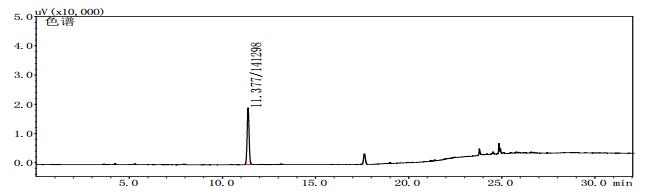
|
图 8 疑似样品(批号170501)气相色谱图 |
|
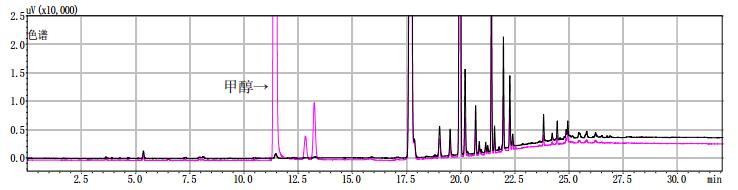
黑色为提取前,粉色为提取后。 图 9 样品(批号180100171)甲醇提取前后气相色谱图 |
|
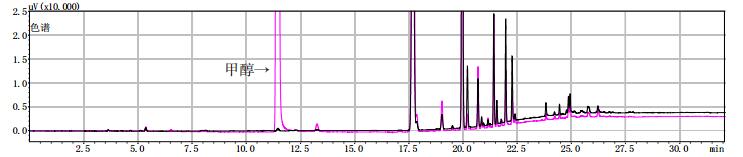
黑色为提取前,粉色为提取后。 图 10 样品(批号20180401)甲醇提取前后气相色谱图 |
|
黑色为提取前,粉色为提取后。 图 11 样品(批号18040301)甲醇提取前后气相色谱图 |
3批模拟阳性样品在甲醇提取前也出现与甲醇对照试剂保留时间一致的色谱峰,量值为50 μg·g-1,以此值作为限度。测定结果表明3批疑似样品检出的甲醇量与羌活自身检出的甲醇量(50 μg·g-1)相比从40倍到3980倍不等。
2.10 GC-MS确认 2.10.1 质谱条件Rtx-WAX MS(30 m×0.25 mm×0.25 μm)毛细管色谱柱;FID检测器;柱温为程序升温:初始37 ℃,保持8 min;以5 ℃·min-1的速率升温至55 ℃,保持5 min;再以30 ℃·min-1的速率升温至220 ℃,保持10 min;进样口温度:230 ℃;分流比:10︰1;顶空温度:80℃,振摇30 min。
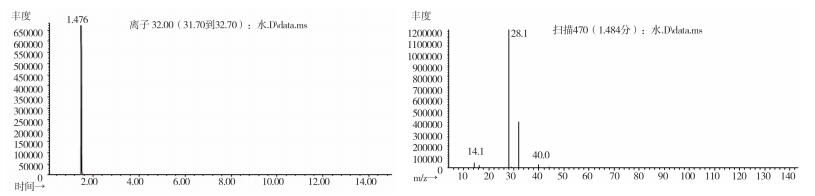
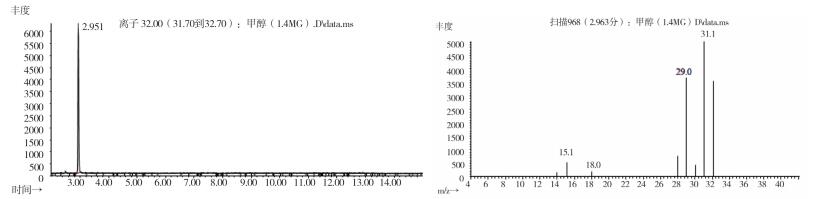
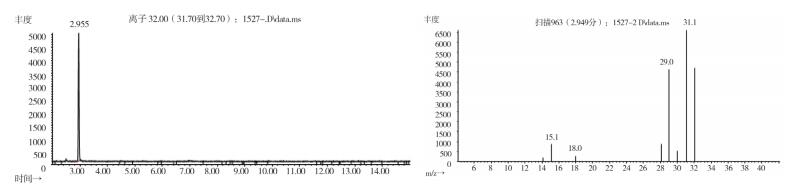
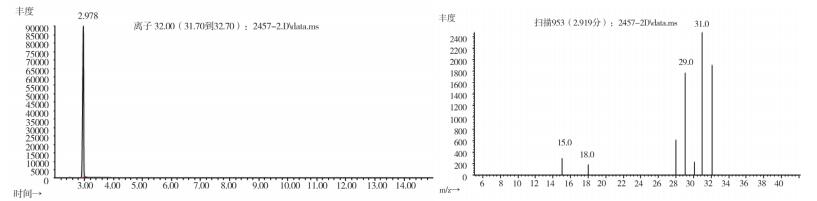
2.10.2 质谱确认结果取上述3批疑似检出甲醇样品(批号分别为170617、151201、170501)、3批模拟阳性样品,各1 g,置顶空瓶中,压盖,密封,按“2.10.1”质谱条件进行测定。结果:3批样品(批号分别为170617、151201、170501)、3批模拟阳性样品与甲醇对照试剂的总离子流色谱及一级质谱图一致(见图 12~19)。
|
图 12 空白溶剂气质色谱图 |
|
图 13 甲醇对照试剂气质色谱图 |
|
图 14 疑似样品(批号170617)气质色谱图 |
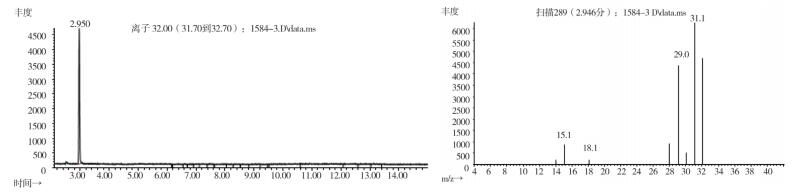
|
图 15 疑似样品(批号151201)气质色谱图 |
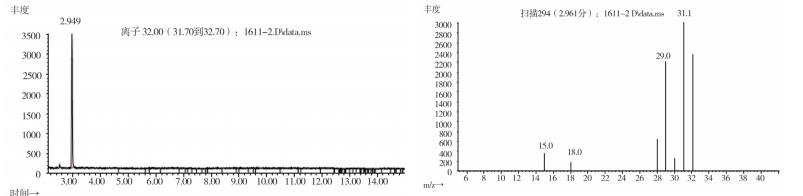
|
图 16 疑似样品(批号170501)气质色谱图 |
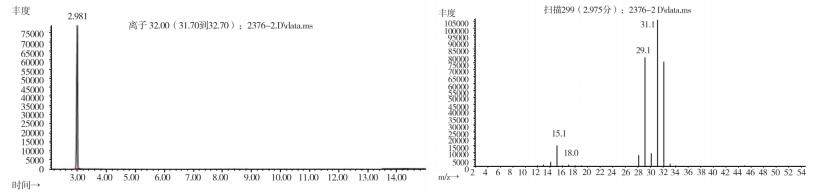
|
图 17 模拟阳性样品(批号180100171)气质色谱图 |
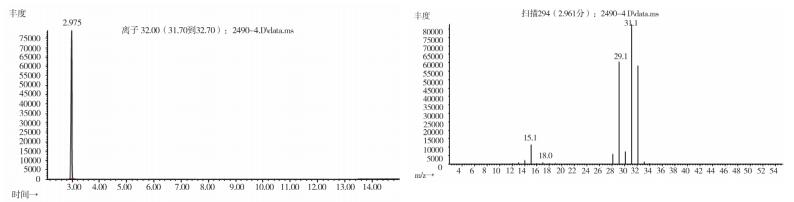
|
图 18 模拟阳性样品(批号18040301)气质色谱图 |
|
图 19 模拟阳性样品(批号20180401)气质色谱图 |
10批次标准检验合格的样品也出现与甲醇对照试剂保留时间一致的色谱峰,但量值很小(50 μg·g-1)。据有关学者考证,高等植物在正常的生长发育过程中,植物体内会产生甲醇、甲醛和甲酸[6-7],其中甲醇主要来源是果胶和木质素的脱甲基作用[8],此外,通过甲醛歧化作用或还原作用也可以产生甲醇[9]。甲醇除了部分从气孔中释放外,植物还能通过自身的甲醇代谢反应将剩余甲醇消耗掉,防止甲醇过度积累而影响正常的代谢活动[10]。虽然高等植物在正常代谢过程中可以通过自身代谢消耗掉部分甲醇,但是具体在植物中参与循环的甲醇比例还不清楚,可以肯定的是植物组织确实能够代谢甲醇。在新鲜叶片和种子中甲醇含量相对要高,在种子中最大能蓄积到90 μg·g-1[11]。
结合本次抽样环节和样品来看,并未有样品出现霉变或储存不当等其他情况而使其中甲醇含量急剧升高的现象,因此,基本可以排除是样品自身的原因导致甲醇含量升高。由于时间较紧,本次研究未建立羌活饮片中有机溶剂类成分的含量测定方法,但从测定结果来看,有部分批次样品中甲醇含量较高,并且参考《中华人民共和国药典》2015年版四部通则0861“残留溶剂测定法”中甲醇的限度为0.3%[12],3批样品中甲醇量的值远高于此限度,可能也存在有机溶剂提取并且未能完全去除有机溶剂的现象,应予以重视。在今后的工作中也要进一步建立相关含量测定方法,并增加相应的测定批次,以确定羌活中甲醇的来源情况。
3.2 检出甲醇量高的样品来源3批检出甲醇量高的样品被抽样单位分别是中医诊所和医药公司,而非标示生产企业。其中,标示同一生产企业同一批号的羌活样品有两批,一批被抽样单位标示为生产企业,标准检验是合格的;而另一批被抽样单位是医药公司,标准检验不合格并且检出甲醇量值很高。
3.3 溶剂残留筛查的意义药品中的残留溶剂是指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。当药材饮片中所含的残留溶剂水平高于安全值时,对人体或环境将产生危害,残留溶剂的检测已经越来越受到行业的重视。本文采用顶空气相色谱法对羌活饮片中的有机溶剂残留进行检测,并进一步采用气相质谱法进行了确认,检测结果表明有3批羌活样品出现与甲醇对照试剂保留时间一致的色谱峰,应予以重视。
| [1] |
吴春丽, 张俊霞, 史云涛, 等. 顶空毛细管气相色谱法测定来曲唑原料药中有机溶剂残留量[J]. 中国药房, 2010, 21(17): 1601-1603. |
| [2] |
田文桥, 李少茹, 王静怡, 等. 顶空气相色谱法测定新药五味子乙素中有机溶剂的残留量[J]. 西北药学杂志, 2015, 28(5): 441-443. |
| [3] |
曹玉. 顶空进样毛细管气相色谱法测定盐酸普拉克索中的残留溶剂[J]. 中国当代医药, 2015, 22(35): 7-10. |
| [4] |
刘薇芝, 胡汉昆, 刘萍, 等. 顶空毛细管气相色谱法测定硝酸异康唑中5种有机溶剂残留[J]. 中国医院药学杂志, 2016, 36(1): 9-12. |
| [5] |
YBB00312004-2015包装材料溶剂残留量测定法[S].国家药包材标准, 2015: 287-288.
|
| [6] |
徐迪, 陈丽梅, 年红娟, 等. 高等植物中一碳化合物代谢研究进展[J]. 西北植物学报, 2009, 29(6): 1284-1289. DOI:10.3321/j.issn:1000-4025.2009.06.035 |
| [7] |
卫培培, 於丙军. 甲醇对植物的作用及其生理机制[J]. 西北植物学报, 2014, 34(2): 416-422. |
| [8] |
FALLR, BENSON A A. Leaf Methanol-the Simplest Natural Product from Plants[J]. Trends in Plant Science, 2006, 1(9): 296-301. |
| [9] |
MASON R P, SANDERS JEREMY K M, GIDLE Y M J. NMR Visualization of Free Asparagine in Potato Tissue Using Adduct Formation with[13C] Formaldehyde[J]. Phytochemistry, 2005, 25(7): 1567-1571. |
| [10] |
NEMECEK-MARSHA LL M, MACDONALD R C, Franzen J J, et al. Methanol Emission from Leaves (Enzymatic Detection of Gas-phase Methanol and Relation of Methanol Fluxes to Stomatal Conductance and Leaf Development)[J]. Plant Physiol, 1995, 108(4): 1359-1368. DOI:10.1104/pp.108.4.1359 |
| [11] |
RALPH L. OBENDORF5, JAMES L. KOCH2, RYSZARD J GORECKI3, et al. Ethanol Accumulation in Maturing Seeds[J]. Journal of Experimental Botany, 1990, 41(225): 489-495. https://www.researchgate.net/publication/31390653_Methanol_Accumulation_in_Maturing_Seeds
|
| [12] |
中华人民共和国药典: 一部[S]. 2015: 105-107.
|
 2019, Vol. 33
2019, Vol. 33 
 ,
,