近年来,眼用给药系统在药学领域有着广阔的发展前景,眼用注射剂在临床的应用也日益广泛。临床常用的药物包括:单克隆抗体类(以下简称“单抗类”)的抗新生血管内皮因子类药物,代表药物有雷珠单抗注射液(Ranibizumab)和贝伐单抗注射液(Bevaizumab),以及受体融合蛋白类的抗新生血管内皮因子类药物,代表药物有康柏西普眼用注射液(Conbercept)和阿柏西普眼内注射液(Aflibercept)。而在关注临床有效性的同时,药物安全性也备受关注。因此,眼用注射剂的质量标准也逐渐受到医药研究工作者的重视。本文通过对比国内外各版药典以及在中国学术期刊全文数据库(CNKI)、万方数据库及pubmed数据库中检索2008-2017年近10年内的眼用注射剂质量标准相关研究文献,对眼用注射剂相关质量标准及临床应用安全性进行了分析和总结。
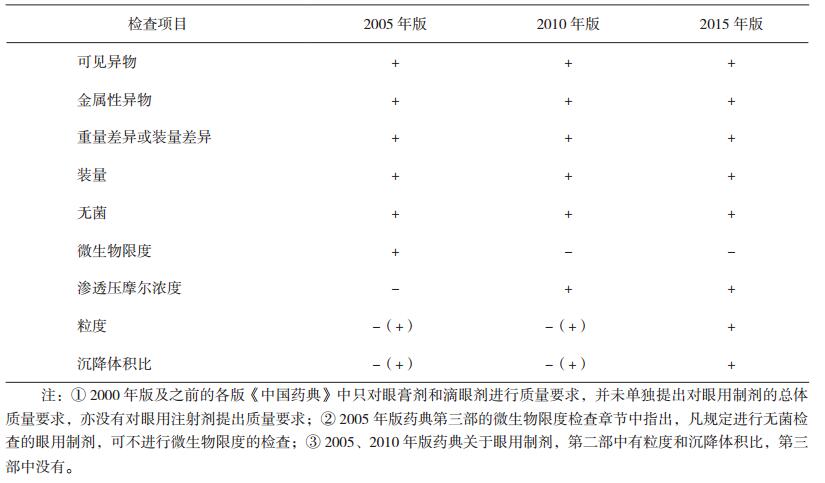
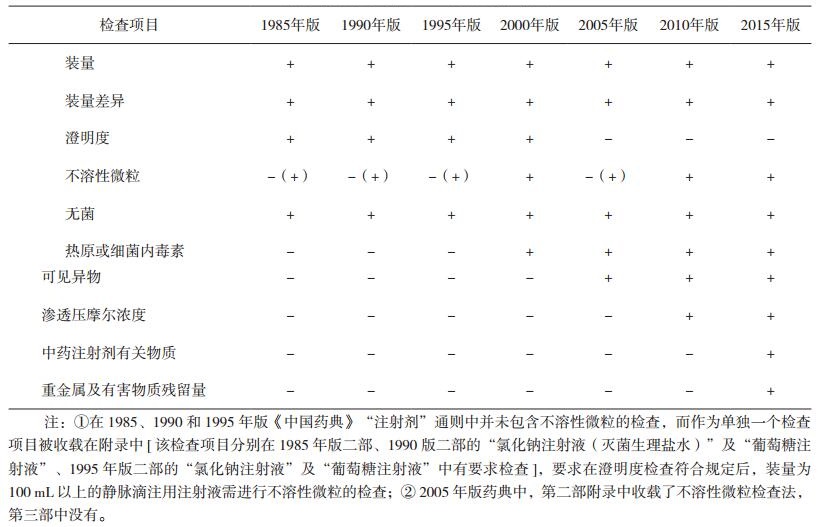
1 《中国药典》关于眼用制剂和注射剂的相关质量标准2015年版《中华人民共和国药典》(以下简称《中国药典》)[1]中,眼用制剂系指用于眼部发挥治疗作用的无菌制剂,它包括眼用液体制剂、眼用半固体制剂以及眼用固体制剂。其中,眼内注射溶液(即眼内注射剂)系指由原料药与适宜辅料制成的无菌液体,供眼周围组织(包括球结膜下、筋膜下及球后)或眼内注射(包括前房注射、前房冲洗、玻璃体内注射、玻璃体内灌注等)的无菌眼用液体制剂。目前,由于眼内注射剂的使用范围有限、种类较少等多方面原因,我国药典还未对其作出单独的质量标准要求。眼用注射剂既属于眼用制剂,又属于局部给药的注射剂,故首先对我国各版药典关于眼用制剂(见表 1)和注射剂(见表 2)的质量标准做一比较和汇总。
从表中数据可见,我国药典对眼用制剂及注射剂的质量标准都在不断提高,但是,目前还没有对眼用制剂提出单独的不溶性微粒质量标准,只能参照静脉注射剂的标准。两表的检查项目差异主要在于不溶性微粒、沉降体积比、中药注射剂有关物质及重金属及有害物质残留量的检查。随着近年临床应用中的不良事件发生和对临床安全风险认识的不断提升,新增了中药注射剂有关物质、重金属及有害物质残留量的检查,不溶性微粒的检测标准也越来越严格。眼用注射剂因其特殊的给药途径,使得无菌及不溶性微粒数量的限度成为影响其质量标准的关键内容之一。
2 国内外药典相关质量标准变化的比较 2.1 无菌检查无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法[1]。我国药典从第一版(1953年版)起就收载了无菌检查法,注射剂始终要求进行无菌检查,而自2005年版起对眼用制剂单独提出质量要求后,也明确提出需进行无菌检查。各版《中国药典》中对无菌检查要求的变迁[1-9]详见表 3。
|
|
表 3 各版《中国药典》中的无菌检查法 |
眼用制剂作为直接用于眼部而发挥治疗作用的制剂,无菌要求是其重要的质量和安全性要求之一。近年来,相继有报道眼用护理液发生的一系列染菌事件,给我们敲响了警钟,保证眼用制剂达到无菌要求,确保患者用药安全,是药师必须高度关注的问题[10]。除了严格控制好药品质量外,还应不断提高其质量标准,从根本上保障用药的临床安全性。
2.2 不溶性微粒检查不溶性微粒系指药物在生产或应用中经过各种途径污染的微小颗粒杂质,其粒径在1~50μm,是肉眼不可见、易动性的非代谢性有害粒子。目前,《中国药典》中[1]的不溶性微粒检测方法有两种,分别为光阻法(Light Obscuration Particles Count Test)和显微计数法(Microscopic Particles Count Test)。
不溶性微粒是一个对安全性很有意义的指标,同时也是药品生产放行的指标之一,因为其作为一种可流动的无法被循环代谢的外源性物质,进入人体后可通过刺激血管内壁,引起静脉血管光滑度改变,导致血小板黏附,从而引起静脉炎;较大的微粒可直接造成局部循环障碍,引起血管栓塞或导致肉芽肿;微粒引起的肉芽肿脱落后随血运行,也可引起血管栓塞,导致血管堵塞、供血不足、血栓、局部组织坏死等疾病,长期大量存在,对心、肺、肝、肾等器官均有严重危害,严重时可能导致患者死亡[11-12]。随着注射液中不溶性微粒造成危害的相关报道急剧增多,各国便相继制定了注射剂的微粒限制标准,对注射剂中微粒含量和粒径提出了要求[13]。
2.2.1 不溶性微粒与眼用制剂的安全性从临床具体使用情况看,眼科制剂作为一种局部使用药物制剂,由于其使用部位自身的生理、解剖特性,其对微粒的耐受性可能更差。曾有文献报道,皮质激素局部注射在眼科使用导致严重的眼部并发症(如视网膜中央动脉闭塞)事件,分析认为这主要与皮质激素微粒堵塞视网膜中央动脉有关,随着药液中超过20μm微粒数量增加,发生血管闭塞的可能性也会增加[14]。
2.2.2 《中国药典》对不溶性微粒检查要求的变迁自1985年开始,不溶性微粒作为判断药品质量的标准之一,被收录于《中国药典》的附录中。此后,较为突出的更新有1990年将微粒的限制标准从“每1 mL中含10μm以上的微粒不得超过50粒, 含25μm以上的微粒不得超过5粒”分别提高至20粒和2粒,以进一步提高注射剂的药品质量;随着检测技术的不断改进,2000年在原显微计数法的基础上增加了光阻法作为检测方法之一,但结果判断标准仍采用了显微计数法的结果;直至2005年版药典,药典委员会在广泛吸取国内外先进技术和实验方法的基础上,将药典附录内容与当前国际药品质量控制的方法、技术保持了基本一致,小剂量注射剂不溶性微粒的限制标准也在该版中得以提出,顺应了临床的呼声从药品质量标准控制上保障了药品的安全性(见表 4)。
2.2.3 国内外不溶性微粒质量标准的差异目前,我国药典在注射剂不溶性微粒的限制方面已与国际接轨,采用了和美国药典(the United States Pharmacopeia,USP)、欧洲药典(European Pharmacopeia,EP)、英国药典(British Pharmacopeia,BP)以及日本药局方(Japanese Pharmacopoeia,JP)一致的限制标准(见表 5)。但是,对于眼用注射剂中的不溶性微粒,我国药典并未做出具体的限度要求,而美国药典和日本药局方则对眼用注射剂中的不溶性微粒限度做出了具体规定(见表 6),并且美国药典中对于眼用注射剂的不溶性微粒限制标准明显严于小容量静脉注射剂的标准。
3 《中国药典》关于单抗类注射剂与普通注射剂质量标准的异同
目前,单抗类的抗新生血管内皮因子类药物(如雷珠单抗注射液、贝伐单抗注射液)是临床常用的眼用注射剂之一。人用重组单克隆抗体制品,系指采用各种单克隆抗体筛选技术、重组DNA技术及细胞培养技术制备的单克隆抗体治疗药物。比较2015年版《中国药典》 [1]关于单抗类注射剂与普通注射剂的质量标准,二者在理化性质方面的检查内容及标准大体相同,均需按照药典相应通则的方法及要求检定相关内容(见表 7),不同之处在于单抗类制品还需进行“异常毒性检查”,普通注射剂若为中药注射剂还需进行“中药注射剂有关物质”和“重金属及有害元素残留量”的检查。此外,二者的主要不同之处在于单抗类注射剂具有生物制品的特性,因此,在完成普通注射剂相关理化检查外,还需要应用生物学和(或)免疫学等方法完成鉴别与一致性分析、纯度与杂质、制品相关杂质、工艺相关杂质以及效价等项目的检定。
|
|
表 7 2015年版《中国药典》关于单克隆抗体制品的部分质量标准 |
近年来,我国对于眼用制剂和注射剂的质量标准一直在不断地提高和完善。目前,对于静脉注射剂不溶性微粒的标准已与美国、欧洲等药典保持一致,但对于特定部位使用的特殊制剂(如眼用注射剂)的相关质量标准还不够完善。建议借鉴国外的相关质量要求,提高特定部位制剂不溶性微粒的标准;同时,建议加强对特定药物(如中草药、生物制品等)中不溶性微粒的检测,以提高临床用药的安全性。建议国家标准能在上述方面作进一步的完善,以提高我国药品质量,保障临床用药的安全性。
| [1] |
中华人民共和国药典: 三部[S]. 2015: 通则8-10, 12-13, 40-42, 76-80, 总论41-44.
|
| [2] |
中华人民共和国药典: 三部[S]. 2005: 附录5-7, 61-63, 73-75.
|
| [3] |
中华人民共和国药典: 三部[S]. 2010: 附录5-7, 31-33, 89-92.
|
| [4] |
中华人民共和国药典: 二部[S]. 1985: 附录4-5, 44-45, 89-92.
|
| [5] |
中华人民共和国药典: 二部[S]. 1990: 附录5-7, 59, 109-111.
|
| [6] |
中华人民共和国药典: 二部[S]. 1995: 附录3-5, 62-63, 79-82.
|
| [7] |
中华人民共和国药典: 二部[S]. 2000: 附录6-7, 69-70, 89-92.
|
| [8] |
中华人民共和国药典[S]. 1953: 附录42-43.
|
| [9] |
中华人民共和国药典: 二部[S]. 1963: 附录61-65.
|
| [10] |
宁黎丽, 邵颖. 对眼用制剂无菌要求和灭菌工艺的思考[J]. 中国新药杂志, 2008, 17(9): 800-802. DOI:10.3321/j.issn:1003-3734.2008.09.023 |
| [11] |
饶友义, 王宇, 马庆阳. 静脉给药不良事件常见原因及防治[J]. 中国药房, 2014, 25(2): 168-171. |
| [12] |
马一星, 王成刚, 李文东. 国产氟康唑氯化钠注射液的不溶性微粒考察[J]. 药品评价, 2015, 12(8): 27-30. DOI:10.3969/j.issn.1672-2809.2015.08.012 |
| [13] |
张秀娟, 林峰, 贾晶, 等. 冠脉支架产品的不溶性微粒评价[J]. 中国医疗器械杂志, 2014, 38(2): 126-129. DOI:10.3969/j.issn.1671-7104.2014.02.013 |
| [14] |
Francis BA, Chang EL, Haik BG. Particle Size and Drug Interactions of Injectable Corticosteroids Used in Ophthalmic Practice[J]. Ophthalmology, 1996, 103(11): 1884-1888. DOI:10.1016/S0161-6420(96)30411-9 |
| [15] |
US.P: VolⅠ[S]. 2013: 350-353.
|
| [16] |
Eur.p: VolⅠ[S]. 2014: 321-323.
|
| [17] |
B.P: VolⅤ[S]. 2013: AppendixⅫ.
|
| [18] |
J.P[S]. 2012: 131-133, 134-135.
|
 2019, Vol. 33
2019, Vol. 33