2. 江西省药品检验检测研究院, 南昌 330029
2. Jiangxi Institute for Drug Control, Nanchang 330029, China
元素杂质包括可能存在于原料药、辅料或制剂中的催化剂和环境污染物,主要是指药品生产或贮藏过程中生成、加入或无意引入的物质[1]。由于某些元素杂质具有毒性,而且还可能对药品的稳定性、保质期产生不利影响,或可能引发有害的副作用[2],故世界各国药品监管机构对药品元素杂质的控制越来越严格。本文对国际人用药品注册技术协调会(ICH)、美国药典(USP)、欧洲药典(EP)和《中华人民共和国药典》(以下简称《中国药典》)中收载的元素杂质有关通则和指导原则的增修订历程进行梳理,旨为制定2020年版《中国药典》四部元素杂质相关控制要求的通则及指导原则提供借鉴和参考。
1 欧美药典元素杂质限度及测定通则和指导原则的增修订背景早期的各国药典,如USP、EP和《中国药典》,对元素杂质的控制主要是针对重金属和部分无机杂质,检测方法主要包括重金属试验、炽灼残渣、硫化物和砷盐检查以及其他的化学检查法。其中,重金属检查法早在《中国药典》1953年版就已收载,后几经修改完善,使这一方法广泛应用于药品中以铅为代表的重金属元素杂质的控制。该方法主要是控制能形成硫化物沉淀的金属元素,如铅、铜和其他金属,这些元素杂质是管道、制药设备、工艺和其他常见来源的潜在污染物。
随着药品生产过程中催化剂和试剂的应用日益广泛,近年来,元素污染的风险因素发生了巨大变化,但其控制标准在几十年内几乎没有变化。现有药典中的检测方法不是针对低水平金属催化剂和试剂的残留设计的,专属性、灵敏度低,不能对单个元素杂质进行定量分析[2-3],已不能满足药品安全性控制的需要。同时,药典中提供的可接受限度是基于历史数据,并不一定基于合适的安全性数据。通常,利用药典重金属检查法检测出的金属种类是有限的,并不包括有安全风险的其他金属杂质[3]。因此,为了保障公众健康安全,建立较重金属检查法更科学的元素杂质限度和测定指导原则,对已明确毒理学问题的元素杂质进行更精确的控制尤为重要。基于以上考虑,ICH提出Q3D元素杂质指导原则,并于2014年11月发布。Q3D适用于原料药和制剂,采用基于风险的方法对元素杂质进行评估,对在改变合成工艺步骤、引入在线或上游控制、原料药和辅料以及容器密闭系统等药品全生命周期内存在的元素杂质进行控制。在此基础上,欧美药典陆续出台一系列通则或指导原则对元素杂质进行控制,历经多次修订完善,目前,元素杂质的种类和限度基本上和ICH保持一致。
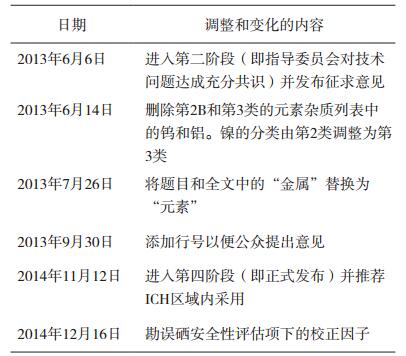
2 ICH Q3D指导原则的增修订历程2009年10月,ICHx批准制定Q3D金属杂质指导原则[4],旨为药品中的金属杂质定性和定量控制提供全球性政策。ICH指导原则须经过四个阶段方可公布,在最后第五阶段被ICH区域内的各国药品监管部门采纳。2013年7月,ICH将Q3D指导原则的题目由“金属杂质指导原则”修改为“元素杂质指导原则”。2014年12月,ICH发布了Q3D第四阶段正式文件,其历史进程中的主要节点见表 1[4]。Q3D指导原则分为三个部分:评估潜在元素杂质的毒性数据,确定每一种有毒元素的每日允许暴露量(PDE),以及运用ICH Q9[5]质量风险管理指导原则来评估和控制药品中的元素杂质[3, 6]。Q3D的出台,有利于帮助企业通过风险评估来判断对哪些元素进行额外控制,为药品制订合理的元素限度[6]。Q3D中未规定元素杂质的检测方法,药品注册申请人可参考ICH Q2分析方法验证指导原则采用任何经验证的检测方法[7-11]。
|
|
表 1 ICH Q3D历史进程的主要节点[4] |
USP于2008年开始启动元素杂质新标准和方法的制订,组建了由美国国家科学院医学研究所(IOM)专家组成的工作小组[2]。USP根据工业界、学术界、政府实验室、FDA、国际药品监管机构、毒理学专家委员会的意见反馈等制定新标准和方法[12],于USP 35第二增补版中增订了通则<232>元素杂质-限度、<233>元素杂质-方法,对药品中常见的元素限度及测定方法做了相应规定,将取代通则USP<231>重金属检查法,于2014年5月1日正式执行[13],<231>重金属检查法自2018年1月1日不再执行。通则<232>中明确要求测定各元素杂质含量而不是总量,即由半定量转为定量控制,并规定了15种元素杂质的PDE值及原料药和辅料中元素杂质的限量值。通则<233>收载了两种元素现代分析仪器检测方法,即电感耦合等离子体原子发射光谱法(ICP-AES或ICP-OES)和电感耦合等离子体质谱法(ICP-MS),可大大提高杂质检出能力[3]。通则<233>中规定,检测方法的选择包括样品的配制以及仪器参数的调整,使用者可以在方法验证的基础上对其进行调整。采用USP收载的方法检测元素杂质被FDA批准的可能性较大,但FDA不强制要求使用<233>中的方法,也接受企业根据自身产品自行开发的经验证的分析方法,比如检测成本相对较低的火焰原子吸收光谱法(FAAS)和石墨炉原子吸收光谱法(GFAAS)。方法学的验证可以参考ICH Q2[14]或FDA发布的分析程序和方法验证指南[15]。
在USP 35第二增补版中提及的15种元素杂质是以ICH Q3D元素杂质指导原则第二阶段草案为依据的[14]。由于USP和ICH的工作进程不同,两者在不同时期内容不尽一致,相关规定有所差异。与USP 35第二增补版相比,ICH Q3D涉及的元素杂质种类更多,有9种元素(钴、铊、金、硒、银、锂、锑、钡、锡)在USP中没有规定限度。因此,在2017年12月后,USP修订了通则<232>中的元素杂质种类和限度,与ICH规定保持一致,并规定在2018年1月1日之后,针对USP品种,提交改良型新药申请(NDA)、仿制药的申请(ANDA)应符合USP通则<232>、<233>。针对非USP品种,申请人提交新的NDA、ANDA时,应该遵循ICH Q3D。USP对元素杂质控制的增修订历程见表 2[16]。
|
|
表 2 USP元素杂质相关控制要求的增修订历程 |
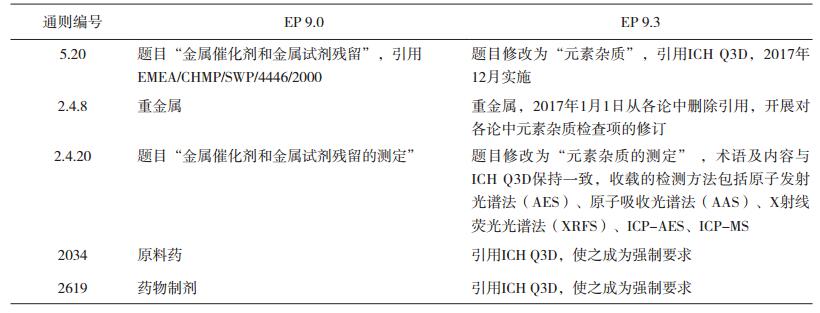
2014年6月,欧洲药典委员会第149次会议上,为保证核发上市许可的一致性,欧洲药品质量管理局(EDQM)制订了对EP重金属通则的修订策略,通则5.20金属催化剂和金属试剂残留作为修订的第一步,一旦ICH Q3D指导原则在欧盟进入第五阶段,则采用Q3D取代现有通则5.20的相关内容。2014年7月18日,EDQM宣布了其元素杂质实施策略及ICH Q3D指导原则的实施计划[17]。2014年9月,ICH Q3D第四阶段终稿签字生效并在其网站上公布后,几周内EDQM人用药品委员会(CHMP)设定了ICH Q3D在欧盟的实施日期,新注册申请须于2016年7月执行,所有已在欧盟上市的制剂于2017年12月执行。2015年3月,欧洲药典委员会第151次会议上,针对EP中受到ICH Q3D影响的内容批准了更详细的策略[17]。一是从各论中删除通则2.4.8重金属检查法的引用,由于所需修订的各论较多,从所有各论中删除的最终日期统一在EP 9.0版(生效时间为2017年1月1日)。值得注意的是,在各论中没有列入重金属检查项并不意味着企业不需控制产品中的元素杂质水平。二是对于EP中已有的ICH Q3D 1类、2A类、2B类和3类单个元素杂质的检测将由相关的专家组进行逐个评估。除另有规定外,EDQM建议一旦ICH Q3D生效,原有EP各论中单个元素杂质的检测项将删除。相反的,对于没有建立PDE限度的元素(例如铝和铁,即在ICH Q3D中被认为是“其它元素”的元素杂质),EP建议在各论中制定不同的检测方法。三是通则5.20金属催化剂和金属试剂残留,目前全文收载了EMA发布的金属催化剂或金属试剂残留限度指南(EMEA/CHMP/SWP/4446/2000)[1],规定了14种金属催化剂和金属试剂的限度(铱、锇、鈀、铂、銠、钌、钼、镍、钒、铬、铜、锰、锌、铁),除铱、锇、鈀、铂、銠、钌这6种元素的口服和注射限度与ICH Q3D一致外,其他元素限度均严于ICH。同时规定了原料药供应商应在元素残留声明中说明使用了哪些元素、元素的类别、检测结果小于口服或注射制剂的PDE等要求。此次修订后,通则5.20将不会再引用此指南,而是被替换为ICH Q3D的内容在EP 9.3版中公布,实施日期为2018年1月1日。
从EP 9.3版开始,对各元素杂质的种类和限度要求均遵循了ICH Q3D[17]。9.3版前,通则2.4.20金属催化剂和金属试剂残留检测,为金属杂质方法的开发例如样品制备和方法验证等提供了指导;自9.3版起,通则2.4.20题目名称修改为元素杂质测定,其术语和内容与ICH Q3D指导原则保持一致[17-18]。通则5.20金属催化剂或金属试剂残留也被ICH Q3D指导原则的内容所替代,题目修改为元素杂质,内容概述了其在EP中的应用[18]。按照EP的执行规定,尽管通则5.20照搬了Q3D,但只要在EP各论中没有引用,则该通则并非强制要求。因此,EP 9.3版对通论2034原料药和2619药物制剂进行了修订,并引用通则5.20,这使得ICH Q3D成为强制性法规,成为所有该通论适用的药品必须满足的条件[17-18]。为了避免因在原料药各论中删除某些元素杂质检查项而引起的误解,通论2619药物制剂增加了“无论产品是否属于ICH Q3D的适用范围,制定元素杂质的控制策略和证明上市许可文件中所用的分析方法的适用性是制药厂商的职责[19]”一句话,这表明对于不在5.20范围内的原料药和药物制剂(例如中草药和放射性药品等),企业也应遵循ICH Q3D或ICH Q9指导原则中的条款,针对这些杂质限度进行风险评估,必要时采用经过验证的分析方法测定。通则2.4.8重金属检查法已从原料药各论引用中删除,此后企业将选择适当的元素分析策略,使其符合ICH Q3D的要求。
EP下一步将对各论中的元素杂质检查项进行修订,以阐明对原料药元素杂质控制的期望(见表 3)。
|
|
表 3 EP元素杂质相关控制要求的增修订历程 |
USP和EP对元素杂质限度和测定的要求,极大地提高了药品中元素杂质的检出能力,这对于患者来说是巨大的利好。但对于企业或者说整个医药行业而言,将面临一次广泛的产业升级。尽管采用USP、EP中的元素杂质测定方法能降低注册申请不被批准的风险,但需购买昂贵的仪器,仪器总运行成本较高,企业将不得不投入巨资对其检测分析方法进行升级,以符合新法规的要求[3]。此外,对于元素杂质是否需要如此严格的控制在工业界也有争论:一是在食物中摄入的元素杂质可能超过药物中含量的若干倍,是否有必要在药品中进行如此严格的控制;二是目前Q3D的适用范围多在美国、欧盟和日本,但大量原料药和辅料的供应商均在这3个地区之外,是否需要将Q3D的控制范围进行延伸;三是如果在较大的范围内进行控制,则成本可能上升,其风险与获益比是否合理[3]。尽管有如此多的顾虑,美国和欧盟还是坚定地推行了Q3D,并制定了实施时刻表。
5.2 实施元素杂质相关控制要求的策略及时机ICH Q3D历经不断地修订完善,形成了目前被世界主流药典基本认可的元素杂质控制指导原则。在ICH Q3D指导原则第四阶段文件发布后,USP与EP对实施元素杂质控制要求的策略相似,即首先声明实施Q3D,接着制订适用于本地区的合适的元素杂质限度和通用测定法通则和指导原则,然后删除原有重金属检查法在各论品种中的引用,最后制定品种项下单个元素杂质的限度及检测方法,使元素杂质控制要求得到了有力贯彻。从USP和EP对元素杂质相关控制要求的修订历程可知,修订都启动于ICH第四阶段前或讨论进程中,此时的ICH指导原则相对成熟,之后的变化较小,可避免由于法规频繁调整给工业界带来的不必要麻烦。但值得注意的是,若ICH Q3D第四阶段的接受和公布延迟,将会影响ICH区域内药典的修订推迟[20]。所以,应随时关注ICH指导原则的修订进展,尽早掌握第四阶段发布稿与前阶段草案稿的区别,使工业界有充分时间做好技术和资源方面的投资准备。
5.3 《中国药典》增订元素杂质限度和测定指导原则目前在元素杂质相关控制要求方面,《中国药典》与USP和EP有较为明显的差距。2015年版《中国药典》未收载针对元素杂质控制的相关通则及指导原则,仅在四部收载了通则0821重金属检查法,利用金属杂质与硫代乙酰胺或硫化钠作用显色的原理,与标准铅在相同条件下的反应结果进行对比。此外,针对砷毒性大的特性,对砷元素的控制采用通则0822砷盐检查法[21]。上述显色测定总量的方法已显得较为落后。2018年我国已成为ICH正式成员国和管委会成员,为加快推进ICH相关要求在我国的实施进程,在参考ICH Q3D指导原则及USP、EP实施策略的基础上,结合我国国情制定《中国药典》元素杂质限度和测定指导原则,提高我国药品中元素杂质控制水平和保障患者用药安全势在必行。对于制定该指导原则的研究方法,笔者给出如下建议:一是选择不同的原料药、辅料及制剂,建立前处理方法,应用ICP-AES、ICP-MS等多种仪器进行元素杂质的检测并对结果进行分析,同时与目前现行的重金属检查法进行比较;二是参照ICH Q3D建立合适的元素杂质检测方法,并进行方法学验证,同时选择适宜的药品进行检测,对所建立的检测方法进行稳定性、适用性及通用性的考察;三是参考ICH Q3D、USP和EP的元素杂质指导原则,对各元素杂质进行分类并制定出各元素杂质在原辅料及制剂中的限度。
USP<233>收载了ICP-AES(或ICP-OES)和ICP-MS两种元素杂质检测方法,EP 2.4.20收载了原子发射光谱法(AES)、原子吸收光谱法(AAS)、X射线荧光光谱法(XRFS)、ICPAES、ICP-MS五种元素杂质检测方法。ICH Q3D中虽然没有指定具体的检测方法,但明确指出:除另有规定外,应使用对每个元素具有专属性的方法来控制。2015年版《中国药典》四部通则中已收载了AAS、ICP-AES(或ICP-OES)、ICP-MS法等,这些方法各具有不同的特点和适用性,应结合药品的特性,待测元素的种类、含量(或浓度)水平和实验室的仪器设备条件,以及是限量控制还是定量分析等不同目的,选择其中之一或多种方法组合的方式作为测定解决方案。
ICH Q3D中的元素杂质评估和控制方法、控制阈值等相关内容,超出了药典各论、通则通常的收载范围,如USP 41版通则<232>元素杂质-限度、<233>元素杂质-方法未将上述内容列入。但由于它们可为执行元素杂质限度标准提供背景、原因和策略等信息,因此,若作为《中国药典》指导原则收载也可考虑对上述内容作适当阐述。
| [1] |
European Medicines Agency. EMEA/CHMP/SWP/4446/2000 Guideline on the Specification Limits for Residues of Metal Catalysts or Metal Reagents[EB/OL].(2008-08-01)[2017-04-29]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003586.pdf.
|
| [2] |
张慧敏, 余灵芝, 陈旭, 等. 《美国药典》新通则<232>和<233>元素杂质控制新标准和方法介绍及其对医药界的影响[J]. 中国药房, 2014, 25(17): 1601-1604. DOI:10.6039/j.issn.1001-0408.2014.17.21 |
| [3] |
王旸, 李眉. 药监机构对金属杂质控制的演变[J]. 中国新药杂志, 2016, 25(18): 2094-2098. |
| [4] |
ICH. Guideline for Elemental Impurities Q3D[EB/OL]. (2014-12-16)[2019-02-03]. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3D/Q3D_Step_4.pdf.
|
| [5] |
ICH. Quality Risk Management Q9[EB/OL].(2005-11-09)[2019-02-03]. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q9/Step4/Q9_Guideline.pdf.
|
| [6] |
姜小林, 董素萍, 舒靖能. ICH Q3D新药制剂元素杂质评估及控制的要点解读[J]. 中国药事, 2017, 31(8): 854-860. |
| [7] |
ICH. Validation of Analytical Procedures: Text and Methodology[EB/OL].(2015-11)[2019-02-03]. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q2_R1/Step4/Q2_R1__Guideline.pdf.
|
| [8] |
梅丽, 叶晓霞, 曾祥程, 等. 吸入气雾剂中元素杂质的电感耦合等离子体串联质谱法测定[J]. 中国医药工业杂志, 2015, 46(5): 502-507. |
| [9] |
王梅, 郑晖. 布洛芬原料药中残留有机溶剂和微量金属杂质的检测研究[J]. 药物分析杂志, 2012, 32(7): 1209-1213. |
| [10] |
陈阳, 杨永健. 化学原料药中19种金属杂质的检测研究[J]. 药物分析杂志, 2012, 32(4): 631-635. |
| [11] |
陈阳, 金薇, 杨永健. 电感耦合等离子体发射光谱法在国内药物分析中的应用现状[J]. 药物分析杂志, 2013, 33(6): 907-914. |
| [12] |
U.S. Pharmacopeial Convention. Workshop on Metals in Pharmaceuticals and Dietary Supplements[EB/OL]. (2009-04)[2019-02-03]. http://120.52.51.18/www.usp.org/sites/default/files/usp/document/our-work/chemicalmedicines/key-issues/2009-04-29-MetalImpuritiesSlides.pdf.
|
| [13] |
U.S. Pharmacopeial Convention. Postponed the Official Dates of <232> Elemental Impurities-limits and <233> Elemental Impurities-procedures[EB/OL].(2012-11-15)[2013-03-25]. http://www.usp.org/usp-nf/officialtext/revision-bulletins/elemental-impurities-limits-andelementalimpurities-procedures.
|
| [14] |
Cross A. Elemental Impurity Analysis[J]. Pharm Technol, 2012, 36(8): 62-64. |
| [15] |
R.N. Rao, M.V.N. K. Talluri. An Overview of Recent Applications of Inductively Coupled Plasma-mass Spectrometry(ICP-MS)in Determination of Inorganic Impurities in Drugs and Pharmaceuticals[J]. J Pharm Biomed Anal, 2007, 43: 1-13.
|
| [16] |
Muzhang.中美欧对元素杂质规定变更历史和基本要求介绍[EB/OL].(2018-04-08)[2019-02-09].http://med.sina.com/article_detail_103_2_43936.html.
|
| [17] |
ECA Academy. European Pharmacopoeia Commission Announces Strategy for Implementation of ICH Q3D[EB/OL].(2014-07-30)[2019-02-09]. https://www.gmpcompliance.org/gmp-news/european-pharmacopoeiacommission-announces-strategy-for-implementation-ofich-q3d.
|
| [18] |
European Directorate for the Quality of Medicines. Comments Concerning Revised Texts Published in Supplements 9.3[EB/OL].(2017-07-01)[2019-02-09]. https://www.edqm.eu/sites/default/files/supplementcomments93_e.pdf.
|
| [19] |
ECA Academy. ICH Q3D Implemented in the European Pharmacopoeia: Revision of Two General Monographs with Regard to Elemental Impurities[EB/OL].(2016-04-06)[2019-02-09]. https://www.gmp-compliance.org/gmp-news/ich-q3d-implemented-in-the-europeanpharmacopoeia-revision-of-two-general-monographswith-regard-to-elemental-impurities.
|
| [20] |
ECA Academy. Waiting for ICH Q3D(Step 4): Revision and Implementation of National Regulations delayed[EB/OL].(2014-06-25)[2019-02-09]. http://www.gmpcompliance.org/enews_04370_Waiting%20for%20ICH%20Q3D%20%28Step%204%29%3A%20Revision%20and%20Implementation%20of%20national%20Regulations%20delayed!.html.
|
| [21] |
中国药典: 四部[S]. 2015.
|
 2019, Vol. 33
2019, Vol. 33