药品不良反应(Adverse Drug Reaction,ADR)是指合格药品在正常用法用量下出现的与用药目的无关或意外的有害反应[1]。抗感染药是指用以治疗病原体(病毒、衣原体、支原体、立克次体、细菌、螺旋体、真菌、蠕虫等)所致感染的各种药物[2],包括抗生素(含β内酰胺类、氨基糖苷类、大环内酯类及喹诺酮类),抗病毒药物,抗真菌药物、抗结核药物、抗寄生虫药物等,是临床应用最为广泛的药品类别之一,其不良反应/事件报告数量一直居于首位,是药品不良反应监测工作关注的重点。按照习近平总书记对食品药品安全提出的“四个最严”要求,昆山市药品不良反应监测工作继续有序推进,监测覆盖面进一步扩大,着力防范药品潜在的安全风险。本文通过对我市2015年-2017年药品不良反应监测网络收到的抗感染药ADR报告进行回顾性分析,旨在通过了解抗感染药不良反应现状,以此发现其中存在的问题,并对抗感染药不良反应发生的防控措施进行探析,为降低抗感染药用药风险提供参考,提高安全用药水平,更好地保障公众用药安全。
1 资料与方法 1.1 资料来源利用“国家药品不良反应监测系统”数据库检索统计功能,使用Microsoft Excel软件,对我市2015年-2017年药品不良反应报告进行收集,由省、市、县评价通过的不良反应报告分别为1616、1738、1899份,其中抗感染药不良反应报告分别为842、769、909份。
1.2 方法采用回顾性研究方法,对2520份抗感染药ADR报告的报告类型、给药途径及报告来源分布情况进行调查,对结果进行统计、分析和评价。
“国家药品不良反应监测系统”中的ADR报告类型:新的(新的一般,新的严重),一般,严重。新的药品不良反应,是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。一般药品不良反应,是指药品说明书中已载明的并与说明书描述一致的不良反应。严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:导致死亡;危及生命;致癌、致畸、致出生缺陷;导致显著的或者永久的人体伤残或者器官功能的损伤;导致住院或者住院时间延长;导致其他重要医学事件,如不进行治疗可能出现上述所列情况的[1]。
2 结果 2.1 抗感染药不良反应/事件报告总体情况药品不良反应报告:2015年1616份,2016年1738份,2017年药1899份,逐年递增;其中抗感染药不良反应报告:2015年842份,2016年769份,2017年909份,分别占同期报告总数的52.10%、44.25%、47.87%,具体情况见表 1。
|
|
表 1 2015年-2017年抗感染药ADR报告总体情况 |
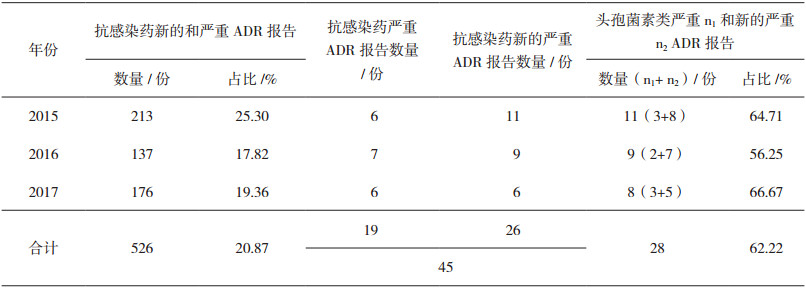
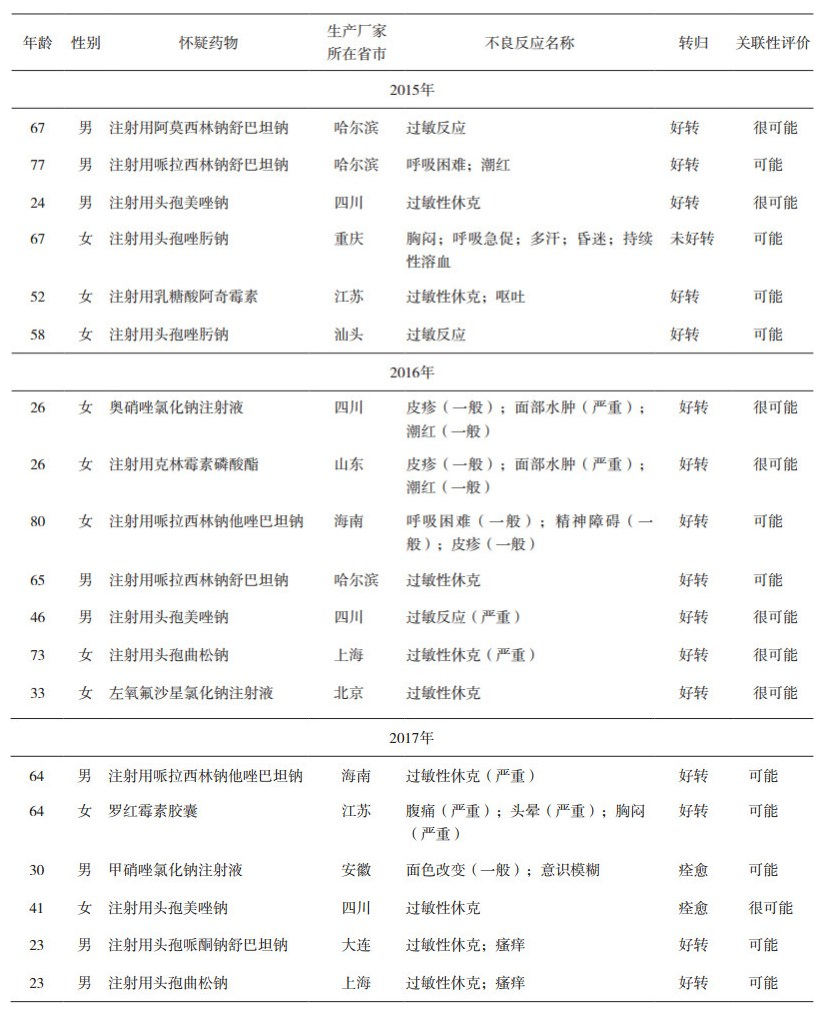
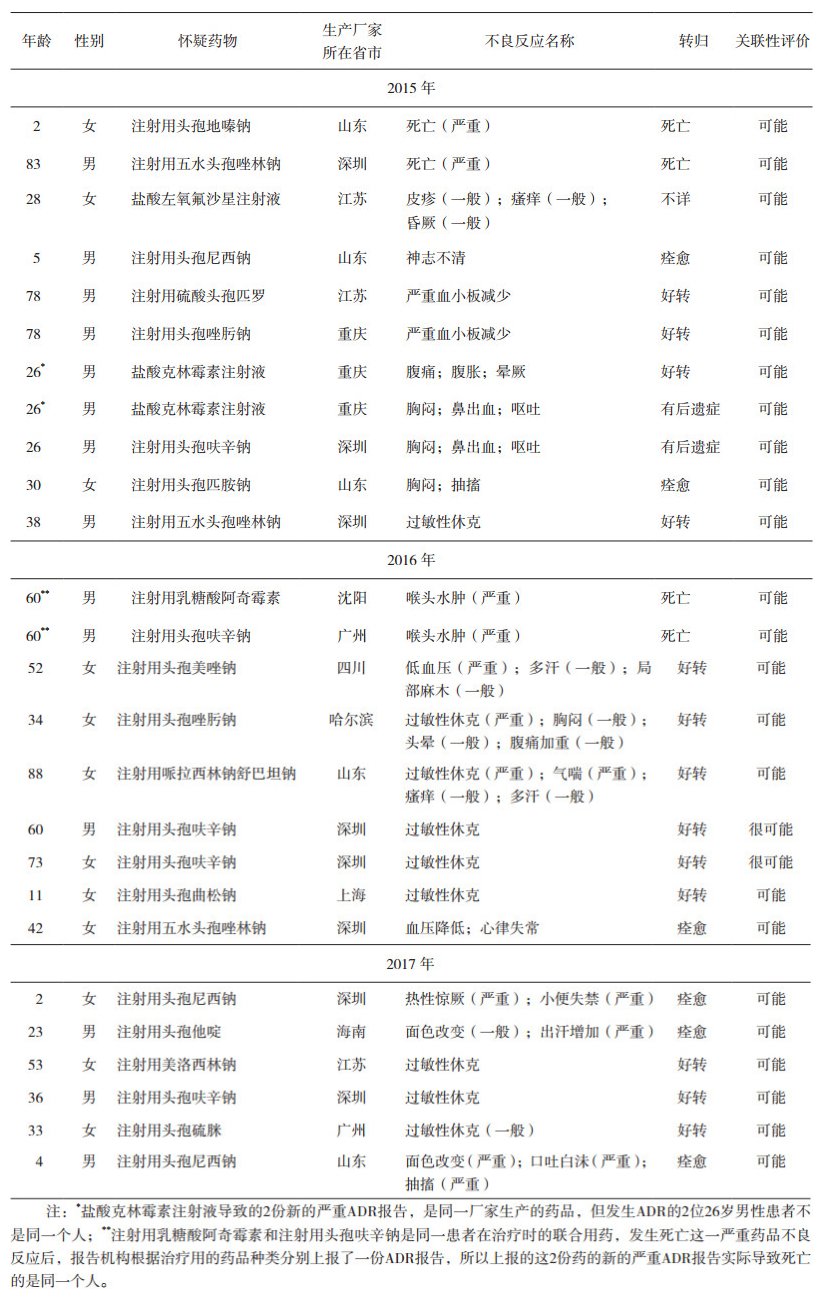
我市2015年-2017年药品不良反应监测网络收到抗感染药ADR报告中,新的和严重ADR报告分别为213份(25.30%)、137份(17.82%)、176份(19.36%),其中严重ADR报告分别为6份、7份、6份,新的严重ADR报告分别为11份(导致死亡2份)、9份(导致死亡2份)、6份。在上述抗感染药的ADR报告中(严重和新的严重类型合计45份),头孢菌素类严重和新的严重ADR报告分别为11份(64.71)、9份(56.25)、8份(66.27),其中严重ADR报告分别为3份、2份、3份,新的严重ADR报告分别为8份、7份、5份,具体情况见表 2、表 3、表 4。
|
|
表 2 2015-2017年抗感染药新的和严重ADR报告情况 |
|
|
表 3 严重ADR报告分布情况 |
|
|
表 4 新的严重ADR报告分布情况 |
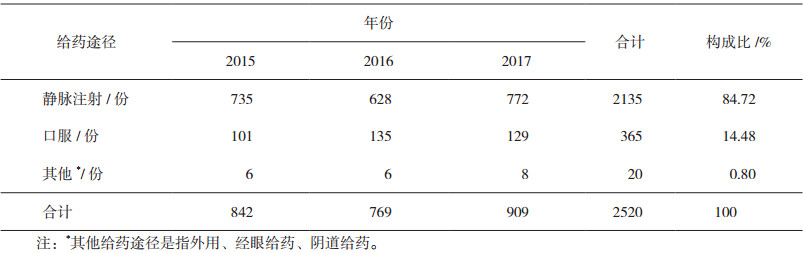
按照药品给药途径统计,2015年-2017年我市抗感染药不良反应报告中,静脉注射给药占84.72%、口服给药占14.48%、其他给药途径占0.80%,具体情况见表 5。
|
|
表 5 抗感染药ADR报告给药途径情况 |
按照报告来源统计,2015年-2017年我市药品不良反应监测网络收到的抗感染药ADR报告中,来自医疗机构的报告占90.83%,来自药品经营企业的报告占9.17%,来自药品生产企业和个人及其他的报告均为零,具体情况见表 6。
|
|
表 6 抗感染药ADR报告来源情况 |
近年来,我市药品不良反应监测工作成果显著,监测网络的覆盖面进一步扩大,从药品生产企业、医疗机构到零售药店,监测体系已经全面建立,ADR报告数量总体稳中有升,各涉药单位和群众都对药品潜在的安全风险有了很高的认识,风险意识有了很大的提高。
3.1.2 发现的问题我市2015年-2017年药品不良反应报告中,抗感染药几乎占居了一半,分别占同期报告总数的52.10%、44.25、47.87%,平均达47.97%,这一比例远高于国家药品不良反应监测年度报告(2017年)中抗感染药不良反应/事件报告占2017年总体报告的35.6%[3]这一数据。在抗感染药ADR报告中,静脉注射给药途径引起的ADR报告的平均占比达84.72%,与国家药品不良反应监测年度报告(2017年)中注射剂占2017年抗感染药不良反应/事件报告80.1%[3]相比也是高出的,注射剂比例总体偏高。可见,我市在抗感染药的临床使用中还存在不规范、不合理现象,因此,亟待加强我市对抗感染药使用的管理。另外,在抗感染药严重的和新的严重的45份报告中,怀疑药物为头孢菌素类的为28份,占比达62.22%,头孢类抗生素用药安全问题尤其突出,临床使用尤为要引起关注。
值得注意的是,在上面提到的45份严重的和新的严重的ADR报告中,被怀疑的药物涉及的企业多达22家,同一怀疑药物也涉及多家不同的企业,例如注射用头孢呋辛钠5份报告涉及3家企业,注射用头孢唑肟钠4份报告涉及3家企业,注射用头孢尼西钠3份报告涉及2家企业,可见药品不良反应的发生存在广泛性和普遍性,与药物品种本身有着密切关系,临床在选择用药时要根据疾病的性质和药物安全性谨慎选用药物品种。
同时还关注到在新的严重的ADR报告中重庆某一厂家生产的盐酸克林霉素注射液发生2起ADR:一起是患者因牙龈炎和牙周疾病单独使用盐酸克林霉素注射液后发生的;另外一起是患者因咽部不适合并使用注射用头孢呋辛钠后发生的。值得注意的是,现行美国药典、英国药典等收载的克林霉素注射剂产品多是克林霉素的磷酸酯;另外,为掩盖克林霉素的苦味,使其更适合口服给药,在临床上有更好的顺应性,通过酯化制成了克林霉素的棕榈酸酯,目前国外已有针对儿童和老年患者的盐酸克林霉素棕榈酸酯的口服制剂[4-6]。中国食品药品检定研究院金少鸿研究员也指出:应通过对盐酸克林霉素注射剂的临床再评价和风险评估,以考虑其是否有继续存在的必要性[7]。由此可见,盐酸克林霉素注射液在临床使用中应该引起高度重视,持续关注其安全性。
《药品不良反应报告和监测管理办法》(卫生部令第81号)规定,药品生产企业(包括进口药品的境外制药厂商)、药品经营企业、医疗机构应当按照规定报告所发现的药品不良反应[1]。我市2015年-2017年的药品不良反应报告中,医疗机构是ADR报告的主力,占90.83%,而药品生产企业没有一份报告,与其药品安全第一责任人[8]的身份严重不符,没能发挥其应当根据安全性情况主动开展重点监测[1]的企业职责。虽然我市只有6家药品生产企业,但是也看出,我市药品生产企业的药品不良反应监测工作尚存在着较大问题,ADR监测体系还不够完善,企业对监测工作还不够重视,没有形成良好的监测工作机制。
个人作为药品的使用者,直接对药品不良反应有着最为直观的感受,但是我国目前的“国家药品不良反应监测系统”没有对个人开放,导致反馈渠道受阻,有些信息可能出现滞后或者偏差现象。此外,目前我国ADR监测模式单一,主要依托“国家药品不良反应监测系统”由医疗机构、药品生产企业、药品经营企业遵循“可疑即报”的原则进行上报,即被动监测,存在报告不及时、漏报误报、缺乏敏感性和特异性等缺陷。
3.2 加强药品不良反应风险防控措施 3.2.1 规范临床合理用药,提高医务人员综合素质辨证施治、合理用药是临床用药的最根本原则,也是减少ADR发生的有效方法[9]。规范合理使用抗感染药,加大对使用抗感染药尤其是抗生素的监管力度,出台医疗机构使用抗感染药临床用药指导和相关考核办法,定期对医护人员进行相关知识的培训,提高医务人员对抗感染药知识的掌握程度从而提升综合素质,保证抗感染药的合理使用,降低不良反应发生的概率。
3.2.2 加强上市后监测,提升药品安全质量药品生产企业应该加强药品上市后安全性监测,继续开展跟踪研究,尤其是药品不良反应,并对其安全性和有效性进行再评价。企业应该制定药品不良反应监测制度,建立专门机构,聘请专业人员,纳入财政预算经费,针对发生的药品不良反应要从患者自身、医疗使用、药品本身等多角度、多范围收集各种信息进行深入调查研究,例如可以与市场上的同品种药物尤其是原研药进行对照,开展质量一致性评价工作,从药品本身的工艺出发,查找风险点,包括原辅料风险、生产质量风险和临床使用风险,及时全面发现药品风险信息,更好地加强对药物安全质量的管理,以减少药品不良反应的发生。
3.2.3 落实企业主体责任,提升ADR监测能力国家应该提高反馈ADR数据的发布频率,建立实时查询系统,使企业能及时获取自身产品的不良反应数据;统一建立专家库,由各地药品不良反应监测中心负责统筹,由企业承担部分专家聘任费用,共享专家库,在企业遇到新的、严重的病例时能立即开展调查评价工作[10]。企业自身应积极构建与患者之间更通畅的交流渠道,可完善公众报告系统,拓展个人反馈渠道,提高企业收集不良反应信息的效率[11],全方位提升企业ADR监测能力。
3.2.4 修订完善法律体系,助力ADR监测工作应完善我国现行的ADR监测法律体系, 分类出台各类企业ADR监测的具体实施办法和细则, 加大对ADR的处罚力度,建立和完善ADR补偿救济制度,实现法律与道德的良性互动[12],设立严重和罕见致伤残的药品不良反应赔偿基金,解决患者的后顾之忧[13],真正做到统一规范,使ADR监测工作有法可依,有章可循。
3.2.5 拓宽ADR监测模式,加强药品监测效果应进一步加快建立和完善主动监测工作机制,全面推广普及中国医院药物警戒系统(CHPS)这一类监测工具,在全国的综合性医院设立监测哨点,加强辅助发现、报告、评价ADR,减少漏报误报现象,提高药品不良反应报告效率和质量,更好地为医院合理用药提供参考,实现主动监测和被动监测相结合的新型监测模式,以减少药品不良反应的发生,提高公众用药安全意识。
| [1] |
卫生部.卫生部令第81号药品不良反应报告和监测管理办法[S]. 2011. https://www.doc88.com/p-5733942822481.html
|
| [2] |
李敏, 葛蕴萍. 抗感染药物的合理应用[J]. 中外医疗, 2009(12): 105. DOI:10.3969/j.issn.1674-0742.2009.12.095 |
| [3] |
国家药品不良反应监测年度报告(2017年)[EB/OL]. (2017-04-27)[2018-10-30]. http://www.cdr-adr.org.cn/xwdt/201804/t20180419_20011.html.
|
| [4] |
夏振华, 秦赟, 王明珊. 克林霉素磷酸酯的不良反应——解析"克林霉素磷酸酯"生产工艺和质量标准[J]. 抗感染药学, 2007, 4(3): 138-139. DOI:10.3969/j.issn.1672-7878.2007.03.017 |
| [5] |
克林霉素磷酸酯产品简介[J].现代妇产科进展, 2006, 15(3): 239. http://www.cnki.com.cn/Article/CJFDTotal-XDFC200603029.htm
|
| [6] |
邓玲, 邓盛齐. 克林霉素国内外制剂的研究进展[J]. 西南国防医药, 2006, 16(2): 222-224. DOI:10.3969/j.issn.1004-0188.2006.02.048 |
| [7] |
聪慧制药工业网.注射剂一致性评价安全为纲[EB/OL]. (2013-07-03)[2019-02-22]. http://info.pharmacy.hc360.com/2013/07/030956466560.shtml.
|
| [8] |
邵蓉, 蒋正华. 对企业是药品安全第一责任人的思考[J]. 中国药事, 2009, 23(10): 953-956. |
| [9] |
彭国平, 饶力群, 蒋科胜, 等. 中药注射剂引起不良反应的原因分析及对策[J]. 湖南中医药导报, 2004, 10(2): 47-49. DOI:10.3969/j.issn.1672-951X.2004.02.028 |
| [10] |
李嘉伟, 刘佐仁, 曾颖珊, 等. 广东省药品生产企业不良反应监测现状调查分析[J]. 中国药事, 2015, 29(5): 552-558. |
| [11] |
刘佐仁, 钱扬. 广东省各区域公众用药安全意识与行为比较分析[J]. 中国药事, 2012, 26(12): 1297-1300. DOI:10.3969/j.issn.1002-7777.2012.12.004 |
| [12] |
骆叶, 王钰涛, 张金钟. 药品不良反应补偿制度的建立与道德进步[J]. 中国药事, 2010, 24(3): 277-279. |
| [13] |
武煜, 许杰, 胡勇, 等. 药物不良反应监测体系存在的问题与对策初探[J]. 中国药事, 2011, 25(1): 60-62. |
 2019, Vol. 33
2019, Vol. 33