醋酸特利加压素为天然精氨酸加压素的结构类似物, 化学名为N-α-三甘氨酰-8-赖氨酸-加压素, 使用赖氨酸替代了内源性加压素肽链中第八位的精氨酸, 同时在半胱氨酸增加了由3个甘氨酸组成的氨基酸支链。特利加压素进入体内后, 经过酶的裂解作用, 代谢为活性产物发挥其药理作用[1]。醋酸特利加压素在临床上主要用于肝肾综合征和出血性食管静脉曲张[2-4]。Ferring GmbH公司生产的注射用醋酸特利加压素已上市多年, 并且国内也有上市仿制药, 为有效控制产品质量, 急需制备醋酸特利加压素国家化学对照品。本研究对醋酸特利加压素进行了结构确证、纯度分析, 最后通过质量平衡法赋值, 最终建立了首批醋酸特利加压素国家对照品。
1 仪器与试药Thermo Nicolet NEXUS FTIR红外光谱仪; Thermo Finigan LCQ DECA XP Plus液质联用仪; Perkin Elmer Model 343 Plus旋光仪; 岛津液相色谱仪(LC20AD泵, Sil20AC自动进样器, SPD20A检测器); 安捷伦6890N气相色谱仪; Mettler XS205电子天平; Metrohm 851KF水分测定仪; SMS DVS2动态蒸气吸附仪; MettlerToledo MP230酸度计; ABI Procise 491氨基酸序列分析仪。
醋酸特利加压素原料(批号Ⅰ-HY017-20121002, 深圳市翰宇药业有限公司); 18种氨基酸对照品(批号140624-200805, 中国食品药品检定研究院); 冰醋酸、磷酸、氢氧化钠、盐酸、磷酸氢二钠、磷酸二氢钾均为分析纯; 甲醇、乙腈、二甲基甲酰胺、三氟乙酸均为色谱纯。
2 方法 2.1 红外光谱测定采用溴化钾压片, 样品扫描次数32;背景扫描数32;分离度4000;Sample gain 1.0;Mirror velocity 0.6329;Aperture 100.00。
2.2 相对分子质量测定采用液质联用仪进行测定, ESI离子源4 kV, 鞘气流速30 arb, 正离子全扫描。样品甲醇溶液浓度为0.01 g ·mL-1。
2.3 比旋度测定将样品用1 m o l · L-1冰醋酸制成浓度为2 mg·mL-1, 采用旋光仪进行测定。
2.4 氨基酸比值采用高效液相色谱法, 样品在110℃水解20 h, 蒸干后衍生[5], 按外标法以氨基酸标准品峰面积计算样品各氨基酸的相对摩尔比值。
2.5 氨基酸序列测定利用Edman降解反应, N-末端氨基酸残基依次与衍生化试剂(异硫氰酸苯酯)作用, 从蛋白质/多肽N-末端按顺序切割下来, 形成稳定的氨基酸后进行分析鉴定。
2.6 纯度分析有关物质测定, 采用高效液相色谱自身对照法[6], 用反相C18色谱柱, 以0.067 mol·L-1磷酸二氢钠溶液(磷酸调pH值至3.5)为A相, 乙腈为B相, 梯度洗脱。供试品溶液浓度为0.2 mg·mL-1, 加水稀释定容制成供试品的1%自身对照溶液, 在210 nm波长下记录色谱图。
2.7 水分测定采用Met ro hm 684 KF水分测定仪对样品进行水分测定。
2.8 引湿性测定采用SMS DVS2动态蒸气吸附仪, 样品在25 ℃相对湿度为80%的条件下放置24 h, 实时测定样品重量[7]。
2.9 醋酸含量采用HPLC法, 反相C18色谱柱(Imertisl ODS- 4.5 µm, 4.6 mm×250 mm), 以磷酸盐缓冲液(取磷酸0.7 mL, 加水1000 mL混合后, 用10%氢氧化钠溶液调节pH值至3.0)为流动相A, 以甲醇为流动相B。样品用流动相(A:B=95:5)定量稀释成浓度为1.0 mg·mL-1, 另取冰醋酸适量, 同样方法稀释成浓度为0.1 mg·mL-1。流速1.0 mL·min-1, 柱温28 ℃, 在210 nm波长下记录色谱图, 按外标法计算醋酸含量。
2.10 残留溶剂测定采用气相色谱法, DM-FFAP毛细管柱(30 mm×0.32 mm, 0.25 µm), 样品用水配制成1.0 mg·mL-1, 柱温起始温度为40 ℃维持6 min, 然后以每分钟20 ℃的速率升至80 ℃, 维持7 min, 最后以每分钟5 0 ℃的速率升至1 5 0 ℃, 维持4 min; 以氮气为载气, 流速为2 mL·min-1; 分流比开始50:1, 0.75 min后为10:1;进样口温度为200 ℃; 检测器温度为250 ℃; 检测器为氢火焰离子化检测器(FID), 按外标法以峰面积计算甲醇、乙腈和二甲基甲酰胺的含量。
2.11 三氟乙酸含量测定采用离子色谱法, 样品加水制成50 mg·mL-1溶液, 采用Metrosep A Supp 5-250阴离子分析柱, NaHCO3(1.0 mmol·L -1)和Na2CO3(3.2 mmol·L-1)的混合溶液进行淋洗, 检测器为电导检测器, 按外标法以峰面积计算三氟乙酸含量。
2.12 均匀性和稳定性采用有关物质测定方法, 随机抽取12支待标品(分装后), 按照随机序列表顺序进样, 以峰面积/称样量为判定指标进行方差分析, 考察样品的均匀性。取3支待标品置于30 ℃保温箱中, 分别于0、5、10天各取1支检测有关物质, 采用面积归一化法和1%自身对照法计算总杂质含量和最大单一杂质含量, 考察样品的稳定性。
3 结果与讨论 3.1 结构确证作为首批制备的对照品, 我们对其结构进行了多方面的考证, 以确保结构的准确。
3.1.1 红外光谱图 1为醋酸特利加压素的红外光谱图, 各吸收峰的归属见表 1。由表 1可知, 本品具有特利加压素的结构特征吸收峰, 波数误差小于规定波数的0.5%。

|
图 1 醋酸特利加压素的红外光谱图 |
|
|
表 1 红外光谱图中各吸收峰的谱峰归属 |
醋酸特利加压素的质谱图见图 2。高分辨率质谱的离子峰614.25, 与醋酸特利加压素2电荷离子峰理论值[C52H76N16O15S2]2+一致, 相差0.252 ppm。
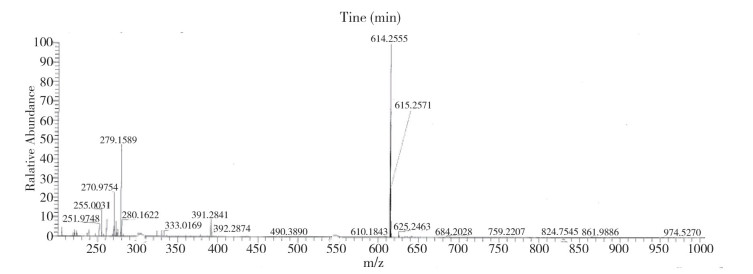
|
图 2 醋酸特利加压素质谱图 |
在一定波长与温度下测定旋光度, 可以区别和检查药品的纯杂程度, 醋酸特利加压素待标品的比旋度为-102º, 在规定范围-93 º至-103 º内。
3.1.4 氨基酸比值由于醋酸特利加压素为多肽, 对其氨基酸的比值进行考察[8]。经测定, 本品的氨基酸谱图如图 3所示, 氨基酸的比值分别为谷氨酸1.0、脯氨酸1.1、苯丙氨酸1.0、天冬氨酸1.0、酪氨酸1.0、赖氨酸1.0、甘氨酸4.0、半胱氨酸1.9。结果显示, 本品各氨基酸比值均在规定限度内。

|
图 3 醋酸特利加压素的氨基酸分析HPLC色谱图的结构特征吸收峰 |
待标品N末端氨基酸序列测定结果如下GlyGly-Gly-Cys-Tyr-Phe-Gln-Asn-Cys-Pro-LysGly, 本待标品氨基酸全序列与特利加压素理论序列一致。
3.2 纯度分析供试品按归一化法计算总杂质含量为0.82%, 单个最大杂质含量为0.36%;采用主成分1%自身对照法计算, 醋酸特利加压素总杂质含量为0.92%, 单个最大杂质含量为0.41%。如图 4所示。

|
图 4 醋酸特利加压素1%自身对照典型色谱图 |
作为首批制备对照品, 还对本品原料中可能会影响含量的有关理化项目做了进一步的检测。
3.3.1 水分分装后的待标品经水分测定结果为5.73%, 符合规定要求。
3.3.2 醋酸由于本品以醋酸盐形式存在, 对其醋酸含量进行控制。经HPLC法检测醋酸含量为8.28%, 符合要求。
3.3.3 残留溶剂三氟乙酸含量为0.038%, 乙腈0.005%, 甲醇和二甲基甲酰胺未检出。
3.3.4 引湿性考虑到本品为首批研制, 且水分含量相对较大, 故对其引湿性进行了测定。样品在25 ℃相对湿度升高至80%的过程中增重约20%, 根据《中华人民共和国药典》(以下简称《中国药典》) 2015年版四部9103《药物引湿性试验指导原则》规定[9], 引湿增重不小于15%为极具引湿性, 鉴于本品极具引湿性, 在对样品进行分装时, 除了严格控制温度外, 还要对分装环境的相对湿度进行控制, 要求在规定湿度恒定条件下快速分装, 避免吸附水分。
3.4 含量确定以质量平衡法计算, 含量=(100%-水分-醋酸-残留溶剂-三氟乙酸)×HPLC纯度, 结果为85.4%。
3.5 均匀性和稳定性本待标品分装后各支间通过均匀性检验(F < Fα), P=0.0949>0.05, 最小称样量为10 mg, 该批待标品支间均匀。供试品溶液室温放置10 h稳定。待标品在30 ℃放置10天内杂质含量有所增加(面积归一化法:总杂质由0.44%增加至0.64%;1%自身稀释对照法:总杂质由0.51%增加至0.79%), 建议-20℃保存并定期核查。
4 结论合成多肽药物是指采用化学合成方法制备的多肽类药物。采用化学合成方法制备多肽, 可以对天然多肽的结构进行修饰, 从而增加多肽与受体的亲和力和选择性, 增强对酶降解的抵抗力或改善药代动力学特性, 甚至由受体的激动剂变为拮抗剂。多肽主要由氨基酸(包括天然氨基酸和非天然氨基酸)构成, 这使得多肽类药物在质量研究方面不同于一般药物。由于合成工艺、结构等方面的独特性, 合成多肽原料药中工艺杂质的来源和一般化学药物有所不同, 其可能产生的工艺杂质有缺失肽、断裂肽、去酰胺多肽、氨基酸侧链的不完全脱保护所形成的副产物、氧化肽、二硫键交换的产物、非对映异构的多肽等。同时, 由于多肽的结构特点, 这类药物的稳定性相对较差, 引起多肽药物不稳定的原因主要有水解、氧化、外消旋化、二硫键的断裂及重排、β消除等。因此, 在合成多肽药物的结构鉴别和有关物质检查方法的研究中需要充分考虑对工艺杂质与降解杂质的区分力和检出效能。对此类多肽类化合物对照品标定中结构鉴别的一般策略, 应选择有资质企业的原料作为候选化合物, 对其关键结构特征进行验证, 如满足, 即可认同其结构准确。
《中国药典》2015版四部首次收录了 < 9901>国家药品标准物质制备指导原则[9], 本待标品严格按照该原则进行制备和标定, 包括待标品的化学结构确证、理化性质检查、纯度及有关物质检查、均匀性检查、稳定性考察等。由于醋酸特利加压素无国际标准物质进行比对, 所以最终采用质量平衡法进行定值, 并由具备相关实验室资质的3家实验室进行协作标定。经过药品标准物质专家委员会审定, 批准待标品(批号150701-201501)作为醋酸特利加压素鉴别和HPLC含量测定用国家对照品使用, 其含量以特利加压素计为85.4%。
| [1] |
戚虎昶, 凌静, 卢芳芳. 特利加压素临床研究进展[J]. 解放军药学学报, 2012, 28(2): 169-172. |
| [2] |
Allegretti AS, Israelsen M, Krag A, et al. Terlipressin Versus Placebo or No Intervention for People with Cirrhosis and Hepatorenal Syndrome[J]. Cochrane Database Syst Rev, 2017, 6: CD005162. DOI:10.1002/14651858.CD005162 |
| [3] |
Wang H, Liu A, Bo W, et al. Terlipressin in the Treatment of Hepatorenal Syndrome:A Systematic Review and Metaanalysis[J]. Medicine (Baltimore), 2018, 97(16): e0431. DOI:10.1097/MD.0000000000010431 |
| [4] |
Israelsen M, Krag A, Allegretti AS, et al. Terlipressin Versus other Vasoactive Drugs for Hepatorenal Syndrome[J]. Cochrane Database Syst Rev, 2017, 9: CD011532. DOI:10.1002/14651858.CD011532.pub2 |
| [5] |
谢能咏, 汤媛玲, 赵俐敏, 等. 柱前衍生反相高效液相色谱法分析赖氨酸[J]. 江汉大学学报, 1999, 16(3): 1-4. |
| [6] |
YBH06912009国家药品标准[S]. 2009.
|
| [7] |
张新, 张启明, 李慧义, 等. 水分吸附分析法及其在药物研究中的应用[J]. 药物分析杂志, 2008, 28(10): 1779-1782. |
| [8] |
刘莉莎, 郝苏丽, 任雪, 等. 首批醋酸去氨加压素国家对照品的研制[J]. 中国药事, 2011, 25(3): 245-247. |
| [9] |
中国药典: 四部[S]. 2015: 附录378-379, 416-417.
|
 2019, Vol. 33
2019, Vol. 33 

