骨肽类制剂是以新鲜或冷冻的猪、鹿或胎牛骨经生物技术提取制成的灭菌水溶液,其内含有多种多肽类骨代谢活性因子、有机钙、磷、无机盐、氨基酸及微量元素等,是一种具有生物活性的多组分生化药。其药理作用有刺激成骨细胞增殖,促进新骨形成,调节钙磷代谢,增加骨钙沉淀及抗炎、镇痛等。临床上主要用于骨质疏松症、骨质增生性疾病、骨折及类风湿性关节炎等治疗[1-2]。
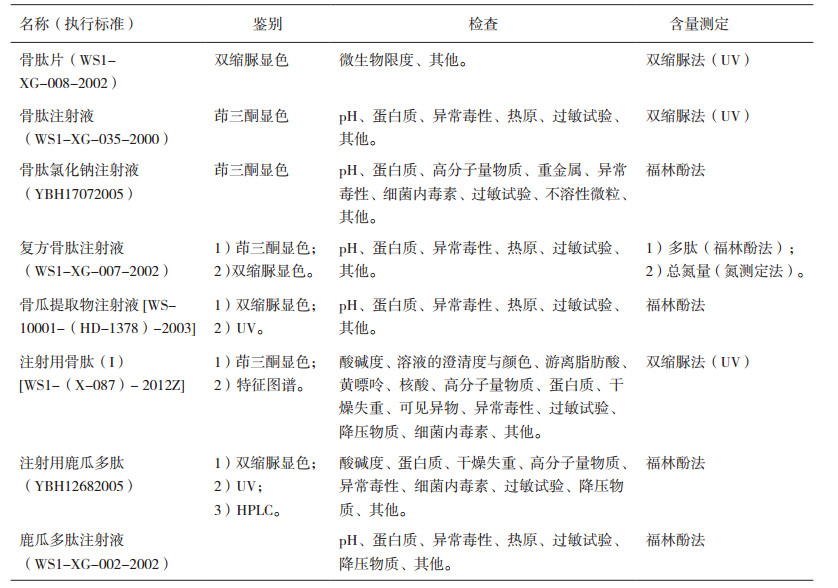
1 骨肽类制剂质量控制现状骨肽类制剂在各国药典均未收载,我国相关品种的质量标准收载于国家标准地升部十六册,详见表 1。现行标准中质控指标包括:1)鉴别:双缩脲显色、茚三酮显色、UV、HPLC及特征图谱;2)检查:包括pH、蛋白质、异常毒性、热原、过敏试验、降压物质等项目;3)含量测定:双缩脲法或福林酚法对多肽含量进行控制等。
|
|
表 1 已有骨肽类制剂(部分)国家质量标准 |
含量测定中所采用的双缩脲法或福林酚法,对于含有肽键的动、植物中的任何多肽均可产生正反应,专属性差[3]。因此,该质量标准应在含量测定的基础上,采用生物活性测定方法,通过生物反应的强度可较直观地反映药物总体活性或效价,与理化分析方法相结合,达到全面综合地保证药品的安全性、有效性和质量可控的目的。
2 骨肽类制剂研究现状生物活性测定法是利用药物对整体动物、离体器官、组织或细胞等生物体上某些特定指标的反应强度来测定药物有效性,它是以药物的药理作用及药效学试验为研究基础[4-5]。临床上骨肽类药物用于治疗骨质疏松症及修复骨折,主要是基于刺激成骨细胞增值及促进新骨形成的药理作用;而用于治疗类风湿性关节炎则是基于其抗炎的药理作用。
2.1 对成骨细胞与破骨细胞的作用骨重建平衡表现为成骨细胞的骨形成与破骨细胞的骨吸收之间的平衡,大多骨类疾病均与成骨细胞和破骨细胞之间的平衡失调有关,包括骨质疏松症和骨折。骨重建过程包括破骨细胞贴附在旧骨区域,分泌酸性物质溶解矿物质,分泌蛋白酶消化骨基质,形成骨吸收陷窝;其后,成骨细胞移行至被吸收部位,分泌骨基质,骨基质矿化而形成新骨[6-7]。
成骨细胞是骨形成的主要功能细胞,在骨骼形成、损伤后再生的过程中起决定性作用,常用于骨代谢研究的成骨细胞模型包括:1)人骨肉瘤细胞株MG63;2)大鼠骨肉瘤细胞的成骨样细胞UMR106;3)从C57BL/6小鼠颅顶细胞中建立的前成骨细胞株MC3T3-E1-subclone14。目前,大量文献表明骨肽类制剂对成骨细胞有明显促增值作用,进而调节骨代谢。岳云飞等[8]采用四甲基噻唑蓝(MTT)法研究建立了注射用鹿瓜多肽促进MG63细胞增值的体外细胞生物活性测定方法。王灿等[9]采用Cell Counting Kit(CCK-8)法研究表明鹿瓜多肽注射液对UMR106细胞及MC3T3-E1细胞株均有促进增殖作用,且对UMR106细胞株促增殖作用更为明显,并建立相应体外活性评价方法。
破骨细胞是骨吸收的功能细胞,其功能亢进在骨质疏松中具有重要的意义。陈雷等[10]通过鹿瓜多肽注射液对小鼠颅骨骨溶解抑制作用实验,发现抗酒石酸酸性磷酸酶(TRAP)染色在药物干预组中破骨细胞数目较阴性对照组减少,表明鹿瓜多肽注射液可减少破骨细胞数目。唐瑛等[11]通过骨肽注射液作用于去卵巢大鼠试验,发现骨肽治疗组破骨细胞上Fas抗原表达增加,与配体结合而引起细胞凋亡,表明骨肽注射液可通过调控Fas蛋白诱导破骨细胞凋亡,而达到抑制破骨细胞骨吸收作用,提示骨肽类制剂作用于破骨细胞骨吸收是其发挥药效的另一作用机制。
2.2 治疗骨质疏松症作用有大量的临床研究表明骨肽类药物治疗骨质疏松症有显著疗效。贾文等[12]通过临床穴位注射骨肽注射液治疗原发性骨质疏松症患者,结果显示治疗组患者骨密度较对照组钙剂治疗有明显改善,表明骨肽注射液对治疗原发性骨质疏松症有较好疗效。还有文献显示骨肽类药物与阿伦磷酸钠[13]、降钙素[14]等一些临床常用骨质疏松症药物联合用药,在改善临床症状或是增加骨密度方面均优于单一用药。去卵巢雌鼠模型动物是研究绝经后雌激素缺乏而引起骨质疏松症的经典模型动物[15]。段永宏等[16]通过研究鹿瓜多肽注射液对去卵巢大鼠骨组织力学的影响,结果显示鹿瓜多肽注射液给药组的骨密度较阴性对照组显著增加,骨小梁间隔变小,骨皮质增厚,与正常对照组接近,表明鹿瓜多肽对去卵巢大鼠的骨密度及骨形态结构有较好维持作用。
2.3 促进间充质干细胞向成骨细胞分化作用机体骨折后修复过程需要局部聚集数量足够的间充质干细胞诱导分化成骨,其过程类似于胚胎期骨形成。间充质干细胞(mesenchymal stem cell,MSCs)是具有高自我更新能力的多向分化潜能干细胞,可诱导分化为成骨细胞,是科学研究骨组织工程的理想种子细胞[17-18]。MSCs诱导分化过程中的各种骨代谢因子起重要作用,骨肽类制剂中含有多种骨诱导活性因子,包括β-转化生长因子(transforming growth factor,TGF-β)、骨形态发生蛋白(bone morphogenetic proteins,BMPs)等。TGF-β是一组调节细胞生长和分化的超家族,可促进间充质干细胞细胞外基质合成及成骨细胞合成Ⅰ型胶原蛋白。BMPs亦属于TGF-β超家族,是间充质干细胞向骨系细胞分化的最初信号分子,诱导分化软骨细胞和成骨细胞而促进新骨形成[19-20]。王伟刚等[21]采用ELISA法检测骨肽作用于骨髓间充质干细胞(MSCs)后TGF-β1的表达,研究表明给药组中TGF-β1蛋白含量较对照组有明显增强。
骨形成初期成骨细胞数量明显增加,而后进入细胞外基质成熟阶段,成骨细胞分泌的碱性磷酸酶(Alkaline phosphatase,ALP)是成骨细胞分化的主要早期特异性指标。Ⅰ型胶原蛋白是细胞外基质的主要成分,作为依托和骨架使骨钙素和羟基磷灰石可与其结合并沉淀,是成骨细胞分化中期指标。骨钙素(Osteocalcin,OCN)是由成骨细胞分泌的一种非胶原性蛋白,在成骨分化晚期能够促进钙结节形成,是成骨细胞完全分化成熟的指标[22]。段智霞等[23]用自行合成的BMP-2诱导MSCs体外定向成骨,通过实时荧光定量PCR检测发现成骨细胞特异性标志物ALP、Ⅰ型胶原、OCN mRNA的表达均明显增加,表明BMP-2能有效促进MSCs向成骨细胞分化。
2.4 抗炎作用一些文献显示骨肽类制剂可协助巨噬细胞参与组织修复而发挥抗炎作用。刘静等[24]在风湿性、类风湿性关节炎的基础治疗上加用骨瓜提取物以探讨研究其抗炎作用,结果显示临床总抗炎效率明显提高,治疗效果显著。侯晓怡等[25]利用大鼠佐剂性关节炎动物模型研究鹿瓜多肽注射液的抗炎作用,结果显示给药组可有效降低血清中TNF-α及IL-6含量,表明鹿瓜多肽注射液可通过调节免疫系统,减少炎性细胞因子和炎症介质的产生而起到良好抗炎作用。欧阳杰湖等[26]参照生物活性检定实验方法,建立巴豆油致小白鼠耳廓肿胀经典体外抗炎实验模型来评价骨瓜提取物注射液抗炎的生物活性。周密妹等[27]研究显示骨多肽本身并无抗炎作用,而是制剂中加入的全蝎或甜瓜籽提取物能够降低局部毛细血管通透性而改善血液流变性,减少炎性渗出,而缓解炎症反应的破坏性。
3 讨论近年来,骨肽类药物的主要药效学及临床效用已逐渐被实验证实,但质量可控性不够仍制约着骨肽类药物的应用和发展。生物活性测定是生物制品或生化药品质量分析的常用方法,可准确地测定产品的生物学效价并评价其稳定性,反映产品批与批之间的一致性,近年来成为骨肽类药物质量控制的研究热点[28]。
生物活性测定法以药物的药理作用及药效学为研究基础,以生物统计为工具,并运用特定的试验设计进行试验,反映药物有效性及临床功能,可分为效价测定法(定量法)和活性限制测定法(半定量法)[29]。其内容包括:测定整体动物或特定器官对药物的生物学反应、测定细胞水平的生化或生理学反应、免疫学作用下的酶反应速率以及配体或受体结合反应等。生物活性是表示药物产生特定生物学效应的能力,寻找包括整体动物、组织、细胞等生物标记物上的反应强度及剂量作为生物活性测定方法学和限值研究的依据。生物活性指标的选择应考虑药品本身功能主治,在以现代药理学研究的基础上选择专属性强且灵敏度高的作为生物活性测定指标[30]。
由于生物制品的复杂性且影响生物活性测定的各种变异因素较多,在实验设计中在每次仅改变一个变量,调整该变量的变化幅度,以分别确定每个变量的影响程度。在众多因素中找出一些影响因素较大的,将影响因素及其变化幅度进行组合,以确定影响因素和反应程度之间的相互作用,进而优化稳定实验操作条件,并通过观察小幅度的改变影响因素对活性检测的结果测定方法的耐用性,经过方法学验证及生物统计分析的比较,制定出可接受的误差范围,从而开发建立出合理、可行、可控的生物活性测定方法。
根据骨肽类药物刺激成骨细胞增殖,促进新骨形成,防治骨质疏松及抗炎等多种生物学活性,我们初步探索建立评价骨肽类药物生物活性的体内巴豆油致小鼠耳廓肿胀抗炎实验以及体外促成骨细胞增值细胞试验,为其生物活性测定方法的开发打开思路。建立关联骨肽类制剂临床药理药效的生物活性测定方法,与理化分析方法相结合的质量标准对骨肽类制剂进行评价,可以更好地反映药品特征全貌,以期达到更全面完善地控制该类药品的安全性和有效性。
| [1] |
马洁, 宋燕青. 骨肽注射液的临床应用及其药理作用[J]. 中国生化药物杂志, 2016, 36(2): 16-18. |
| [2] |
刘红煜, 吴学海, 张丽. 动物骨制剂药理作用与临床应用[J]. 黑龙江医学, 2004, 17(3): 228-229. |
| [3] |
王雪, 张伟, 李家春, 等. 4种常用蛋白质测定方法用于中药注射剂中大分子蛋白检测的适用性研究[J]. 中草药, 2015, 46(15): 2228-2231. DOI:10.7501/j.issn.0253-2670.2015.15.009 |
| [4] |
齐烨迪, 苏慧, 陈莉, 等. 多肽类药物研究进展[J]. 福建分析测试, 2018, 27(1): 23-28. DOI:10.3969/j.issn.1009-8143.2018.01.05 |
| [5] |
于雷, 饶春明. 生物技术药物生物学活性测定方法研究进展[J]. 生物技术通讯, 2017, 28(3): 392-396. DOI:10.3969/j.issn.1009-0002.2017.03.030 |
| [6] |
Watanabe Y, Harada N, Sato K, et al. Stem Cell Therapy:Is There a Future for Reconstruction of Large Bone Defects?[J]. Injury-international Journal of the Care of the Injured, 2016, 47: S47-S51. |
| [7] |
秦集斌, 宋洁富, 薛旭红. 原发性骨质疏松症的病因学研究进展[J]. 中国骨质疏松杂志, 2016, 22(4): 511-514. DOI:10.3969/j.issn.1006-7108.2016.04.027 |
| [8] |
岳云飞, 张丽英. MTT法测定注射用鹿瓜多肽活性[J]. 黑龙江医药, 2011, 24(3): 348-349. DOI:10.3969/j.issn.1006-2882.2011.03.007 |
| [9] |
王灿, 董闪闪, 王自强, 等. 鹿瓜多肽体外活性测定方法的探讨研究[J]. 药物分析杂志, 2018, 38(7): 1196-1201. |
| [10] |
陈雷, 李长德, 于洋, 等. 鹿瓜多肽注射液对PMMA颗粒诱导的小鼠颅骨骨溶解抑制作用的实验研究[J]. 黑龙江医药科学, 2014, 37(2): 102-103. |
| [11] |
唐瑛, 唐忠志, 王晓昆, 等. 骨肽注射液对去卵巢大鼠骨组织中TGF-β1及Fas的影响[J]. 中国中医骨伤科杂志, 2005, 13(6): 42-45. DOI:10.3969/j.issn.1005-0205.2005.06.016 |
| [12] |
贾文, 尹莹, 董雪, 等. 穴位注射骨肽注射液治疗原发性骨质疏松症临床观察[J]. 山西中医, 2014, 30(9): 32-34. |
| [13] |
廖化波, 张俊娟. 阿仑膦酸钠联合骨肽治疗骨质疏松症患者的临床效果[J]. 中国骨质疏松杂志, 2017, 23(6): 784-786. DOI:10.3969/j.issn.1006-7108.2017.06.017 |
| [14] |
车革方. 骨肽联合降钙素治疗原发性骨质疏松症[J]. 中国实用医药, 2014(2): 154-155. |
| [15] |
Johnston B D, Ward W E. The Ovariectomized Rat as a Model for Studying Alveolar Bone Loss in Postmenopausal Women[J]. BioMed Research International, 2015, 2015: 1-12. |
| [16] |
段永宏, 刘建, 胡蕴玉, 等. 鹿瓜多肽注射液对去卵巢大鼠骨密度及松质骨中骨形态发生蛋白表达的影响[J]. 中国医药, 2006, 1(12): 740-742. DOI:10.3760/cma.j.issn.1673-4777.2006.12.020 |
| [17] |
Jaiswal N, Haynesworth S E, Caplan A I, et al. Osteogenic Differentiation of Purified, Culture-expanded Human Mesenchymal Stem Cells in Vitro[J]. Journal of Cellular Biochemistry, 2015, 64(2): 295-312. |
| [18] |
师彬, 杨武斌, 王平. 骨髓间充质干细胞诱导分化成骨细胞的研究现状[J]. 中国实验方剂学杂志, 2014, 20(19): 228-231. |
| [19] |
王小娜. TGF-β在雷奈酸锶促进大鼠骨髓间充质干细胞向成骨细胞分化中的作用[J]. 中国病理生理杂志, 2011, 27(12): 2357-2361. DOI:10.3969/j.issn.1000-4718.2011.12.022 |
| [20] |
韩娜, 寇玉辉, 王天兵, 等. 17β-雌二醇对大鼠骨髓间充质干细胞向成骨细胞分化的诱导调控[J]. 中国组织工程研究, 2012, 16(10): 1721-1724. DOI:10.3969/j.issn.1673-8225.2012.10.003 |
| [21] |
王维刚, 王志刚, 李大鹏. 骨肽对骨髓间充质干细胞TGF-1表达的影响[J]. 中国实验诊断学, 2012, 16(4): 607-608. DOI:10.3969/j.issn.1007-4287.2012.04.013 |
| [22] |
周绮红. 鹿瓜多肽中骨诱导多肽类生物因子在临床中应用[J]. 中国伤残医学, 2017, 25(18): 100-100. |
| [23] |
段智霞, 郑启新, 郭晓东, 等. 骨形成蛋白2活性多肽体外定向诱导骨髓间充质干细胞向成骨方向分化的剂量依赖性研究[J]. 中国修复重建外科杂志, 2007, 21(10): 1118-1122. |
| [24] |
刘静. 骨瓜提取物注射液与鹿瓜多肽治疗风湿性、类风湿性关节炎的疗效比较[J]. 中国保健营养旬刊, 2014(6): 3467-3467. |
| [25] |
侯晓怡.鹿瓜多肽注射液对大鼠佐剂性多发性关节炎的抑制作用[D].吉林大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10183-2009093877.htm
|
| [26] |
欧阳杰湖, 陈子渊, 潘善庆, 等. 骨瓜提取物注射液的生物活性测定[J]. 中南药学, 2013, 11(2): 92-95. |
| [27] |
周密妹, 耿立坚, 李性天. 骨肽类药物的临床安全性探讨[J]. 药物流行病学杂志, 2010(8): 469-472. |
| [28] |
欧阳杰湖, 潘善庆, 田洪. 多组分制剂生物活性测定研究进展[J]. 中南药学, 2013(6): 450-451. |
| [29] |
黄青, 鲁素雅, 陆益红, 等. 转移因子注射剂质量评价与研究[J]. 中国药学杂志, 2015, 50(13): 1146-1152. |
| [30] |
游云, 廖福龙, 黄璐琦. 基于生物活性测定开展中药质量控制的研究进展[J]. 中国中药杂志, 2018, 43(3): 452-456. |
 2019, Vol. 33
2019, Vol. 33