在药包材实际生产和使用过程中,变更会时常发生,有药包材登记人主动进行的质量提升和改造,也有受突发或不可控原因导致的变更。变更内容涉及从原辅材料到生产工艺各个方面。因此,变更研究对于药包材行业来说是很重要的问题,直接影响到产品质量,并影响到药品的安全有效。变更研究贯穿于整个产品生命周期[1-2]。目前,国内药品、药包材以及药用辅料的相关法规和要求层出不穷,其中关于药包材的变更研究在行业内已有征求意见稿。本文就美国食品药品监督管理局(FDA)对于药包材变更管理的要求和法规途径进行优劣分析,进而为我国处于法规改革阶段的药包材监管提供借鉴和帮助。
1 FDA对于药包材的监管模式及其质量标准要求FDA的监管主要针对药品,而对于药品相关的“附属”产品如原料药、药用辅料和药包材则采取结合药品的关联审评方式,对于这些产品的监管,主要由药品生产商来负责。但是考虑到这些产品本身所拥有的知识产权不可能泄露给药品生产企业,同时结合FDA主要针对药品的监管模式,FDA推出了药品主控文件(Drug Master File,DMF)的管理模式。按照不同的产品备案分类,DMF分为5类:
Ⅰ类:生产地点、设施、操作流程和人员(已取消);
Ⅱ类:原料药、中间体及其制备中所用材料或药品;
Ⅲ类:包装材料;
Ⅳ类:赋形剂、着色剂、矫味剂、香精或以上制备中所用材料;
Ⅴ类:FDA接受的其他参考信息[3]。
针对不同类型DMF有不同的资料要求,所有药包材,包括进口药包材以及美国本土生产的药包材,都可以申请Ⅲ类DMF备案。按照通用技术文件格式要求撰写资料,形成完整的DMF文件后以电子递交的方式递交DMF备案。FDA在收到备案资料后2~3周内,对资料进行形式核查,主要关注通用技术文件所有部分都有相应的内容,但是不会关注具体技术数据。形式核查通过后,FDA会公布DMF号,于是相应的药包材拥有了自己的DMF备案号。当该药包材用于包装某个药品时,该药品注册申请人向FDA递交注册申请,FDA对药品进行技术审评时,会关联相应包材的资料进行审评,这种审评模式被称为关联审评。在审评完成后,药品申请人会被通知通过审评,而包材DMF号会说明通过技术审评。上述流程就是DMF备案以及关联审评制度。由于DMF制度成立,其初衷是为了保护知识产权,防止DMF持有人(例如包材)的技术信息泄露给药品申请人,因此,DMF备案制度不是强制要求。而是否申请DMF完全由申请人自己决定,FDA对此保持不反对也不鼓励的中立态度。
在技术方面,目前美国药品行业关于药包材标准的要求,主要是美国药典的药包材专论章节。但是,对于美国药典的要求仅仅是参考标准,也非强制要求。如果药包材生产企业有足够的科学研究数据,证明美国药典相应检测标准或者检测方法不适用于某些药包材,但是对药品不产生不良影响,FDA在关联审评过程中也会接受此类标准。
另外,如同关联审评一样,由于FDA意识到单独研究药包材本身意义不大,需要和相关的药品结合研究,考虑药包材针对特定药品的适用性,包括药包材的保护性、安全性、相容性、功能性等。因此,在技术审评过程中,也更多关注药品在开发过程中对相应药包材的研究项目和研究内容,并且研究结果是否可以说明药包材对药品的适用性。同时,考虑到不同的药品,由于给药途径以及作用原理不同,其风险也有高低之分,因此FDA针对不同风险分级的给药方式,给药包材出具相应的技术审评指导原则,即CMC Reviews of Type Ⅲ DMFs for Packaging Materials MAPP 5015.5 Rev. 1[4],以便在包材生产企业开发产品以及撰写DMF备案资料时有更科学的依据,也更为了解FDA审评员的关注点。
综上所述,可以从两个方面理解FDA对于整个药包材行业的监管:
1)从法规管理层面,FDA对于药包材的管理,其实是“委托”相关的药品生产企业。药品生产企业作为第一责任人,对所有和药品相关的事故责任负责,即使某些问题来源于药包材、药用辅料或者原料药。
2)从技术指导层面,FDA和美国药典委员会一起提供相关的药典标准,并且FDA也给出相应的审评指导原则,使药包材企业包括制药企业有明确的技术指导原则可以参考。
因此,FDA在对于药包材的整体监管可以理解为,药品为主力,FDA提供支持。
2 FDA对于药包材变更管理的优势和问题分析产品上市后变更是常态,FDA对于产品的变更有比较多的技术指导原则。FDA的监管主抓药品,因此变更的指导原则几乎全部是关于药品的,而对于药包材的变更,也是评估包材的变更对于药品的影响。在这些指导原则中,比较关键也是最为常见的是“Changes to an Approved NDA and ANDA” [5]以及“ANDA Submissions-Prior Approval Supplements Under GDUFA” [6]和“Scale-up and post-approval changes” [7]。
相比于欧洲药监局(European Medicine Agency,EMA),FDA的变更技术指导原则分类比较简明扼要,基于变更对产品的特性、规格、质量、效价以及其他和产品安全、有效性相关的因素潜在的影响程度,将变更分成三大类:微小变更、中等变更和重大变更。各类变更有各自清晰的法规申报途径。对于微小变更,可以通过年报(Annual Report)形式通知监管机构。对于中等变更,根据中等变更的本身性质不同,也有两类申报途径:立即执行的补充申请(Supplement-Changes Being Effected,CBE-0),以及30天后执行的补充申请(Supplement - Changes Being Effected in 30 Days,CBE-30);前者意味着申请人在将变更递交至FDA后可以立刻执行变更,而后者则需要在变更申报递交至FDA后等候30天,如果30天内没有得到FDA的通知,则可以执行变更(一般来说,申请人会在30天内与FDA审评的项目负责人保持联系,以确保变更申报在FDA审评进展顺利)。对于重大变更,申请人需要递交补充申请给FDA审评审批,批准后,才能执行变更(Prior Approval Supplement,PAS)。
FDA的变更分类原则,是基于变更本身对于产品质量影响的程度。当变更发生时,需要对产品本身安全、临床效用以及质量可控进行合理评估,然后在进行相应的研究验证工作。当然,在变更技术指导原则中,FDA也阐述了各类批准后的产品在生产场地、生产工艺、处方、标准、包装容器系统,以及说明书和包装标签发生单个变更以及多个变更同时发生时,如何做出变更分类评估;同时,针对上述各类不同变更发生时,给出各种具体实例及其所属变更种类。但是由于在整个产品生命周期内,发生的变更非常多,远远超出FDA变更技术指导原则中举例的情况,因此,很多未纳入上述变更技术指导原则的变更分类,需要申请人根据产品特性和变更特性做好评估。可以理解为,FDA更多是要求申请人自身对于变更做好评估,并且完成相应的研究验证工作。另外,对于相应需要完成的具体验证研究工作,以及需要申报递交的资料,FDA并没有和EMA一样给出详细的要求以及所有变更必须符合的前提条件。FDA完全将变更评估和申报的主动权交给申请人。
FDA以这种模式管理药品、药包材还有药用辅料的变更,对整个行业至少有两点益处:
第一,FDA的变更技术指导原则完全基于质量源于设计(Quality by Design),即QbD理念。FDA于2006年提出QbD,简单来说就是产品(药品、包材和辅料)在设计之初,必须考虑到将来使用产品的对象,从对象的需求即终端用户的需求出发,设计开发产品本身,确定产品的目标产品质量概况(Quality Target Product Profile,QTPP)并且框定该产品的设计空间(Design Space,DS),进而推导出产品常规以及关键质量属性(Critical Quality Attributes,CQA),据此可以确定产品的生产工艺、关键工艺步骤、关键工艺参数(Critical Process Parameters,CPP),以及对产品有影响的关键物料属性(Critical Materials Attributes,CMA)……在产品被FDA批准后,如果有相应的变更,则通过评估这些变更对CQA以及DS的影响,来判断变更的分级。当然,这些参数也是指导产品在生产过程中的法规符合性,如果在生产过程中,某些参数超出CQA以及DS的范畴,即使最后产品检验合格,也不得上市销售。
第二,FDA的变更技术指导原则是基于产品生命周期的维护而建立,并且同时明确了变更的评估主体是产品持有人或者是变更申请人,FDA仅仅是基于申请人递交的资料来审评申请人对于变更的评估是否充分。如果有缺陷,包括变更归类出错(通常为申请人将PAS的类型归入CBE-30),FDA会提出相应补充资料要求,要求企业完善研究,并且给出合理的分类依据和足够的研究资料。由于在整个产品的生命周期中,变更的发生是经常的,FDA作为监管机构,不可能将所有可能的变更情况通过一个变更技术指导原则罗列清楚,因此,只有让产品持有人来做相应的变更评估,选择相应的变更申报途径来递交。可以说,FDA的变更技术指导原则是基于科学和技术的客观指导原则,不涉及法规流程。
但是,当包材的变更引起药品的变更时,FDA遇到最普遍的问题就是包材变更执行的时间节点问题。由于对整个药包材生命周期的监管是以药品生产企业为主,FDA仅仅是出具相应的指导原则,因此涉及的药包材变更管理,药品生产企业在其中也起着举足轻重的作用。药包材的技术资料是和药品的申报一起作为FDA关联审评的对象,因此当药包材发生变更后,其变更若触发药品的相应变更,并且递交补充申请,那么FDA也将通过对补充申请的关联审评,同时审评药包材的变更和药品的变更。当审评完成后,药包材和药品生产企业双方方可执行相关的变更。具体流程见图 1。
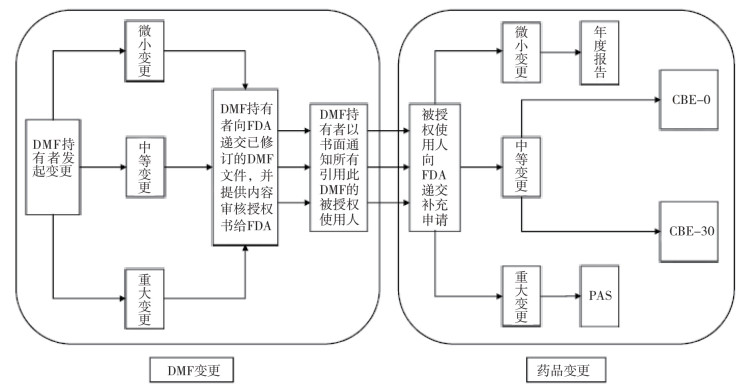
|
图 1 美国药包材变更审评流程图 |
在图 1显示的变更流程实施过程中,药包材企业(DMF持有人)的变更切换取决于药品的变更何时批准,因此,药品生产企业需要事先给包材持有人一个大概时间,使包材企业可以完成相应时间段的库存和备货,否则很容易出现包材的市场断货或者存货过多,这对于药品生产企业和包材企业都是一种损害。当FDA的审评时间不确定时,包材企业执行变更且获得时间也无法明确,从而导致在开始执行时,最普遍的现象就是药包材、药用辅料、原料药的供应商出现断货或者库存过多,产能浪费。在整个过程中,不确定因素在于FDA的审评阶段,若作为监管方的FDA明确了对于药品的三类补充申请的时限,也就规避了这个问题。
除了上述时间问题,对于FDA的监管也提出新的要求。虽然此类变更管理模式是以药品生产企业为主,但是由于药企对包材企业的监管还是片面的,无法从整个行业的大范围和大环境入手去判断和提前预防,这个时候对FDA的辅助监管能力就提出了要求,即较高水平的监管能力和比较完善的监管体系,包括现场核查、年报审查、市场抽查、不良事件发生前的预判和控制,以及发生后的救治和惩治,从而将危害降到最低。只有监管机构和整个行业相互信任,紧密合作,才能保证产品在生命周期内可以很好地保证患者得到足够的收益。
综上所述,对于药包材变更管理中“药企为主,药监辅助”的前提条件有两点:一是行业内企业的平均水平比较高,企业有能力对变更做到尽量客观和科学的评估,然后做出相应的验证和研究工作;二是监管机构具有较高水平的监管能力和比较完善的监管体系,以及公开透明的监管审批流程。
3 对我国药包材法规改革的启示FDA的DMF制度及其对包材变更的监管以及对于药包材标准的要求已经非常成熟,对于我国探索并且建立药包材上市后变更监管的制度有非常大的借鉴意义。
近三年来,随着我国药品改革,药包材的相应法规也在发生着巨大变化,最主要的就是我国原料药、药用辅料和药包材的共同审评审批制度。从新的制度上看,除了申报资料的技术要求,整个法规流程正在与FDA的DMF备案以及关联审评制度接轨。国家药品监管部门开始慢慢放权给药品生产企业,对于原料药、药用辅料和药包材的质量,以药品生产企业监管为主,药监机构主要监管药品生产企业。这样减少了政府机构参与市场运作的程度,使药品生产企业从自身利益出发,更加谨慎地选择研发强、生产稳、质量好的药包材生产企业作为供应商。
从药监角度出发,更应该清醒地认识到,我国目前药包材企业小而散乱,质量意识不足,各地包材企业能力不一,而各地监管也存在尺度的偏差。因此,国家药品监管部门需要推出与共同审评制度相关的配套法规、标准与技术指导文件,比如在《药品管理法》以及《药品注册管理办法》的修订中考虑到药包材变更对药品的影响,尽快更新完善10年前发布的《药品上市后变更技术指导原则》,出台药包材变更分类以及应开展的相关技术研究指南等等,实现政府监管、行业自律、企业自觉的多维度药品质量保证体系。
对于药包材变更,国内相关网站发布了《药包材变更研究指南(征求意见稿)》[8],将变更分为技术类变更和非技术类变更,使用范围限定在药包材生产企业发生的各类变更以及应开展的研究和评估,综合评估原则考虑基于风险和等同性。该指南对行业具有很好的指导意义,建议《药包材变更研究指南》先期在行业内作为推荐性规范,为药包材生产企业与制药企业签署质量协议作参考,同时也为制药企业对药包材企业进行供应商审计提供。
关联审评审批不是一劳永逸的完美制度,在实施过程中,特别是上市后的监管过程中还会出现这样那样的监管盲点。这就需要国家药品监督管理部门对药品上市后再评价进行规范和延伸管理,实现药品整个生命周期的监督和管理,也是对药包材在生产和使用过程中发生变更从而导致对药品质量影响的客观评价。我国实施原辅料包材与药品共同审评审批后,不仅仅是药包材,原料药和药用辅料也需要跟着药品的变更实施同时进行,实现整个行业共同进步。
 2019, Vol. 33
2019, Vol. 33 
