2. 北京中医药大学, 北京 100029
2. Beijing University of Chinese Medicine, Beijing 100029, China
环烯醚萜(Iridoids)是一类天然存在的单萜类化合物, 为蚁臭二醛的缩醛衍生物。最早于1925年, 在伊蚁(Iridomyrmex Humilis Mary)的分泌物中分离得到, 曾命名为伊蚁内酯(Iridomyrmecin),是从动物中发现的第一个抗生素[1]。天然环烯醚萜是具有环戊二烯并吡喃环基本骨架的一类单萜化合物,可分为3种主要类型:环烯醚萜苷类、裂环烯醚萜苷类和环烯醚萜乙缩醛酯类(环烯醚萜酯类)。环烯醚萜基本骨架经环氧化、羟基化及由莽草酸途径得到的芳香酸的酯化,导致了该类化合物的多样性(如图 1所示)[2]。环烯醚萜类化合物在植物中存在较为广泛,主要存在于玄参科、茜草科、唇形科、龙胆科、马鞭草科、木犀科等双子叶植物中。据不完全统计,已从植物中分离并鉴定结构的环烯醚萜类化合物超过800种,其中大多数为苷类成分,非苷类环烯醚萜仅60余种,裂环环烯醚萜类30余种[3]。
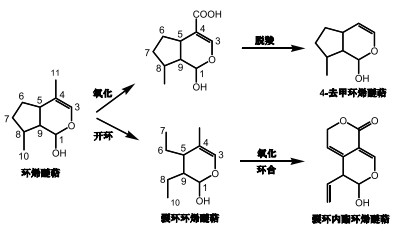
|
图 1 环烯醚萜化学结构 |
环烯醚萜类化合物的母核为环烯醚萜醇,具有环状烯醚及醇羟基。其中,醇羟基属于半缩醛羟基,性质活泼,易与糖结合,所以天然存在的环烯醚萜多为苷的形式,且多为D-葡萄糖苷。C4-CH3易氧化成-CH2OH、-CH2OR、-COOH、-COOR等,若为-COOH,脱羧后可形成降解环烯醚萜类化合物。C8-CH3也易氧化成-CH2OH、-COOH等。此外,分子中的环戊烷部分可呈现不同的氧化状态,C5-6、C6-7、C8-9间均可形成双键,C7-8可存在环氧结构,C6或C7可形成环酮结构,在C6、C7、C8等位上可连接-OH等[1, 3]。
1.1 环烯醚萜苷类如图 1中的环烯醚萜和裂环环烯醚萜为其基本骨架结构,母核内含有环戊烷结构单元。化合物由一个五元环和一个环烯醚环组成,五元环C6、C7、C8位均可有取代基(常为羟基或酯基),C6-C7、C7-C8、C8-C9、C8-C10可以为单键或双键。C1位上有取代基如羟基、甲氧基等;C1位为半缩醛羟基(β型)常与D-葡萄糖形成苷键且多为单糖苷,葡萄糖C6上羟基可与其他基团以酯基形式存在。
随着对环烯醚萜类化合物研究的不断深入, 不断有新颖的环烯醚萜类结构被发现, 如:抱茎獐芽菜(Swertia franchetiana H.Smith)中分离得到senburiside Ⅲ和senburiside Ⅳ[4], C7位苯甲酰基的间位羟基上连有一个间羟基苯甲酰基; 白骨壤(Avicenna marina)中的2′-O- (4-methoxycinnamoyl) mussaenosidic acid[5], 接木骨(Sambucus williamsii Hance)中的williamsoside A and williamsoside B[6], 地蚕中的蜜力特苷(melittoside)和新环烯醚萜苷(stageoboside A)[7]等。
环氧醚式环烯醚萜型化合物也是植物中较为常见的一类环烯醚萜类化合物,环氧醚结构存在于母核中的C7-C8或C6-C7之间,且均为β型。当C7-C8间是环氧醚结构时,C4位无取代基,C6位上连有β型羟基且常与糖形成苷键,糖基上羟基氢常被其他基团取代。还发现一类环烯醚环被氢化的C7-C8环氧醚类化合物。当C6-C7之间形成环氧醚结构时,C4位有取代基,C8上连有β型羟基或取代基[3]。在玄参(Scrophularia deserti)中分离得到Scropolioside-D2和Harpagoside-B[8]就是环氧醚式环烯醚萜型化合物,也称为4-位无取代环烯醚萜苷类。
1.2 裂环环烯醚萜苷类环烯醚萜苷的环戊烷C7-C8共价键断裂,形成裂环式环烯醚萜型化合物。分子中C8-C9或C8-C10以双键形式存在,多数情况下,C7位成酯基或连有羟基,C10位常为羟基或与另一含有羧基的分子脱水形成酯基。此外,C7位的羟基也可与C11位羧基形成环状内酯结构的六元环,其C6位羟基及糖部分的2′位上也常有取代基[3]。
近年来,大量的裂环环烯醚萜被发现,其中忍冬科金银花中发现的裂环环烯醚萜苷数量较多,毕等[9]在金银花(Lonicera japonica Thunb.)水提物中分离得到7种裂环环烯醚萜苷类化合物:vogeloside(Ⅰ)、7-epi-vogeloside(Ⅱ)、secologanic acid(Ⅲ)、sweroside(Ⅳ)、secoxyloganin(Ⅴ)、secologano side(Ⅵ)和(E)- aldsecologanin(Ⅶ)。化合物Ⅲ和Ⅶ为首次从忍冬属植物中分离得到。化合物Ⅶ是迄今为止较为罕见的通过碳碳键相连的二聚环烯醚萜苷。Dehydromorroniside是从金银花中分离得到一个新的裂环环烯醚萜苷,具有一定活性,该化合物为忍冬属中发现的第3个morroniside型裂环环烯醚萜苷[10]。女贞子为木犀科植物女贞(Ligustrumlucidum Ait.)的干燥成熟果实,具有滋补肝肾、明目、乌发等功效, 裂环环烯醚萜类化合物是其水溶性化学成分中的重要的活性成分之一[11]。张等[12]从女贞子70%乙醇提取物中分离得到一种新的裂环环烯醚萜苷类化合物,鉴定为6′-O-肉桂酰基-8-表-金吉苷酸(6′-O-cinnamoyl-8-epi-kingisidic acid)。坚龙胆(Gentiana regescens)的根中分离得到1个新的裂环烯醚萜苷,命名为坚龙胆苷A(geniforigenoside A)[13]。
1.3 环烯醚萜乙缩醛酯类环烯醚萜苷易被水解,生成的苷元为半缩醛结构,具有活泼的化学性质,容易进一步聚合,难以得到结晶苷元。据报道,蜘蛛香(Valeriana jatamansi Jones)属于败酱科缬草属蜘蛛香,含有较高的环烯醚萜类成分,其中包括双烯型环烯醚萜和单烯型环烯醚萜成分,其中缬草环状结构在缬草中起了重要作用,其结构如图 2所示。
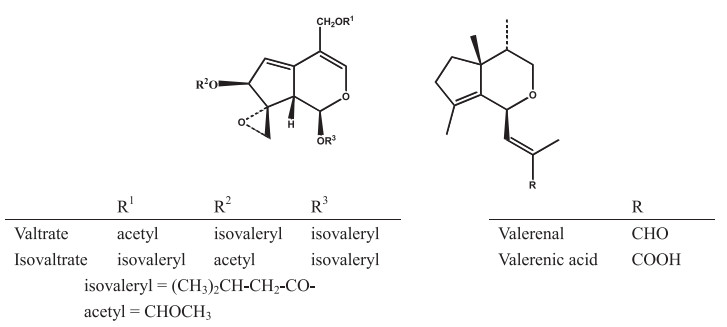
|
图 2 缬草环烯醚萜化学结构 |
缬草醚酯是单萜环烯醚萜成分,没有糖结构[14]。它们受热不稳定,在酸性条件和碱性条件下均会发生降解[15]。Thies和Funke于1966年首次从缬草中分离得到环烯醚萜类化合物—缬草三酯。缬草醚酯的酯基团产生baldrinals,这个反应发生在胃肠道、缬草的根或者它的提取物中,降解为非活性的产物。环烯醚萜酯类化合物多见于缬草属植物中[16]。
2 环烯醚萜的生物学活性环烯醚萜类化合物作为天然药物和传统的中药有效成分,其主要功效为神经系统的保护作用、抗肿瘤作用、保肝作用等多种生物学功效。不同环烯醚萜由于结构不同,所具有的生物学活性和剂量依赖性也有差异[17]。
2.1 在神经系统中的作用中枢神经系统(CNS)的再生和修复是一个多环节、多影响因素的复杂过程。造成CNS损伤后再生与修复失败的原因主要有3点:① CNS损伤导致继发性损伤,大量神经元死亡;② CNS受损神经元细胞外微环境含大量阻止神经再生的抑制因子;③有丝分裂后的神经元内在的再生能力减弱。环烯醚萜类化合物大多有着神经系统保护和调节作用,下面介绍几种常见的对神经细胞具有保护作用的富含环烯醚萜类化合物的植物及其代表化合物。
蜘蛛香有效延长戊己比妥钠导致的小鼠睡眠时间,提高阀下剂量戊己比妥钠小鼠入睡数,具有较好的镇静催眠作用。同时,水提取物可减弱吗啡引起的小鼠竖尾反应,对抗印防己毒素、硫代氨基腺诱发小鼠惊厥等作用,有明显的镇静催眠活性[18]。实验表明,蜘蛛香水提物可刺激大鼠脑突出释放GABA递质,GABA释放可抑制GABA(A)受体活性,从而使大脑皮质细胞由兴奋转为抑制,进而发挥镇静和促眠作用[14]。闫等[19]于2013年公开了一种蜘蛛香中环烯醚萜类新化合物,结构如图 3所示,该化合物可对谷氨酸损伤的神经细胞有明显的保护作用,且可用于中枢神经系统疾病如脑梗死、阿尔茨海默病、焦虑症等神经症的预防和治疗。
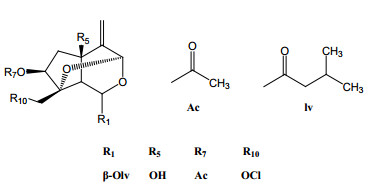
|
图 3 蜘蛛香新化合物结构 |
西藏胡黄连(Picrorrhiza scrophulariaeflora Pennell)为常用中药材,主要成分是环烯醚萜类、葫芦素类和酚苷类。研究表明,胡黄连苷-Ⅱ为西藏胡黄连的主要有效成分。胡黄连苷-Ⅱ化合物可明显缓解H2O2对PC12神经细胞损伤作用。其可能的作用机理:①直接减少细胞内的氧自由基,或提高PC12细胞内抗氧化酶活性抑制自由基;②增强PC12细胞抗氧化的功能,从多个环节阻断自由基对细胞的损伤作用;③可能是通过保护细胞膜、线粒体膜,促进SOD等细胞内抗氧化酶合成而降低细胞内氧自由基。胡黄连苷-Ⅱ具有诱导PC12神经细胞轴突生长的作用,又可直接清除细胞内自由基等毒性物质,对损伤的PC12细胞具有保护作用[20]。应用胡黄连糖苷对痴呆小鼠模型进行试验治疗,给药组小鼠与模型组相比血清和脑内SOD活性显著升高,MDA含量显著降低。可推断胡黄连糖苷具有增强抗氧化活力,清除异常的活性氧自由基和抗脂质过氧化的作用,这可能是胡黄连糖苷拟用于治疗痴呆的一个很重要的原因[21]。郭等研究胡黄连苷Ⅱ对缺血再灌注损伤(Ischemia-reperfusion Injury,IRI)后脑组织Toll样受体4(Toll-like Receptor 4,TLR4)和核转录因子кB(Nuclear Transcription Factor кB,NFкB)表达的影响。IRI是由兴奋性氨基酸中毒、氧化应激、细胞内钙超载、炎症反应和细胞凋亡等多种因素参与的病理过程。炎性因子刺激细胞膜表达的TLR4受体,激活下游的NFкB通道,促进诸如肿瘤坏死因子、白细胞介素、细胞黏附分子等靶基因激活,最终诱导神经细胞凋亡。实验表明,胡黄连苷Ⅱ可下调TLR4的表达,抑制NFкB的激活,阻止大鼠IRI炎症反应诱导的细胞凋亡[22]。IRI损伤后,缺血半影区神经细胞凋亡具有延迟性和可逆性。半胱天冬酶家族是哺乳动物细胞凋亡的启动者和执行者,其中Caspase-3是启动Caspases级联“瀑布”下游最关键的凋亡蛋白酶。IRI损伤后,细胞外各种死亡信号通过Fas受体途径激活Caspase-8,细胞内线粒体细胞色素C途径激活Caspase-9。活化的Caspase-8和Caspase-9继而激活Caspase-3,水解特异性细胞蛋白和多聚腺苷酸二磷酸核糖聚合酶(PARP),诱导细胞凋亡。胡黄连苷Ⅱ可能通过下调Caspase-3和PARP表达,抑制IRI损伤诱导的神经细胞凋亡,从而改善动物的神经行为功能[23]。
山茱萸(Corus officinalis Sieb. Et Zucc)为山茱萸科(Cornaceae)山茱萸属(Cornus)植物山茱萸的干燥成熟果肉,主要含多糖、有机酸、环烯醚萜苷类化合物。其中,山茱萸的环烯醚萜总苷类成分主要包括马钱苷、莫诺苷、獐牙菜苷等成分[24]。山茱萸中医临床用于眩晕耳鸣、崩漏带下、大汗虚脱等症。张等[25]实验证实,山茱萸有效成分环烯醚萜苷能够明显保护缺血再灌注脑损伤大鼠神经功能和神经元,对大鼠局灶性脑缺血有明显改善作用。穹隆海马伞切断可导致海马锥体细胞及齿状回颗粒细胞减少50 % ~ 60 %,细胞肿胀,排列紊乱疏松,尼氏体明显减少;山茱萸的环烯醚萜总苷给药治疗后,神经元排列基本规则,细胞增多,尼氏体较丰富,山茱萸的环烯醚萜总苷能够显著减少神经元死亡数量[26]。
2.2 在抗肿瘤中的作用人们对肿瘤的认识不断深入,但是,对肿瘤治病机理的研究还停留在很多假说之中。原癌细胞和正常细胞是否和平共处,在何种刺激下会使机体诱发肿瘤,肿瘤的人群特异性又和哪些遗传和环境因素有关,这些问题一直困扰着科学界。在中医经典中,也有对于肿瘤的发病机理的阐述,《内经》中记载:“寒气客于肠外,与卫气相搏,气不得营,因有所系,癖而著内,恶气乃起,息肉乃生,其始得也,大如鸡卵”“积之始生,得寒乃生”“邪之所凑,其气必虚”“壮人无积,虚人有之”“内伤于忧怒……而积聚成矣。”不难看出,肿瘤的发生与邪气(寒气)、脏腑功能低下以及情志抑郁等因素有关。而用现在医学解释,邪气可能与环境中的病毒、细菌、污染等有关系,脏腑功能低下会影响机体免疫能力,情志抑郁会使气血不畅,机体自身毒素大量积累产生毒性物质,临床研究也表明肿瘤患者多伴有抑郁症等情志疾病。由此表明,中西方在对于肿瘤的机理的论述,有很多相似之处。目前的化疗和放疗治疗肿瘤的方法,对于正常细胞的杀伤力很大,对人体有很大毒性。对于天然药物抗肿瘤的研究,一直是科学家们研究的热点。由上文可知,环烯醚萜类化合物对于调节神经系统、抗抑郁方面有很好的作用。对于其抗肿瘤作用的研究也在不断深入。
研究表明,缬草属环烯醚萜类化合物同样具有一定的抗肿瘤作用,其机理可能与抗氧化应激相关。薛等[27]研究表明缬草环烯醚萜苷和环烯醚萜酯对多种肿瘤细胞均有细胞毒作用,其抗肿瘤活性强度为双烯键结构的环烯醚萜>单烯键结构的环烯醚萜>环烯醚萜苷。糙叶败酱(Patrinia scabra Bunge)为败酱科(Valerian aceae)败酱属(Patrinia)多年生草本,常以干燥根及根茎或鲜品入药,其味辛、苦、微寒;具有清热解毒,燥湿止带,怯淤止痛,收敛止血之功效。糙叶败酱中环烯醚萜苷元成分[28]具有促进人前列腺癌细胞株DU145和PC3增殖的作用。墓头回(Patriniae Radix)系败酱科植物异叶败酱(Patrinia heterophylla Bunge)及糙叶败酱(P. scabra Bunge)的根及根茎,民间常用于治疗恶性肿瘤,疗效显著。墓头回提取物环烯醚萜酯部位(PHEBB),其体内外均具有一定抗肿瘤作用,且其抗肿瘤机制可能与诱导肿瘤细胞凋亡及抑制肿瘤微血管有关。抗肿瘤作用机制研究结果显示,PHEBB能上调促细胞凋亡蛋白Bax表达,下调抑制细胞凋亡蛋白Bcl-2的表达。因此,破坏促细胞凋亡因子与抑细胞凋亡因子的动态平衡,诱导瘤细胞凋亡,可能是PHEBB抑制小鼠移植性肿瘤的作用机制之一。免疫组化检测结果显示,PHEBB能降低H22小鼠瘤组织微血管密度。因此,抑制小鼠瘤组织中微血管增殖,亦是PHEBB抗肿瘤作用机制之一[29]。鸡屎藤环烯醚萜苷类成分主要包括鸡屎藤苷、鸡屎藤次苷、鸡屎藤苷酸、车叶草苷和少量的脱乙酰车叶草苷、车叶草酸、熊果酚苷和京尼平苷酸等。研究表明,鸡屎藤环烯醚萜苷类成分对不同肿瘤细胞系的增殖抑制作用并不相同,其中对人肺癌细胞系和人白血病细胞系未发现有增殖抑制作用,对人胃腺瘤细胞系较敏感,对人结肠癌细胞系、人乳腺癌细胞系和人子宫颈癌细胞系均有一定的敏感性。可能的机制有下调抑制细胞凋亡蛋白Bcl-2的表达,上调促细胞凋亡蛋白Bax表达,从而破坏细胞凋亡因子在细胞中的动态平衡,诱导肿瘤细胞的凋亡,也有研究表明,通过抑制p53/MDM2及其介导的信号通路,从而实现肿瘤细胞的凋亡[30]。筋骨草属植物金疮小草(Ajuga decumbens Thunb.)分离得到的8-O-乙酰基哈帕苷以及车叶草苷酸均可抑制EBV病毒诱导的十四酰基佛波醋酸酯(TPA),可能具有潜在的抗肿瘤作用[31-32]。茜草科植物海巴戟分离等到的2种环烯醚萜化合物citrifolinin A和critrifolinoside可以显著抑制细胞内UVB诱导的AP-1蛋白活性[32]。
2.3 抗炎作用炎症是生物体对外源性致炎因子及局部损伤所产生的以血管渗出为中心的防御性反应,其过程是导致机体组织、细胞病变,组织细胞变性坏死;机体血管渗出性反应;局限杀灭损伤因子和局部组织细胞的增生,修复损伤组织,抗损伤能力大于损伤程度,表现为炎症痊愈;损伤程度大于抗损伤能力,表现为炎症蔓延扩散;抗损伤能力与损伤程度相当,表现为炎症迁延不愈。
独一味为唇形科独一味属植物独一味(Lamiophlomis rotate Benth.Kudo)的全草或根, 是我国藏、蒙、纳西等少数民族常用药物之一, 具有镇痛消炎的功效。独一味地上部分含有环烯醚萜苷类和黄酮类成分。其中, 山栀子苷甲酯和乙酰山栀子苷甲酯对LPS诱导巨噬细胞释放NO有明显的抑制作用, 特别是山栀子苷甲酯的抑制作用更强[33]。乙酰山栀子苷甲酯、Phloyoside Ⅱ和山栀子苷甲酯均具有抑制LPS诱导巨噬细胞释放PGE2的作用。
京尼平(Genipin)是栀子苷经β-葡萄糖苷酶水解后的产物,具有显著地抗脂质过氧化的作用,可抑制巴豆油所导致的小鼠耳水肿,说明其具有局部抗炎活性。京尼平对LPS/IFN-γ诱导巨噬细胞NO的生成及iNOS表达均有抑制作用。研究[34]表明,京尼平的抗炎作用与NF-кB/IкB-β通路、抑制NO生成和抗血管生成活性相关。
秦艽为植物秦艽(Gentiana macrophylla Pall)、麻花秦艽(Gentiana straminea Maxim)、粗茎秦艽(Gentiana crassicaulis Duthie ex Burk)和小秦艽(Gentiana dahurica Fisch)的干燥根[35],主要产于陕西、甘肃、四川、青海、西藏等地[36]。秦艽始载于《神农本草经》,列为中品:“秦艽主寒热邪气,寒湿风痹,肢节痛、下水、利小便”。研究表明,秦艽中的环烯醚萜类成分具有抗炎的作用。叶等[37]研究表明,龙胆苦苷、栽培品种总环烯醚萜苷(包括胡麻属苷、落干酸、山栀苷甲酯、6'-O-β-D-葡萄糖基龙胆苦苷、獐牙菜苦苷、龙胆苦苷)和野生品种总环烯醚萜苷(包括落干酸、秦艽苷A、山栀苷甲酯、6'-O-β-D-葡萄糖基龙胆苦苷、獐牙菜苦苷、龙胆苦苷、獐牙菜苷、dehydropentstemoside)均能通过抑制了MAPKs途径中P38、ERK、JNK的磷酸化,降低COX-2的表达,减少PGE2的产生,使MMP-1、MMP-3、MMP-13的表达降低,达到抑制Ⅱ型胶原降解的目的,对软骨细胞有一定的保护作用。
2.4 对糖尿病的相关作用糖尿病是一种慢性血糖状态异常所引发的机体内分泌代谢紊乱综合征。胰腺分泌的胰岛素能促进全身各部位组织摄取葡萄糖,并促进其对葡萄糖的储存和利用。当胰岛素分泌不足时,首先引起糖代谢障碍;由于胰岛素缺乏,对于肝糖原和肌糖原分解抑制减弱,对糖原异生及肝糖生成的抑制过程减弱,从而引起肝糖原输出增多,糖原分解增多,导致高血糖的产生。
山茱萸作为我国传统的名贵滋补中药材,在临床糖尿病的治疗方面有着广泛的应用。其药用历史已有两千余年,始载于《神农本草经》“治心下邪气寒热,温中逐寒湿痹,去三虫,久服轻身”,其性酸、涩,微温,归肝、肾经,具有补益肝肾和涩精固脱之功效[38]。研究表明,山茱萸环烯醚萜总苷(马钱苷、莫诺苷、獐牙菜苷等),具有防治糖尿病肾病、糖尿病视网膜病变、保护糖尿病大鼠主动脉内皮等作用。王等[39]研究认为,马钱苷、莫诺苷、獐牙菜苷这3种化合物均含有数个供电子基团-羟基,羟基通过释放氢原子并与自由基结合,阻断活性氧介导的链式反应,降低机体氧化应激水平,使得P65、ERK1/2、JNK1/2和P38蛋白避免受到氧化应激刺激而磷酸化活化,进一步抑制NF-кB和MAPKs炎症信号通路激活,从而抑制炎症反应发生来改善胰岛素抵抗和肝损伤。
此外,环烯醚萜类化合物还有保肝护肝作用,如栀子中的京尼平和草苁蓉中的环烯醚萜;保护心血管治疗冠状动脉硬化,如白花蛇草中的栀子酸、鸡矢藤苷和去乙酰车野草苷酸;抑制DNA合成酶活性,如梓醇、8-O-乙酰基哈帕苷和哈帕苷等生物学作用。
3 结语众所周知,环烯醚萜类化合物分布广泛,我国大部分民族均有悠久的使用记载,具有抗肿瘤、抗抑郁、保肝、神经保护作用等多种生物学作用。环烯醚萜类化合物为植物提取化合物,相关提取物已作为保健品销售,并鲜有副作用的报道。但是,由于环烯醚萜类化合物不稳定,在物理和化学条件下均产生降解,这阻碍了对其活性和功能的研究,其单体的研究相对有限。近年来,随着提取方法和贮存条件的不断改进,越来越多的环烯醚萜类化合物被发现,对它们的功能研究也成为天然产物的新热点。但是,目前对于大部分环烯醚萜类化合物的研究还停留在对其结构的确定和对某些活性的分析。对于环烯醚萜的结构类型、构效关系、生物活性等方面缺乏系统的研究。因此,通过对已知环烯醚萜结构和功能的分析和对比研究,可以更好地推断出其主要活性作用基团和作用特点,为化学修饰和新药开发提供有效的数据支持。
| [1] |
周荣汉, 周自新. 有发展前途的植物次生物质-环烯醚萜类[J]. 植物科学学报, 1984, 2(2): 317-320. |
| [2] |
乔卫, 张产文. 天然环烯醚萜类化合物的生物活性[J]. 现代药物与临床, 2001, 16(2): 65-67. |
| [3] |
郭建华, 田成旺, 刘晓, 等. 中药环烯醚萜类化合物研究进展[J]. 药物评价研究, 2011, 34(4): 293-297. |
| [4] |
Wang S, Zhao W X, Liang X. Two New Iridoid Glycosides from the Tibetan Folk Medicine Swertia Franchetiana[J]. Chemical & Pharmaceutical Bulletin, 2005, 53(6): 674-676. |
| [5] |
Behbahani M. Evaluation of Anti-HIV-1 Activity of A New Iridoid Glycoside Isolated from Avicenna Marina, in vitro[J]. International Immunopharmacology, 2014, 23(1): 262-266. DOI:10.1016/j.intimp.2014.09.003 |
| [6] |
Wang Z Y, Han H, Yang B Y, et al. Two New Iridoid Glycosides from the Root Barks of Sambucus Williamsii Hance[J]. Molecules, 2012, 17(2): 3869-3874. |
| [7] |
Zhou X, Huang S, Wang P, et al. A Syringic Acid Derivative and Two Iridoid Glycosides from the Roots of Stachys Geobombycis and Their Antioxidant Properties[J]. Natural Product Research, 2017, 1: 1-6. |
| [8] |
Ahmed B, Jathlan A R A, Abdullah A H T, et al. Scropolioside-D2 and Harpagoside-B:Two New Iridoid Glycosides from Scrophularia Deserti and Their Antidiabetic and Antiinflammatory[J]. Biological & Pharmaceutical Bulletin, 2003, 26(4): 462-467. |
| [9] |
毕跃峰, 田野, 裴姗姗, 等. 金银花中裂环环烯醚萜苷类化学成分研究[J]. 中草药, 2008, 39(1): 18-21. DOI:10.3321/j.issn:0253-2670.2008.01.007 |
| [10] |
李会军, 李萍, 王闽川, 等. 金银花中一个新的裂环环烯醚萜苷[J]. 中国天然药物, 2003, 1(3): 132-133. |
| [11] |
李阳, 孙文基. 女贞子中2种主要裂环环烯醚萜苷类成分的含量考察[J]. 中国中药杂志, 2008, 33(18): 2099-2102. DOI:10.3321/j.issn:1001-5302.2008.18.022 |
| [12] |
张廷芳, 段营辉, 屠凤娟, 等. 女贞子中一个新的裂环环烯醚萜苷类成分[J]. 中草药, 2012, 43(1): 20-22. |
| [13] |
许敏, 王东, 张颖君, 等. 坚龙胆中的一个新裂环烯醚萜甙[J]. 植物分类与资源学报, 2006, 28(6): 669-672. |
| [14] |
Smet P A G M D, Keller K, Hänsel R, et al. Adverse Effects of Herbal Drugs[M]. Springer Berlin Heidelberg, 1997.
|
| [15] |
Houghton P J. Valerian:the Genus Valeriana[M]. Crc Press, 1997.
|
| [16] |
Lin S, Shen Y H, Li H L, et al. Acylated Iridoids with Cytotoxicity from Valeriana Jatamansi[J]. Journal of Natural Products, 2009, 72(4): 650-655. DOI:10.1021/np800716f |
| [17] |
董天骄, 崔元璐, 田俊生, 等. 天然环烯醚萜类化合物研究进展[J]. 中草药, 2011, 42(1): 185-194. |
| [18] |
王珍.褪黑素受体探针对镇静安神类中药成分的鉴定研究[D].昆明: 昆明理工大学, 2016.
|
| [19] |
闫智勇, 左长英, 林玉, 等.一种环烯醚萜类新化合物及其神经保护作用: 中国, CN103145724A[P]. 2013.
|
| [20] |
陶移文, 刘建文, 魏东芝, 等. 胡黄连苷-Ⅱ在体外对PC12神经细胞损伤的保护作用[J]. 中国临床药理学与治疗学, 2003, 8(1): 27-30. DOI:10.3969/j.issn.1009-2501.2003.01.007 |
| [21] |
李婷, 刘建文, 曹艳, 等. 胡黄连糖甙对拟痴呆模型小鼠的神经保护作用[J]. 华东理工大学学报:自然科学版, 2006, 32(5): 544-547. |
| [22] |
郭云良, 沈卫, 杜芳, 等. 胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤后TLR4及NFκB表达的影响[J]. 中国中西医结合杂志, 2011, 31(1): 58-61. |
| [23] |
李琴, 郭云良, 李震, 等. 胡黄连苷Ⅱ对大鼠脑缺血/再灌注损伤Caspase-3和PARP表达的影响[J]. 中国药理学通报, 2010, 26(3): 342-345. |
| [24] |
李伟, 许惠琴, 陶玉菡, 等. RP-HPLC法测定山茱萸环烯醚萜总苷中马钱苷和莫诺苷含量[J]. 南京中医药大学学报, 2014, 30(1): 90-92. |
| [25] |
张丽, 李春阳, 赵玲, 等. 山茱萸环烯醚萜苷对局灶性脑缺血模型大鼠神经功能和神经元损伤的影响[J]. 中国康复理论与实践, 2007, 13(3): 201-202. DOI:10.3969/j.issn.1006-9771.2007.03.001 |
| [26] |
丁月霞, 张丽, 叶翠飞, 等. 山茱萸环烯醚萜苷对穹隆海马伞切断大鼠海马区神经元存活和细胞凋亡调控因子的影响[J]. 首都医科大学学报, 2011, 32(1): 73-78. DOI:10.3969/j.issn.1006-7795.2011.01.015 |
| [27] |
薛存宽, 何学斌, 张书勤, 等. 缬草环烯醚萜抗肿瘤作用的实验研究[J]. 现代中西医结合杂志, 2005, 14(15): 1969-1972. DOI:10.3969/j.issn.1008-8849.2005.15.014 |
| [28] |
毛俊琴, 李铁军, 邱彦, 等. 糙叶败酱中环烯醚萜苷元成分抗结肠癌作用的实验研究[J]. 药学实践杂志, 2007, 25(1): 10-12. DOI:10.3969/j.issn.1006-0111.2007.01.004 |
| [29] |
杨波, 王一奇, 程汝滨, 等. 墓头回环烯醚萜酯提取部位抗肿瘤作用及机制研究[J]. 中草药, 2013, 44(20): 2884-2888. |
| [30] |
李红霞, 杨磊, 陈小丽, 等. 鸡矢藤环烯醚萜苷体外抗肿瘤活性研究[J]. 中国药师, 2017, 20(12): 2117-2122. DOI:10.3969/j.issn.1008-049X.2017.12.006 |
| [31] |
Takasaki M, Yamauchi I, Haruna M, et al. New Glycosides from Ajuga Decumbens[J]. Journal of Natural Products, 1998, 61(9): 1105. DOI:10.1021/np980148k |
| [32] |
Toshihiro Akihisa, Kazumi Matsumoto, Harukuni Tokuda, et al. Anti-inflammatory and Potential Cancer Chemopreventive Constituents of the Fruits of Morinda Citrifolia(Noni)[J]. Journal of Natural Products, 2007, 70(5): 754-757. DOI:10.1021/np068065o |
| [33] |
尚小飞.独一味环烯醚萜苷镇痛抗炎作用及其机理研究[D].兰州: 兰州大学, 2010.
|
| [34] |
Koo H J, Song Y S, Kim H J, et al. Antiinflammatory Effects of Genipin, An Active Principle of Gardenia[J]. European Journal of Pharmacology, 2004, 495(2): 201-208. |
| [35] |
国家药典委员会. 中华人民共和国药典:一部[M]. 北京: 中国医药科技出版社, 2015.
|
| [36] |
张兴旺, 牛迎风, 陶燕铎, 等. 秦艽中龙胆苦苷提取工艺研究[J]. 中药材, 2009, 32(4): 625-627. DOI:10.3321/j.issn:1001-4454.2009.04.048 |
| [37] |
叶娟.黄管秦艽中总环烯醚萜苷、龙胆苦苷对IL-1β诱导大鼠软骨细胞损伤的保护作用及机制研究[D].兰州: 甘肃中医学院, 2014.
|
| [38] |
叶贤胜.中药山茱萸的化学成分和生物活性研究[D].北京: 北京中医药大学, 2017.
|
| [39] |
王世伟, 徐宁. 山茱萸环烯醚萜总苷对小鼠胰岛素抵抗和非酒精性肝损伤的改善作用及其机制研究[J]. 天津中医药, 2017, 34(3): 195-199. |
 2019, Vol. 33
2019, Vol. 33 
