2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
能力验证是利用实验室间比对, 按照预先制定的准则评价参加者的能力[1]。能力验证是检测和校准实验室质量保证的一个重要组成部分, 也是评估实验室检测能力的一种手段, 在国家认可准则中明确规定检测和校准实验室应满足在其认可领域参加相应频次的能力验证[2]。
容量分析法具有准确、精密等优点, 因此, 作为化学原料药含量测定的首选方法被广泛采用, 其中电位滴定法是根据滴定过程中电极电位(电池电动势)的变化来确定终点的一种电化学分析方法。采用电位滴定法测定含量的影响因素较多, 如电极的状态, 仪器的精密度, 滴定液的配制、标定与贮藏等。为考察评价各相关实验室容量分析法的准确性, 提高检测能力, 原国家食品药品监督管理总局开展了电位滴定法测定尼美舒利含量能力验证计划(编号NIFDC-PT093), 并指定中国食品药品检定研究院组织, 由广东省药品检验所负责实施。
1 能力验证计划方案 1.1 样品设计和制备本次能力验证计划样品设计采用"分割水平"设计, 制备两个能力验证物品具有类似(但不相同)水平的被测量[3], 一个是未添加辅料的尼美舒利原料, 一个是添加5%(w/w)中间体物料的原料, 并将参加者分为三个组别, 每个组别对应不同的样品组合(即低浓度、高浓度; 低浓度、低浓度; 高浓度、高浓度), 每个实验室收到的2份样品有可能浓度相同, 也可能浓度不同, 以避免在同一轮能力验证中使用两个完全相同的能力验证物品带来的数据串通问题[4]。
按配方准备尼美舒利以及中间体物料, 过筛, 混合均匀后, 分装至低硼硅玻璃管制注射剂瓶中, 冲氮, 加塞, 扎铝盖密封。每个水平共制备710瓶, 每瓶净重1.0 g, 室温保存。
1.2 样品均匀性和稳定性考察按照抽样量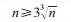
能力验证统计方法的选择取决于结果总体分布特征, 应首先考察参加实验室的结果分布, 以选择适宜的统计方法[6-10]。本计划从回收结果的分布来看, 整体数据近似于正态分布, 适宜使用Robust统计技术。采用稳健统计技术处理检测结果, 分别计算总计统计量, 并采用Z比分数作为能力统计量[6]。若|Z|≤2, 则结果为满意; 若2 < |Z| < 3, 则结果为可疑; 若|Z|≥3, 则结果为不满意。对于参加实验室的评价, 若2份样品结果均为满意, 实验室评价结果为满意; 若1份样品结果为不满意, 实验室评价结果为不满意; 若1份样品结果为可疑, 另1份为满意, 或2份样品结果均为可疑, 实验室评价结果为可疑。
2 统计结果与分析 2.1 样品的均匀性和稳定性检验结果采用单因子方差分析(One Way ANOVA)进行样品的均匀性检验, 低浓度样品中尼美舒利含量的均值统计量F低=1.54;高浓度样品中尼美舒利含量的均值统计量F高=1.07, 均小于F0.05(14, 15)= 2.42, 表明在0.05显著性水平时, 样品是均匀的。采用t检验法评价样品在发样前、结果回收后以及在5℃、40℃, RH75%条件下放置15天与0天(即均匀性检验)的尼美舒利含量测定结果的一致性, 结果无显著性差异(P>0.05), 表明样品在本计划运作期间是稳定的。
2.2 含量测定能力验证结果本计划共有157家实验室报名, 最终共153家实验室反馈结果, 参加实验室分布于26个省(自治区、直辖市), 其中省级以上食品药品检验机构27家, 地市级食品药品检验机构112家, 此外, 还包括科研院所、企业实验室等14家其他机构。
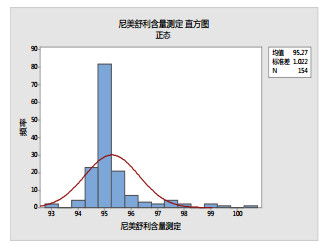
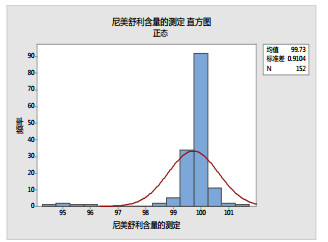
将反馈的结果绘制直方图并进行正态拟合。低浓度样品(图 1)和高浓度样品(图 2)的检测结果的直方图均为单峰, 并具有一定的对称性, 可看作均满足近似正态分布, 根据ISO规定[11], 可采用CNAS推荐的中位值稳健统计方法进行结果评价[6], 各实验室测定结果的综合统计量汇总见表 1。
|
图 1 参加者检测结果(低浓度样品)直方图 |
|
图 2 参加者检测结果(高浓度样品)直方图 |
|
|
表 1 综合统计量汇总表 |
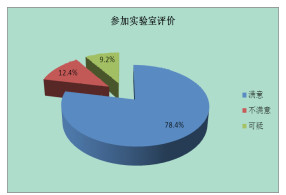
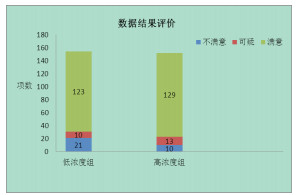
反馈结果的实验室中, 共33家可疑或不满意, 占实验室总数的21.6%(图 3), 其中19家不满意(12.4%), 14家可疑(9.2%)。省级以上食品药品检验机构的满意率(92.6%)高于地市级食品药品检验机构的满意率(75.0%)和科研院所与企业实验室等其他机构的满意率(78.6%)。由于参加者均可收到2份样品(不同组合方式), 结果分别按高低浓度组别统计, 其中低浓度组有21项结果不满意, 10项结果可疑, 123项结果满意; 高浓度组有10项结果不满意, 13项结果可疑, 129项结果满意(图 4)。
|
图 3 参加实验室评价图 |
|
图 4 数据结果评价图 |
本次计划推荐的检测方法为《中国药典》 2015年版二部尼美舒利含量测定方法, 该法涉及的电位滴定法技术细节可参照《中国药品检验标准操作规范》的要求[12]。根据各实验室反馈的测定结果和提供的原始记录进行技术分析, 造成检测结果偏差的影响因素主要包括滴定液、电极、电位滴定仪、空白试验和溶剂等。
3.1 滴定液滴定液是具有量值溯源与量值传递的标准溶液, 其浓度的准确性直接影响测定结果[13]。本方法采用氢氧化钠滴定液(0.1 mol·L-1)进行滴定, 由于氢氧化钠本身含有一定的碳酸钠杂质, 在制备过程中需配制为饱和溶液后静置数日, 使碳酸钠沉淀, 取上清液备用。滴定液标定时采用的滴定管、移液管应经检定合格, 且将其校正体积在计算中予以补偿。滴定液浓度值应为其标示值的0.95~1.05[12], 且应在有效期内(3个月)使用。但收到的结果显示有些参加者的滴定液浓度值超出范围。建议实验室人员在标定中发现其浓度值超出规定0.95~1.05时, 应加入适量的溶质或溶剂予以调整。
滴定液的贮藏也会影响测定结果。由于玻璃的主要成分是二氧化硅, 长时间与氢氧化钠接触会使得其被分解, 因此, 氢氧化钠的饱和溶液及氢氧化钠滴定液不能长期放置在玻璃容器中, 更不能采用玻璃容器来保存。若贮存于不附有钠石灰管的聚乙烯塑料瓶中, 则在贮存后的使用时, 应注意其浓度值的改变, 必要时应重新标定。氢氧化钠饱和溶液在贮存过程中, 液面上因吸收二氧化碳而生成少量的碳酸钠膜状物; 在取用澄清的氢氧化钠饱和溶液时, 宜用刻度吸管插入溶液的澄清部分吸取(注意避免吸管内的溶液倒流而冲浑), 以免因混入碳酸钠而影响浓度[12]。由于参加实验室原始记录中无法体现贮藏容器的信息及配制过程中的操作细节, 建议可疑或不满意结果的实验室对其滴定液配制与标定的准确性进行核查, 在原因分析中加以考虑。
3.2 电极和电位滴定仪自动电位滴定仪是滴定到达终点时, 因被分析成分的离子浓度急剧变化而引起指示电极的电位突减或突增[14], 而使滴定自动停止, 故试验中采用的电位滴定仪及所用的电极对结果有着决定性影响。
总体而言, 多电极系统抗干扰能力要强于复合电极系统[15]。本次计划中有个别参加者采用pH计电极, 通过记录滴定液体积和电位值, 绘制滴定曲线。由于手动电位滴定所需时间较长, 相关环境因素的影响应加以考虑, 而且滴定增量、滴定速度、搅拌速度的差异也会影响试验结果。
绝大部分参加实验室采用自动电位滴定仪, 设备性能是否完好、是否计量合格、滴定参数的设置、电极的状态等均会影响试验结果。自动电位滴定仪参数的设置主要包括滴定模式、滴定增量、搅拌速度及滴定终点的判断标准。等体积等当点滴定(MET)在滴定过程中每步添加的滴定液体积不变, 适用于反应较缓慢的滴定或响应较迟缓的电极, 如非水滴定、表面活性剂滴定、空白测定; 而动态等当点滴定(DET)则保证每次加液时测量值的变化相同, 最佳加液体积由之前加液后的测量值变化计算得出, 适用于信号波动相对较大的滴定或电位陡然突变的滴定。参加者若在正式试验前未对具体参数进行预试验研究, 有可能导致试验结果偏差。由于反馈的原始记录中信息有限, 无法体现具体参数的设置, 建议结果可疑或不满意的实验室在查找原因时予以考虑。
此外, 手动电位滴定所用的滴定管的体积以及自动电位滴定仪中用于定量的滴定管的体积是否经过校准, 也会直接影响测定结果的准确性。
3.3 空白试验作业指导书中要求同时进行空白试验, 即空白与样品同法处理, 并将样品滴定结果用空白值校正。由于空白消耗的体积较小, 因此, 其微小差异容易导致最终结果有较大偏差, 空白应做2份。个别实验室存在在多份空白中挑选2份进行平均后进行样品测定的情况, 而并非连续测定2份空白样品, 待平行后再进行样品测定, 而出现可疑结果。由于本法采用电位滴定法, 如空白为非连续测定结果, 系统和电极的稳定性难以保证, 建议结果可疑或不满意的实验室在查找原因时对此予以分析。
3.4 溶剂用于溶解尼美舒利的溶剂为中性丙酮, 需用氢氧化钠试液调节至中性(酚酞指示液显中性), 酚酞指示液会沉积在容器底部, 颜色不明显, 对是否为中性的判断易受人为因素影响, 也可能导致空白值较高而影响测定结果。
3.5 组织方计划设计为防止个别参加实验室通过与其它实验室的结果进行比较, 调整后再行上报, 影响能力验证结果评价的有效性, 能力验证提供者应在能力验证计划开始之前制定验证方案, 并提供防止参加者串通或伪造结果的合理预警措施[3]。因此, 本次计划在样品设计、样品发放等方面采取一定措施有效地保证能力验证结果评价, 可为其他机构组织实施能力验证计划提供参考。如样品采用"分割水平"设计, 编号时以序号表示, 不增加"A""B"等字符, 使参加者无法从编号上辨识样品的区别[4]; 而样品分发分组设计的原则为邻近地市或同一单位的不同实验室分别在不同组别。
本次计划有2家单位(单位1、单位2), 分别以不同地点的两个实验室报名参加, 分发样品时对同一单位的其中一个实验室发放低浓度、低浓度样品; 另一实验室发放高浓度、高浓度样品。单位1的两个实验室结果评价均为满意, 而单位2的其中一个实验室结果评价为不满意, 而该实验室对应的样品组别为高浓度、高浓度, 而上报结果却落在低浓度组测定值范围内, 因此, 将其列为可能存在的异常情况, 建议予以关注。
| [1] |
中华人民共和国国家标准GB/T 27043-2012/ISO/IEC 17043: 2010合格评定能力验证的通用要求[S]. 2010.
|
| [2] |
CNAS-RL02能力验证规则[S]. 2018.
|
| [3] |
CNAS-CL03能力验证提供者认可准则[S]. 2010.
|
| [4] |
刘霞, 龚维, 王鹏, 等. 能力验证计划中防止数据串通的措施[J]. 化学分析计量, 2017, 26(3): 106-107. |
| [5] |
CNAS-GL003能力验证样品均匀性和稳定性评价指南[S]. 2018.
|
| [6] |
CNAS-GL002能力验证结果的统计处理和能力评价指南[S]. 2018.
|
| [7] |
赵新玥, 陈华. 药品检验领域能力验证统计方法研究[J]. 中国药学杂志, 2017, 52(4): 320-321. |
| [8] |
伍恒, 陈祝康, 顾颂青. 国内外化学检测领域能力验证结果统计方法的探讨[J]. 食品安全质量检测学报, 2016, 7(7): 2623. |
| [9] |
李晶, 项新华, 张河战. 实验室比对统计分析方法的比较[J]. 中国药学杂志, 2016, 51(2): 139-143. |
| [10] |
王林波, 杨美成, 翟培军, 等. 药品检测能力验证常用统计方法的探讨[J]. 中国药事, 2012, 26(8): 809-813. DOI:10.3969/j.issn.1002-7777.2012.08.005 |
| [11] |
ISO 13528: 2005 Statistical Methods for Use in Proficiency Testing by Interlaboratory Comparisions[S]. 2005.
|
| [12] |
中国药品生物制品检定所.中国药品检验标准操作规范[S]. 2010: 503-508.
|
| [13] |
丁文静, 沈漪, 陈祝康, 等. 药品中氮含量测定的能力验证[J]. 中国医药工业杂志, 2016, 47(12): 1557. |
| [14] |
中国药典: 四部[S]. 2015: 86.
|
| [15] |
陈祝康, 王林波, 杨美成, 等. 电位滴定法测定酮康唑含量能力验证的结果分析[J]. 中国医药工业杂志, 2009, 40(10): 769. |
 2019, Vol. 33
2019, Vol. 33