2. 江西省药品检验检测研究院, 南昌 330029
2. Jiangxi Institute for Drug Control, Nanchang 330029, China
2015年版《中华人民共和国药典》(以下简称《中国药典》)突破性地将2010年版《中国药典》各附录中的通用检验方法整合为《中国药典》第四部[1],2020年版《中国药典》也将首次对整合后的第四部进行科学、系统地修订。研究各国药典通则及附录的修订方法将有利于明确《中国药典》四部通则的修订路径。光谱技术应用广泛、发展迅速,是药品检验实际应用中最主要、最基本的方法之一,美国药典(USP)对光谱法通则的修订思路已较为系统成熟[2]。为了进一步做好2020年版《中国药典》四部的制修订工作,我们研究探寻了2010~2020年间USP各光谱法通则及指导原则的修订历史、规划以及内在联系,旨在为2020年版《中国药典》四部光谱法的修订提供参考。
1 USP光谱法通则的修订规划 1.1 2010~2015年间USP光谱法通则存在的问题与修订目的与其他各国药典一样,USP设立光谱法通则的目的是为各论中仪器(系统)的应用提供依据。但在2010~2015年间,USP认为其光谱法通则在各论中的适用性欠佳。光谱法通则的适用性可从两个方面来评价,一是方法符合仪器(系统)技术性能的程度,二是通则中的仪器(系统)测定法在各论中的适用性。作为USP现代化进程的一部分,USP化学分析通则专家委员会决定以整体和全局的角度考虑光谱法各通则的布局方式,确保通则中的科学概念与目前的最佳应用保持一致,增强通则的适用性[2]。
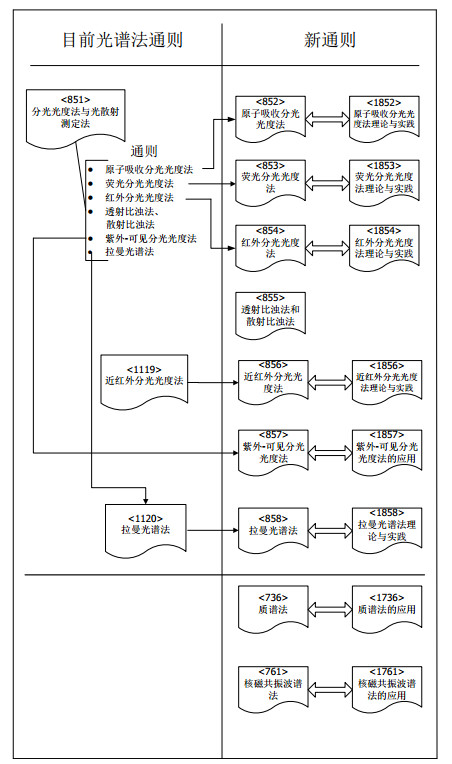
1.2 2015~2020年间USP光谱法通则的修订规划自USP 39版起,删除了涵盖多种光谱类型的概述性通则<851>分光光度法和光散射,此前多年来该通则基本保持不变[3]。取而代之的是制定每一种光谱法通则,并配备相应的指导原则:编号小于1000的通则为各论中使用的最低要求,内容包括测定法、仪器确认、验证及确认部分,每个部分都包括了对特定方法需求的评估,以确保仪器系统和相关方法的适用性;配对的编号大于1000的指导原则将给出其理论、指导和最佳应用的建议(见图 1)。这种为通则配对指导原则的思路最早体现在USP 37版<761>核磁共振光谱法、<1761>核磁共振光谱法的应用和<736>质谱法、<1736>质谱法的应用中[4]。
|
图 1 2015~2020年间USP光谱法的修订规划 |
所有编号小于1000的光谱法通则都有着相同的体例[5]。第一部分简要介绍该光谱法及与之配对的编号大于1000的指导原则;第二部分介绍对安装确认(IQ)、运行确认(OQ)等的要求,此部分内容与<1058>分析仪器的确认(AIQ)指导原则的要求相一致;第三部分介绍该方法的定性和定量分析;第四部分根据<1225>药典分析方法验证和<1226>药典分析方法确认指导原则的要求,为各论方法的开发提供所需的验证和确认方法[5-6](见表 1)。
|
|
表 1 USP 41版光谱法通则及指导原则体例结构及与2015年版《中国药典》的对比 |
USP<1058>分析仪器的确认指导原则提供了一种基于风险并适用于各论的科学的分析仪器确认过程,分析在仪器(系统)生命周期中生成的数据。目前,USP中AIQ被定义为确保仪器符合其应用目的过程。<1058>指导原则进一步描述了AIQ期间仪器确认的步骤,包括设计确认(DQ)、IQ、OQ及性能确认(PQ)。编号小于1000的光谱法通则收载了仪器确认方法及可接受标准,以确定仪器性能的最低药典要求。使用经确认的仪器将有助于确保分析数据的可靠性,从而进一步保障患者用药安全。如果经USP认定具有科学等效性,通则接受仪器制造商推荐的OQ、PQ方法和可接受标准。这将避免编号小于1000的光谱法通则中的AIQ测定方法变得过于死板。目前,<1058>指导原则正在修订中,USP将扩展其内容与良好自动化生产规范(GAMP)第五版和GAMP实验室良好实践指南第二版相一致[2]。
1.2.2.2 验证(Validation)和确认(Verification)作为光谱法通则整体修订的一部分,其方法验证要求也应与现行标准保持一致。尽管ICH Q2指导原则[7]和USP<1225>药典分析方法验证指导原则的制定主要基于色谱法的验证方法,但上述两个指导原则理论上也覆盖了光谱法的验证。USP现代化的目标之一是在各光谱法通则中均增加方法验证部分,<1225>指导原则的修订将为方法验证和各光谱法的特殊验证要求提供总体方向。目前,<1224>分析方法转移、<1225>药典分析方法的验证和<1226>药典分析方法的确认三个指导原则正在USP的修订过程中[2]。
1.2.2.3 分光光度法与光散射测定法在USP 39版中被删除的<851>分光光度法与光散射测定法通则涵盖了多种光谱类型,概述了各光谱法的原理及基本要求,但表述较为笼统,无法满足光谱仪器技术和监管日益增长的需求。新光谱技术的不断涌现使得对通则<851>的修订需求日益突出,故USP决定将该通则的内容分散收载在特定的光谱法中。目前,USP 41中已收载6种配对的光谱法通则和指导原则,即原子吸收分光光度法<852>和<1852>、荧光分光光度法<853>和<1853>、红外分光光度法<854>和<1854>、紫外-可见分光光度法<857>和<1857>、核磁共振波谱法<761>和<1761>、质谱法<736>和<1736>。近红外分光光度法和拉曼光谱法都没有在原<851>通则中体现,而是作为编号大于1000的指导原则收载,USP将对这种情况进行规范[2]。
1.2.2.4 其他除了发布修订的近红外分光光度法和拉曼光谱法通则外,化学计量学等相关的验证和确认的支撑性通则也在USP增修订进程中。USP 40版中新增的<1039>化学计量学通则将对光谱法的增修订产生重要的影响。此外,USP 40版中新增振动圆二色散光谱法(VCD)通则和指导原则<782>和<1782>,X射线荧光光谱法(XRF)和X射线衍射法(XRD)也将在此周期中进行修订[8]。尽管透射比浊法和散射比浊法在生物分析领域的应用越来越受瞩目,但目前USP对于<855>及其配套章节<1855>并没有明确的修订计划[2]。
2 对《中国药典》四部光谱法通则增修订的启示 2.1 建立系统整体的修订思路《中国药典》2020年版编制大纲中要求药品检验方法技术应不断标准化、规范化[9]。因此,不断完善科学、系统、规范、统一、协调的《中国药典》通则体系,将会为提升国家药品标准和加强药品质量控制提供更为全面、实用、有效的指导和支持。学习借鉴USP对光谱法系统性、整体性的修订思路,将有助于统筹考虑《中国药典》四部通用检验方法的增修订工作,不仅解决缺方法、少技术的问题,更应站在全局的高度,通盘考虑已收载方法通则的体例欠规范及难应用的问题。
2.2 规范通则的体例结构2015年版《中国药典》四部光谱法包括11个技术通则和1个指导原则[6]。与USP编号小于1000的通则相比,2015年版《中国药典》四部各光谱法通则体例不统一,作为法定标准来说显得稍欠规范(见表 1)。此外,《中国药典》光谱法通则缺少USP中的仪器确认、方法验证与确认等相关内容。为了保证各光谱法测定结果的合理与准确,可考虑针对不同光谱法的特点,调整框架结构,增加方法验证的相关要求。例如原子吸收分光光度法、核磁共振光谱法与高效液相色谱法等常规仪器原理不同,方法学有其自身的特点,可根据仪器和影响实验结果的因素科学地进行方法学的制订。
2.3 增强通则在各论中的适用性光谱法通则在品种各论中的适用性欠佳是USP决定对光谱法进行系统性修订的初衷。修订后的USP光谱法通则和指导原则包含了对每种方法技术的全方面使用指导,增强了各论品种项下的适用性。所以,做好通则与各论的衔接工作,使品种项下的方法延伸做到可复制、可推广、可追溯,是各国药典通则制修订的工作目标之一。2015年版《中国药典》四部光谱法通则与各论品种项下的方法也有待进一步统一协调,增强适用性。例如:原子吸收分光光度法存在着各论部分品种在该项目下关键条件缺失的现象,使标准执行存在困难。可考虑在原子吸收分光光度法通则中将原子化方式、测定关键条件、系统适用性等要求细化,增加干扰种类及克服干扰方法介绍和重要注意事项等,将利于正文的执行。目前,原子吸收分光光度法通则规定的测定法仅有两种,第一法为标准曲线法,第二法为标准加入法。但是各论中一些品种如葡萄糖酸钙片溶出度测定,仍采用对照品比较法(单点对照法)进行测定,可考虑在通则的测定法中增加该方法[10]。此外,紫外-可见分光光度法通则对溶剂的要求中规定,溶剂和吸收池的吸光度在220~240 nm范围内不得超过0.40,但个别品种如西咪替丁的吸收系数、西咪替丁片和西咪替丁胶囊的溶出度和含量测定,测定波长为218 nm,溶剂吸光度未在该范围内,在药品检验工作中无法判断是否符合要求。
2.4 增订先进方法技术2015年版《中国药典》编制大纲要求进一步扩大现代分析检测技术的应用[9]。将先进成熟的光谱技术应用于药品标准,将为药品质量控制与监管提供更多的技术支撑。近年来,USP加大了对光谱法通则的增订工作,新增了X射线荧光光谱法(XRF)、圆二色散光谱法(CD)、旋光色散光谱法(ORD)、化学计量学和化学成像技术等,在药品质量控制中起到举足轻重的作用。
2.4.1 X射线荧光光谱法与USP及其他药典相比,《中国药典》目前还未收载XRF。XRF不但能对待测样品的元素组成进行定性和定量分析,还可以获得化学结构方面的信息,具有分析速度快、检测元素范围广、前处理简便、无污染、成本低廉以及无损检测等优点,对于元素的检测范围可达0.00001%~100%。近年来,我国XRF在药物重金属检查、中药真伪鉴别等方面也出现了新的研究和应用成果[11-13]。
2.4.2 圆二色散光谱法USP 39第二增补版中新增通则<782>振动圆二色散光谱法(VCD)和<1782>振动圆二色散光谱法—理论与实践。VCD弥补了CD要求待测样品必须有紫外吸收的缺点,能够在红外波长区域(4000~750 cm-1)测定分子圆二色性,扩展了CD的应用范围[14]。在手性药物绝对构型的确证中,通常采用X射线衍射法(XRD)、核磁共振(NMR)、CD、ORD配合使用[2],以确保结果的准确性。
2.4.3 化学计量学及化学成像技术作为近红外光谱法和拉曼光谱法验证和确认的基础支撑章节,USP越来越重视对化学计量学领域的制修订[2]。化学成像技术使用户通过振动光谱(如中红外光谱、近红外光谱和拉曼光谱)等创建分布图像,结合传感技术和数据分析技术描述样品的化学和物理性质,检测例如多态性、粒子形态,同质多晶、样品的物理缺陷或外源粒子及污染物等[15]。
3 结语2020年版《中国药典》的编制目前正处于攻坚阶段。在加强药品标准国际协调的大背景下,研究国外先进药典的编制思路,将有利于做好《中国药典》的制修订工作。本文首次对2010~2020年间USP中光谱法通则存在的问题、修订目的、修订规划进行了详细的梳理和总结,并与2015年版《中国药典》四部光谱法通则相关内容进行了初步对比。可以看到,《中国药典》四部光谱法通则在建立系统整体的修订思路、规范体例结构、增强在各论中的适用性、增订先进方法技术等方面有可学习和借鉴的内容。在兼顾我国药品质量控制特点、药品监管需要以及医药产业发展现状的基础上,秉承科学、规范、经济和适用的原则,提高《中国药典》四部光谱法通则的准确性、适用性与先进性,将为确保我国药品的安全、有效和质量可控性打下坚实的基础。
| [1] |
姜雄平, 洪小栩. 进入发展新常态的2015年版《中国药典》通则[J]. 中国药学杂志, 2015, 50(20): 1787-1789. |
| [2] |
Burgess C., Hammond J. P.. Modernisation of the Spectroscopic General Chapters in the United States Pharmacopeia[J]. Spectrosc. Eur, 2015, 27(1): 26-29. |
| [3] |
United States Pharmacopoeia (39)[S]. 2016.
|
| [4] |
United States Pharmacopoeia (37)[S]. 2014.
|
| [5] |
United States Pharmacopoeia (41)[S]. 2018.
|
| [6] |
中华人民共和国药典: 四部[S]. 2015.
|
| [7] |
ICH Q2(R1): Validation of Analytical Procedures: Text and Methodology[EB/OL].(1996-11-06)[2018-09-07]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q2_R1/Step4/Q2_R1__Guideline.pdf.
|
| [8] |
United States Pharmacopoeia (40)[S]. 2017.
|
| [9] |
国家药典委员会.《中国药典》2020年版编制大纲[EB/OL].(2018-01-30)[2018-09-07]. http://www.chp.org.cn/view/ff8080815e0d584f016146aee506579a?a=WYHBJWY.
|
| [10] |
张立雯. 关于修订《中国药典》2015年版原子吸收光谱法相关内容的建议[J]. 中国药品标准, 2013, 14(6): 405-407. |
| [11] |
钱原铬, 赵春江, 陆安祥, 等. X射线荧光光谱检测技术及其研究进展[J]. 农业机械, 2011(23): 137-141. |
| [12] |
聂黎行, 朱俐, 戴忠, 等. X射线荧光光谱技术在中药分析中的应用[J]. 中国药事, 2016, 30(7): 691-694. |
| [13] |
张秀娟, 芦清, 何春阳. 药材中微量元素测定方法的研究进展[J]. 药物评价研究, 2017, 40(4): 566-570. |
| [14] |
甘礼社, 周长新. 振动圆二色谱:一种确定手性分子绝对构型的新方法[J]. 有机化学, 2009, 29(6): 848-857. |
| [15] |
EDQM: New General Chapter on Chemical Imaging in the European Pharmacopoeia[EB/OL].(2017-01-05)[2018-09-07]. https://www.edqm.eu/sites/default/files/pressrelease-pheur_new_chapter_chemical_imagingjanuary2017.pdf.
|
 2019, Vol. 33
2019, Vol. 33 
