2. 烟台大学药学院, 烟台 264000
2. College of Pharmacy, Yantai University, Yantai 264000, China
洋葱伯克霍尔德菌是一种广泛存在于水、土壤、植物和人体中的革兰氏阴性杆菌。最早由美国植物病理学家Walter H. Burkholder于1947年从腐烂的洋葱中分离发现,也因此称为洋葱假单胞菌[1]。1992年Yabuuchi等将其正式归属为伯克霍尔德菌属。该属目前已确认有122个种[2],其中洋葱伯克霍尔德菌在医院临床上常常被分离到,是一种多重耐药菌,对人类的危害极大,可引起人类肺部囊肿性纤维化(CF)感染,是CF患者的高毒力、高致病性病原菌,也是引起抵抗力低下患者感染的重要病原菌[3]。1981年,美国因洋葱伯克霍尔德菌污染吸入剂导致数名囊泡性纤维症(Cystic Fibrosis)患者死亡,进而引起FDA对该菌的注意,并在后来将该菌明确列为不可接受微生物。在2004-2011年FDA召回的非无菌制剂中有害微生物种类统计分析显示,因洋葱伯克霍尔德菌污染而召回的非无菌药品占因微生物污染召回总量的34%。报告显示近三十年来,洋葱伯克霍尔德菌已逐渐成为全球制药业产品中检出率最高的不可接受微生物之一。此外,在2004-2011年召回的非无菌制剂中,因抑菌效力失败召回的占总召回量的5%[4]。
本实验室在一起医疗事件的调查分析过程中,从含有0.1 mg·mL-1的苯扎溴铵样品中分离获得了一株洋葱伯克霍尔德菌,其能够在该样品的防腐体系中存活和生长。苯扎溴铵和苯扎氯铵是一类常用的阳离子型抑菌、杀菌剂。苯扎溴铵又称新洁尔灭,国内使用较多。苯扎氯铵又称洁尔灭,在国内外都有使用。苯扎溴铵和苯扎氯铵的杀菌机理相同,通过改变细菌细胞膜的通透性,使胞内物质外渗,阻碍代谢而杀死菌体。《中国药典》1121抑菌效力检查法中指出“添加事宜的抑菌剂目的是防止制剂在正常贮藏或使用过程中由于微生物污染和繁殖,使药物变质而对使用者造成危害”。日本《医药品添加事物典》中规定,眼科制剂中苯扎氯铵的最大使用量为0.1 mg·mL-1 [5]。为了考察该菌对抑菌剂和产品防腐体系的耐受能力,测定了该菌在样品中初始状态与分离传代后对苯扎溴铵的最低抑菌浓度(MIC)值,并将分离传代后的培养物回接到未受污染样品中,观察其存活状态;最后将其作为挑战菌接入三个含有不同浓度苯扎氯铵的样品防腐体系产品,按照《中国药典》2015年版四部通则1121抑菌效力检查法的操作要求进行挑战试验[6],以考察苯扎氯铵防腐体系对洋葱伯克霍尔德菌的抑菌有效性。
1 材料与试验样品 1.1 仪器YAMATO SQ810C型高压蒸汽灭菌器;Sartorius BJ-2202S型电子天平;Thermo 1285 4FT型生物安全柜;BINDER KD240培养箱;BD麦氏比浊仪。
1.2 菌种金黄色葡萄球菌[CMCC(B)26003];大肠埃希菌[CMCC(B)44102];铜绿假单胞菌[CMCC(B)10104];白色念珠菌[CMCC(F)98001];黑曲霉[CMCC(F)98003];以上菌株均来自中国医学菌种保藏中心。
洋葱伯克霍尔德菌两株:一株为本实验室从含0.01%苯扎溴铵的凝胶样品中分离获得,另一株CICC10857(ATCC25416)来自工业微生物菌种保藏中心。
1.3 培养基胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨肉汤培养基(TSB)、沙氏葡萄糖琼脂培养基(SDA)、沙氏葡萄糖液体培养(SDB)、MH肉汤(MHB)、马铃薯葡萄糖琼脂培养基(PDA)、96孔板。
1.4 试验样品从市场上获得,共涉及三个厂家的玻璃酸钠滴眼液,本文分别以A、B和C代表。
2 试验方法 2.1 MIC值的测定质控菌株和分离传代洋葱伯克霍尔德菌的菌液制备:挑取TSA平板上新鲜培养的洋葱伯克霍尔德菌,用MH肉汤制备菌液,并用浊度仪调至0.5麦氏浊度,十倍稀释后制备成工作菌液。
苯扎溴铵梯度液制备:无菌96孔板第1~11列加入无菌MH肉汤100μL,取5%苯扎溴铵溶液65.5μL加入第1列,再加34.5μL MH肉汤将第1列补齐至200μL,逐次倍比稀释至第11列(每孔液体终体积是100μL),第1列孔中苯扎溴铵浓度为8192 g·mL-1,第11列孔的浓度为8 g·mL-1。第12列A~D孔加入100μL/孔无菌MH肉汤作为阳性对照,第12列E~H孔加入200μL/孔无菌MH肉汤作为阴性对照。
接种培养:将制备好的工作菌液按100μL/孔加入含100μL苯扎溴铵梯度液的96孔板中(第12列E~H孔不加菌),接种后,盖好板盖,置33℃恒温箱培养20~24小时观察结果。
将含菌量约为105cfu·mL-1的原样品作为工作菌液(0801-Y)按上述操作进行测定。
2.2 回接试验将分离纯化后的洋葱伯克霍尔德菌新鲜培养物制备成一定浓度的菌悬液,按样品量1%的体积比接入到未污染的样品中,涡旋混匀,置于25℃条件下,并在接种后1、2、7、14、28 d分别进行活菌计数。
2.3 抑菌效力评价 2.3.1 菌液制备挑取金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、洋葱伯克霍尔德菌的新鲜培养物至TSA上,30~35℃培养18~24 h;白色念珠菌接种于SDA上,20~25℃培养24~48 h。各取上述培养物,用0.9%无菌氯化钠溶液制备成菌悬液,并用浊度仪调整浊度。黑曲霉接种于PDA斜面上,20~25 ℃培养5~7 d,至有丰富的孢子产生,用含0.05%(mL·mL-1)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,然后用灭菌移液管吸出孢子悬液至无菌试管内,用含0.05%(mL·mL-1)聚山梨酯80的0.9%无菌氯化钠溶液制成适宜浓度的孢子悬液。
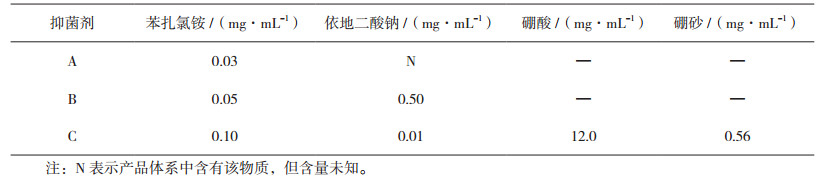
2.3.2 方法适用性试验三个厂家产品的处方(见表 5)中均添加苯扎氯铵和依地酸二钠,C厂家还含有硼酸和硼砂,在这些成分中苯扎氯铵为主要防腐剂,硼酸硼砂也有一定的抑菌作用,依地酸二钠具有协同作用,综合各成分作用及含量,选择苯扎氯铵含量最高的C厂家产品进行方法适用性实验。
平皿法:取C厂家产品作为试验供试品,用无菌生理盐水按10倍梯度进行稀释,按试验菌种类制备供试品稀释液六组,每组供试品稀释至10-4;以生理盐水替代供试品稀释液作为对照组。将制备好的菌液稀释至适宜浓度,按1%体积比接入到各组供试品稀释液中,涡旋混匀,取1mL至无菌平皿中,加入15~20 mL温度不超过45℃胰酪胨大豆琼脂,平行制备2个平板,混匀,凝固,细菌置30~35℃培养不超过3 d;真菌采用沙氏葡萄糖琼脂培养基,并置20~25℃培养,培养时间不超过5 d。
薄膜过滤法:当平皿法的回收率不能满足规定或对供试品原液进行计数时,可采用薄膜过滤法去除抑菌性。取1 mL供试品原液,加入到含100 mL无菌生理盐水的滤器中混匀,过滤后用生理盐水进行冲洗,依据供试品的抑菌性冲洗量分别设为0、100、200、300 mL,并在最后一次冲洗液中接入不大于100 cfu的菌,完全过滤后取下滤膜,有菌面朝上贴于相应的琼脂平板上,置于规定的温度进行培养;对照组以生理盐水代替供试品,不冲洗,其他同供试品组。
2.3.3 供试品接种与计数不同厂家的玻璃酸钠滴眼液供试品各取6支,每支装量5 mL,按1%的体积比接种试验菌,一种试验菌(大肠埃希菌、铜绿假单胞菌、金黄色葡萄球菌、洋葱伯克霍尔德菌、白色念珠菌、黑曲霉)分别接种一支供试品,充分混合均匀,然后置20~25℃避光贮存。在规定的时间间隔(6 h、24 h、7 d、14 d、28 d)按2.3.2节下确认的方法进行计数。
2.3.4 菌液对照组制备与计数制备与供试品等体积的0.9%的无菌生理盐水管,按1%的体积比接入各试验菌,涡旋混匀作为菌液组,并按照供试品组的操作进行培养计数,计数结果作为供试品的初始接菌量。
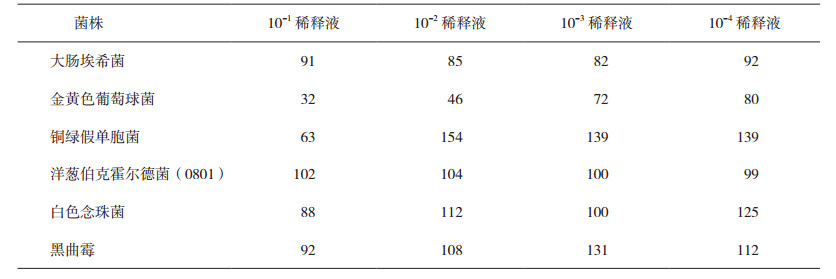
3 试验结果 3.1 MIC值对样品中分离传代培养后的洋葱伯克霍尔德菌(编号0801)、样品中所含的最初状态的洋葱伯克霍尔德菌(编号0801-Y)以及从工业微生物菌种保藏中心购买的洋葱伯克霍尔德菌标准质控菌株(CICC10857),参照美国CLSI M07 A10细菌的稀释抗菌敏感性试验方法中微量稀释法进行MIC值测定,测定结果见表 1,CICC10857和0801对苯扎溴铵的MIC值低于0801-Y的MIC值。
|
|
表 1 洋葱伯克霍尔德菌对苯扎溴铵的MIC值 |
将分离菌回接到样品中,在特定的时间间隔进行活菌计数,观察样品中洋葱伯克霍尔德菌的存活状态,结果见图 1。在回接后的24 h内,菌数下降,但24 h后,菌数逐渐升高,28 d时恢复至初始水平,表明洋葱伯克霍尔德菌在回接到含苯扎溴铵的样品中后,最初受到抑制,随时间增加,对苯扎溴铵逐渐产生耐受,至28 d时恢复至初始水平。
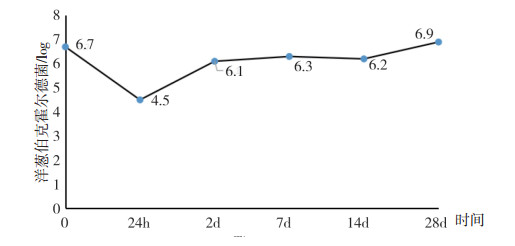
|
图 1 洋葱伯克霍尔德菌回接样品后的存活状态 |
检验方法是数据稳定、准确、可靠的前提,《中国药典》规定:供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。因此,在进行挑战之前,首先对平皿法进行适用性试验,试验结果见表 2。试验结果表明金黄色葡萄球菌对苯扎氯铵的敏感性最强,在供试品10-2级稀释液中的回收率低于70%,不符合规定,因此,在对含菌供试品进行存活菌计数时,当存活菌量低于104 CFU·mL-1时,为保证结果的准确性,应该采用薄膜过滤法进行计数。
|
|
表 2 平皿法回收率(%) |
在对薄膜过滤法进行方法适用性试验时,选择对该防腐剂最为敏感的菌株-金黄色葡萄球菌作为试验菌来确定去除抑菌性的最小冲洗量,试验结果见表 3。
|
|
表 3 金黄色葡萄球菌薄膜过滤法培养计数结果 |
由表 3可知,当冲洗量为100 mL时,回收率为102%,大于70%,符合规定。采用该冲洗量,对其余菌株进行方法确认,回收率均大于70%(见表 4)。因而在对供试品的存活菌数进行测定时,当对高于10-2稀释级的样液进行计数时,可采用平皿法,当样液稀释级低于或等于10-2时,应采用薄膜过滤,以最低冲洗量为100 mL进行检验。
|
|
表 4 薄膜过滤法验证结果 |
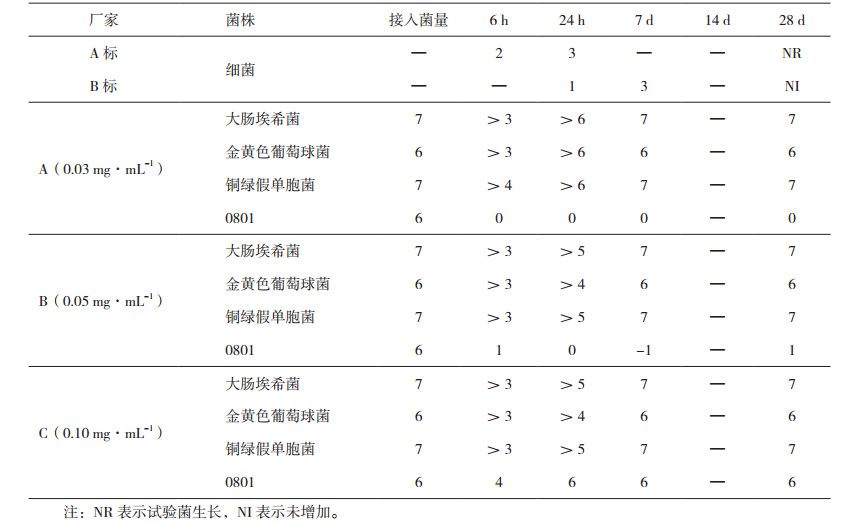
将样品分离的洋葱伯克霍尔德菌与药典中规定的菌株一起作为挑战菌对三种不同浓度的苯扎氯铵(见表 5)进行评价,评价结果见表 6。
|
|
表 5 玻璃酸钠滴眼液处方中的抑菌剂含量 |
|
|
表 6 不同浓度的苯扎氯铵防腐体系中细菌的下降对数值 |
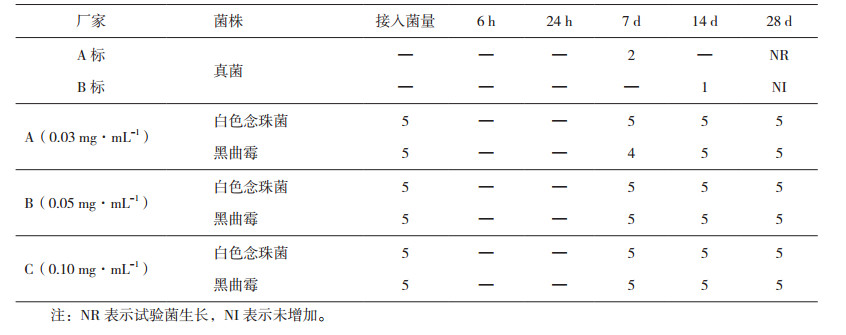
由表 5、表 6和表 7可知,在含量为0. 0 3 mg·mL-1、0.05 mg·mL-1和0.10 mg·mL-1的苯扎氯铵防腐体系中,按照《中国药典》2015年版四部通则1121抑菌效力检查法进行评价,均符合药典规定的A标,但对洋葱伯克霍尔德菌,只有0.10 mg·mL-1的苯扎氯铵对洋葱伯克霍尔德菌抑菌作用符合规定。
|
|
表 7 不同浓度的苯扎氯铵防腐体系中真菌的下降对数值 |
苯扎溴铵对最初状态的洋葱伯克霍尔德菌的MIC值为128 g·mL-1,高于分离传代后和标准质控菌株(64 g·mL-1);将经过多次传代后的分离菌株回接至含有苯扎溴铵的样品后,活菌量在接入24 h内显著下降,24 h后逐渐恢复至初始菌量。本试验的结果与Jeong Myeong Kim团队[7]的研究发现类似:将洋葱伯克霍尔德菌从不含苯扎氯铵的环境中接入到含有亚致死剂量的苯扎氯铵环境中,在接触的前20min内,菌体回收量迅速下降,但20min后菌体回收量又迅速回升。Youngbeom Ahn等[8]研究发现,洋葱伯克霍尔德菌复合菌群(BCC)中的菌株对苯扎氯铵存在天然耐受,其能利用自身的外排系统和代谢系统降低苯扎氯铵的伤害。将分离获得的洋葱伯克霍尔德菌作为抑菌效力评价的挑战菌株,对含苯扎氯铵的滴眼液防腐体系进行挑战,结果表明:只有含有0.10 mg·mL-1苯扎氯铵的防腐体系对其的抑制效力符合规定,而0.1 mg·mL-1苯扎氯铵是日本《医药品添加事物典》中规定的眼科制剂中的最大使用量。
上述结论表明,在特定环境下的野生菌株对抑菌剂的耐受性有可能会高于实验室培养菌株,提示在进行防腐剂效力评价时,为了客观评价其防腐效力,模拟实际使用情况,应考虑加入环境或样品中常分离的菌作为挑战菌。对此国内外药典也都有提及,如中国药典第四部1121抑菌效力检查法:若需要,制剂中常见的污染微生物也可作为试验菌株[6];美国药典[9]中规定:菌株对产品防腐体系的真实活性评价有益,药典中规定的菌株不影响其他菌株的使用[9]。欧洲药典[10]:适当条件下,添加可能污染制剂的代表菌株或指定的微生物进行试验。
但环境或样品分离菌的加入并不是将分离菌加入到挑战菌列表中那么简单,一方面添加菌株的选择必须慎重,所选菌株必须有一套可靠的、合理的文件记录,以保障所选菌株的合理性和有效性。如本试验中分离的洋葱伯克霍尔德菌,在原始状态下对苯扎溴铵的抗性较强,但通过传代培养后,其抗性下降或消失,如何保持原始菌株的性状,是实验室需要考虑的一个问题;另一方面对于挑战失败的防腐体系必须有一个明确的应对体系[11]。各国药典均规定防腐剂的添加应遵循“最低有效的原则”,而环境分离菌的引入可能会导致原有防腐体系的失败,如本研究中,0.03 mg·mL-1和0.05 mg·mL-1的苯扎氯铵防腐体系对洋葱伯克霍尔德菌无效。因此,在将分离菌加入到挑战菌行列之后,如何在“最低有效原则”的前提下改进防腐体系,保障防腐效果也是各制药企业所需要考虑的问题。
| [1] |
Burkholder W H. Sour Skin, a Bacterial Rot of Onion Bulbs[J]. Phytopathology, 1950, 64(1): 468-475. |
| [2] |
Parte A.C.. LPSN-List of Prokaryotic Names with Standing in Nomenclature (bacterio.net), 20 Years on[J]. International Journal of Systematic and Evolutionary Microbiology, 2018, 68: 1825-1829. DOI:10.1099/ijsem.0.002786 |
| [3] |
李金钟. 洋葱伯克霍尔德菌复合体的研究进展[J]. 临床检验杂志, 2008, 26(3): 233-235. |
| [4] |
Sutton S & L Jimenez. A Review of Reported Recalls Involving Microbiological Control 2004-2011 with Emphasis on FDA Considerations of "Objectionable Organisms"[J]. American Pharmaceutical Review, 2012, 15(1): 42-57. |
| [5] |
日本医药品添加剂协会.医药品添加事物典[S]. 2007: 248-249.
|
| [6] |
国家药典委员会.中国药典: 四部[S]. 2015: 151-153.
|
| [7] |
Kim J M, Ahn Y, Lipuma J J, et al. Survival and Susceptibility of Burkholderia Cepacia, Complex in Chlorhexidine Gluconate and Benzalkonium Chloride[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(6): 905-913. |
| [8] |
Ahn Y, Kim J M, Kweon O, et al. Intrinsic Resistance of Burkholderia Cepacia Complex to Benzalkonium Chloride[J]. Mbio, 2016, 7(6): e01716-16. DOI:10.1128/mBio.01716-16 |
| [9] |
USP42-NF 37: VolⅠ[S]. 2019: 6382-6385.
|
| [10] |
EP 9.0: VolⅠ[S]. 2016: 577-579.
|
| [11] |
Sutton S. The Antimicrobial Efficacy Test, GMP and Investigations[J]. Microbiology, 2013, 16: 40-48. |
 2019, Vol. 33
2019, Vol. 33