乙型脑炎减毒活疫苗(乙脑活疫苗)自1989年上市以来,在国内外使用超过10亿剂,已出口至多个国家,包括韩国、印度、泰国等十多个国家。2013年,成都生物制品研究所生产的乙脑活疫苗已通过了世界卫生组织的预认证[1],为中国及东南亚国家儿童乙脑的有效控制发挥了重要作用。乙脑活疫苗在疫苗生产用细胞基质上连续传代20代,E蛋白基因序列未发生改变[2],临床研究及大规模的应用充分证明乙脑活疫苗的安全性。但是,国外有文献报道我国乙脑活疫苗会致死小鼠,其病毒基因序列也发生了改变,可能造成乙脑活疫苗安全性的潜在风险[3]。为此,本研究探索乙脑活疫苗病毒SA14-14-2在成瘤性细胞BHK21上连续传代后病毒基因序列是否发生改变,对明晰、规范和严格控制乙脑活疫苗生产细胞基质,从而有效保障疫苗安全性有着十分重要的意义。
1 材料与方法 1.1 材料 1.1.1 病毒乙脑活疫苗SA14-14-2成都生物制品研究所提供,批号为201806A106-2,病毒滴度为1×106.4 PFU·mL-1。
1.1.2 细胞BHK21细胞由中国食品药品检定研究院虫媒病毒疫苗室提供。
1.1.3 主要试剂Eagles’MEM培养基购于HyClone公司(批号AE27142269)。胎牛血清、青霉素10000u·mL-1与链霉素10000μ·mL-1(PS)、胰酶均购自Gibco公司(批号2085376);RNA提取试剂盒购自QIAGEN公司(批号OOD6943020000B16S072);逆转录试剂盒购于T a K a R a公司(批号AI20774A);PCR高保真聚合酶(Q5 Hot Start High-Fidelity)购于NEB公司(批号10022725)。
1.1.4 引物由invitrogen合成,序列见表 1。
|
|
表 1 SA14~14~2全基因序列扩增引物 |
用含有10%FBS,2%PS的MEM培养基培养,置于37℃、5%CO2的培养箱中培养,至长成单层细胞后接种病毒。
1.2.2 SA14-14-2的传代培养复溶1支乙脑活疫苗(批号201806A106-2),接种到已长成致密单层的BHK21细胞上,吸附1h后加入细胞维持液(含2%FBS和1%PS的MEM培养基),72 h左右观察到细胞病变时收获病毒液,连续传15代。选取第二代病毒(P2)、第五代病毒(P5)、第十五代病毒(P15)进行基因序列分析。
1.2.3 RNA的提取及目的基因的扩增使用QIAamp Viral RNA Mini Kit试剂盒,提取P2代、P5代、P15代病毒的RNA,再用TaKaRa逆转录试剂盒进行病毒RNA的体外逆转录,反应体系20μL:3μL RNA,4μL 5X PrimeScript RT Master Mix,13μLRNase Free dH2O;反应条件为37℃ 15min,85℃ 5s。把逆转录合成的cDNA分为7个片段(F1~F7)进行PCR,反应体系50μL:25μL 2X Q5 Master Mix,F1~F7对应的上下游引物各2μL,cDNA 1μL,ddH2O 20μL。反应条件:98℃ 30s;98℃ 10s,55℃ 30s,72℃ 68s(F3、F6、F7)/72℃ 100s(F1、F2、F4、F5),共35个循环;72℃终延伸2 min。PCR产物经0.8%的琼脂糖凝胶电泳鉴定后送至invitrogen公司测序。
1.2.4 测序结果分析使用SeqMan软件对测序结果进行序列拼接,将GenBank中登录号为D90195和MH258852的序列导出,用MegAlign软件对测序结果进行比对分析。
2 结果 2.1 PCR扩增片段的鉴定P2、P5、P15全基因以七个大小相等的片段进行扩增,预期的F1~F7的目的片段长度分别为1500 bp、2200 bp、1700 bp、2100 bp、2400 bp、1500 bp、1500 bp,经0.8%的琼脂糖凝胶电泳后分析,结果与预期相符,如图 1所示。
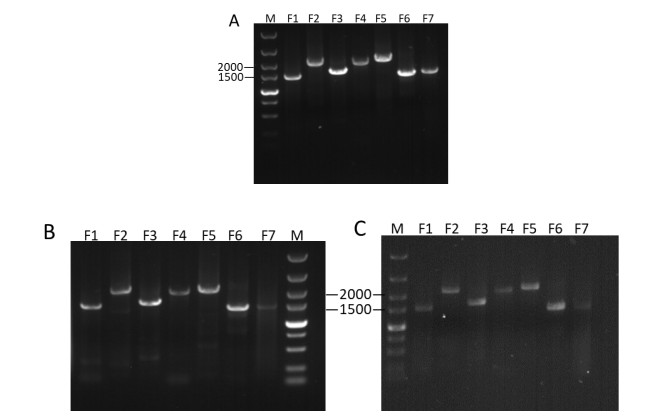
|
A. P2;B. P5;C. P15 图 1 PCR扩增片段的电泳图分析 |
P2、P5和P15代病毒基因组由10976个核苷酸(nt)组成,编码3432个氨基酸,分别由5’- UTR,核心蛋白(C)、前膜(PreM)、膜蛋白(E)、非结构蛋白(NS,NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5)和3’-UTR构成,与GenBank中登录号为D90195的乙型脑炎减毒株SA14-14-2全基因序列的核苷酸同源性达99.9%。P2代病毒全基因组有7个碱基位点发生了改变,其中5个碱基位点位于非结构蛋白区,分别分布于NS2A区、NS3区、NS4A区、NS4B区、NS5区,导致WNS3R、TNS4AI和QNS5H三个氨基酸发生了改变,另外两个碱基位点位于3’ UTR区。P5代病毒有8个碱基位点发生变化,其中1个碱基位点改变位于结构蛋白E第279位,由甲硫氨酸(M)改变为赖氨酸(K)ME279K;其余7个碱基改变位点分别发生在NS2A区、NS3区、NS4A区、NS4B区、NS5区和3’UTR区,与P2代病毒改变位点一样。P15代病毒有9个碱基位点发生改变,它在P5代病毒发生改变的碱基位点的基础上,多了一个非结构蛋白NS5区的一个碱基突变,但未造成氨基酸的改变。详细结果见表 2。
|
|
表 2 P2、P5、P15代病毒基因与基因库中SA14-14-2基因序列比对结果 |
乙脑活疫苗超过几十年、十亿多剂使用,证明了其安全性、有效性和质量可控。许多研究证明乙脑活疫苗神经弱毒力稳定[4-8]乙脑病毒E蛋白是决定病毒毒力的关键蛋白,其中E蛋白上有8个位点氨基酸与乙脑病毒毒力密切相关[9-10]。乙脑活疫苗的质量控制标准包括了分子水平的病毒基因序列分析,即乙脑活疫苗E蛋白8个关键位点E107、E138、E176、E177、E264、E279、E315、E439氨基酸均不能发生改变[11]。李、贾等[2, 12]学者将乙脑病毒SA14-14-2在乙脑减毒活疫苗生产用细胞基质上连续传20代、17代,E蛋白上关键位点都未发生改变。而WHO乙脑活疫苗的生产和质量控制标准也是基于中国乙脑活疫苗的生产和质量控制标准而制定[13]。表明我国乙脑活疫苗的质量可靠。但是近年来,国际上有学者报道中国乙脑活疫苗病毒SA14-14-2致死小鼠,疫苗病毒的基因序列也发生了改变[3],对中国疫苗减毒活疫苗造成了不利影响。由于乙脑病毒减毒株SA14-14-2及其亲代强毒株SA14均系我实验室保存和建株,刘等[14]采用了来源清晰、代次明确在原代地鼠细胞上培养的乙脑病毒SA14、SA14-14-2进行了全基因序列分析,建成了乙脑活疫苗病毒原始种子、主种子、工作种子、疫苗病毒的基因标准序列,进一步证明了《中华人民共和国药典》(2015年版,三部)上规定的8个位点氨基酸的不能发生改变,在这样的遗传背景下SA14-14-2病毒对小鼠脑也无神经毒力。因此,为了进一步弄清楚国外文献报道乙脑减毒活疫苗的基因变化的原因,本研究将乙脑病毒减毒株SA14-14-2病毒在实验室里常用的成瘤性BHK21细胞上连续传代,以期解析乙脑病毒减毒株的基因变化情况。本研究结果发现乙脑病毒减毒株SA14- 14-2在BHK21上连续传5代后,E蛋白第279位点的氨基酸由甲硫氨酸突变为赖氨酸,此位点突变株病毒ME279K对小鼠脑内有神经毒力,杨健等[15]学者研究结果已证明此结论。该结果提示国外的研究所用SA14-14-2病毒可能因为来源不清晰,或者病毒传代代次过高,或者在具有成瘤性细胞上培养,导致了与乙脑病毒毒力相关位点的基因发生了突变,从而表现出对小鼠脑内神经毒力。因此,本研究提示乙脑活疫苗的质量控制应考虑乙脑活疫苗病毒培养的细胞基质和病毒培养代次控制。本研究为确保疫苗的质量提供了技术支持,具有十分重要意义。
| [1] |
WHO. Newly Accessible Japanse Encephalitis Vaccine Will Make Saving Children easier in Developing Countries[EB/OL]. (2013-10-09)[2013-10-09]. https://www.who.int/mediacentre/news/releases/2013/Japanese-encephalitis-20131009/zh/-66k.
|
| [2] |
李玉华, 刘杰, 汪伟, 等. 乙脑病毒减毒株SA14-14-2在原代地鼠肾细胞多次传代后病毒基因稳定性研究[J]. 中国生物制品学杂志, 2003, 16(6): 333-335. DOI:10.3969/j.issn.1004-5503.2003.06.005 |
| [3] |
Yun S.-I., Lee Y.-M., Kim J.-K., et al. Biological and Genetic Properties of SA14-14-2, a Live-attenuated Japanese Encephalitis Vaccine that is Currently Available for Humans[J]. The Journal of Microbiology, 2012, 50(4): 698-706. DOI:10.1007/s12275-012-2336-6 |
| [4] |
俞永新. 中国乙型脑炎病毒株的毒力变异和减毒活疫苗的研究[J]. 中华实验和临床病毒学杂志, 2018, 32(5): 449-457. DOI:10.3760/cma.j.issn.1003-9279.2018.05.001 |
| [5] |
Yu Yongxin. Phenotypic and Genotypic Characteristics of Japanese Encephalitis Attenuated Live Vaccine Virus SA14-14-2 and Their Stabilities[J]. Vaccine, 2010, 28(21): 3635-3641. DOI:10.1016/j.vaccine.2010.02.105 |
| [6] |
李玉华, 李海玲, 吴永林, 等. 流行性乙型脑炎病毒活疫苗株SAl4-14-2基因稳定性研究[J]. 中华微生物学和免疫学杂志, 2003, 23(11): 858-861. DOI:10.3760/j:issn:0254-5101.2003.11.010 |
| [7] |
杨邦玲, 王洪强, 王凯, 等. 乙型脑炎减毒活疫苗毒力稳定性分析[J]. 中国生物制品学杂志, 2014, 27(12): 1512-1516. |
| [8] |
俞永新. 流行性乙型脑炎减毒活疫苗SA14-14-2弱毒株的表型和基因型特性及其稳定性[J]. 中国计划免疫, 2002, 8(5): 283-287. DOI:10.3969/j.issn.1006-916X.2002.05.022 |
| [9] |
Yang Jian, Yang Huiqiang, Li Zhushi, et al. Envelope Protein Mutations L107F and E138K Are Important for Neurovirulence Attenuation for Japanese Encephalitis Virus SA14-14-2 Strain[J]. Viruses, 2017, 9(1): 20. DOI:10.3390/v9010020 |
| [10] |
Li Yuhua, Fu Yin, Liu Xinyu, et al. The Molecular Determinants Governing the Immunogenicity of Japanese Encephalitis Live Attenuated Vaccines[J]. In Signal Transduction and Targeted Therapy, 2017, 2: 17005. DOI:10.1038/sigtrans.2017.5 |
| [11] |
国家药典委员会. 中华人民共和国药典2015年版三部[M]. 北京: 中国医药科技出版社, 2015: 122.
|
| [12] |
贾丽丽, 郑铮, 郭玉鹏, 等. 流行性乙型脑炎减毒活疫苗生产毒株(SAl4-14-2)的稳定性研究[J]. 中国生物制品学杂志, 1992, 5(1): 174-176. |
| [13] |
WHO. Guidelines for the Production and Control of Japanese Encephalitis Vaccine (live) for Human Use[EB/OL]. (2000-11-03)[2000-11-03]. https://apps.who.int/iris/bitstream/handle/10665/42577/WHO_TRS_910.pdf.
|
| [14] |
Liu Xinyu, Zhao Danhua, Jia Lili, et al. Genetic and Neuroattenuation Phenotypic Characteristics and Their Stabilities of SA14-14-2 Vaccine Seed Virus[J]. Vaccine, 2018, 36(31): 4650-4656. DOI:10.1016/j.vaccine.2018.06.040 |
| [15] |
杨健, 李玉华, 李竹石, 等. 乙型脑炎疫苗株SA14-14-2包膜蛋白279位氨基酸回复突变对其毒力的影响[J]. 川北医学院学报, 2013, 28(4): 325-330. DOI:10.3969/j.issn.1005-3697.2013.04.07 |
 2019, Vol. 33
2019, Vol. 33 


