无菌药品是法定药品标准中列有无菌检查项目的制剂和原料药,其生产的主要风险是微生物污染,生产过程中应当进行动态监测,并最大限度地降低微生物污染。根据《药品生产质量管理规范(2010年修订)附录1无菌药品》的要求,对培养基模拟灌装试验发生的任何微生物污染应当进行调查。美国FDA“行业指南-采用无菌工艺生产的无菌药品”要求:任何污染的样品应该被认为是有害的,并需进行调查。微生物应该鉴别至种水平[1]。《中国药典》2015年版四部通则“1101无菌检查法”要求:应该从阳性实验结果中分离到的微生物进行鉴定,以判定试验是否重试[2]。由于企业在失败的培养基模拟灌装试验或无菌检查中,分离到的污染菌通常与环境监控中发现的分离菌密切相关,因此,通过环境微生物鉴定所建立的数据库应该能为调查提供有价值的信息。
微生物鉴定技术包括表型特征鉴定、化学型特征鉴定和基因型特征鉴定。微生物脂肪酸鉴定法为化学型特征鉴定法,由于每一种细菌脂肪酸成分相对稳定,可以作为微生物标记物,美国MIDI公司根据长期积累的脂肪酸生物标记物的研究经验开发了Sherlock全自动微生物鉴定系统,该系统根据不同种类微生物细胞膜中磷脂脂肪酸(Phospholipid Fatty Acid,PLFAs)的不同对微生物进行鉴定和分析。该系统已应用于食品工业,如浓香型大曲中芽孢杆菌的分离、鉴定和贻贝中的菌相分析[3-4],及环境科学研究,如浓香型白酒窖泥中的微生物鉴定和制浆废水处理优势菌的鉴定[5-6],但有关采用微生物脂肪酸鉴定法进行医药工业洁净区环境微生物鉴定的文献较少。本文对无菌药品生产环境动态监测发现的微生物采用该系统进行鉴定和种群分析,为微生物的溯源和污染控制提供科学依据。
1 仪器和试药 1.1 仪器Sherlock®微生物鉴定系统软件(美国MIDI公司);Agilent6890型气相色谱仪(包括氢火焰离子检测器FDI、自动液体取样器等,美国Agilent科技有限公司);Agilent UltraⅡ型毛细管气相色谱柱,长度25 m×内径0.20 mm×膜厚0.33 um,用5%苯基-甲基聚硅氧烷包被,由美国Agilent科技有限公司提供;计算机系统(MIDI系统操控的IBM可兼容计算机);LRH-250A培养箱,由广东医疗器械厂提供。
1.2 试剂胰蛋白胨大豆琼脂固体培养基(美国BD公司);甲醇、盐酸、己烷(Riedel-de Haen公司);甲基-3-丁基醚(FLUKA公司);氢氧化钠(杭州萧山化学试剂厂);氯化钠(宜兴市辉煌化学试剂厂);微生物样本,从冻干粉针剂生产车间B级洁净区生产环境监测中收集分离的菌种。
2 实验方法 2.1 培养基配制称取胰蛋白胨大豆琼脂固体培养基40.0 g,加热搅拌溶解于1000 mL蒸馏水中,分装于500 mL玻璃瓶中,加胶塞,轧盖,121℃高压灭菌15 min,备用。使用时,将培养基在水浴中融化,至温度降至约60℃时,将20 ~ 25 mL已融化的培养基分装至直径90 mm的无菌培养皿中,在室温下凝固,经预培养,无菌生长后使用。
2.2 脂肪酸裂解试剂配制 2.2.1 皂化试剂将蒸馏水150 mL与甲醇150 mL混合,加入氢氧化钠45 g至溶剂中,搅拌至完全溶解。
2.2.2 甲基化试剂将盐酸(6.0N)325 mL加至甲醇275 mL中,搅拌混匀。
2.2.3 萃取试剂将甲基-3-丁基醚200 mL加入己烷200 mL中,搅拌混匀。
2.2.4 碱洗涤试剂将氢氧化钠10.8 g加入蒸馏水900 mL中,搅拌至完全溶解。
2.2.5 饱和氯化钠溶液将氯化钠40 g加入蒸馏水100 mL中,搅拌至完全溶解。
2.3 样品萃取过程 2.3.1 菌体收获将经观察有微生物生长的培养皿上蘸取一铂金耳菌苔,在大豆胰蛋白胨营养琼脂培养基(TSA)上,应用三区划线法进行污染菌的分离。在三区划线培养的平板第三区,用直径4 mm无菌接种环轻括菌落的表面,用分析天平称取约40 mg湿重的菌体细胞,收获的细菌置洁净干燥的带螺旋盖培养管中。
2.3.2 皂化在培养管中加入1.0 ml皂化试剂,培养管管口用带特弗龙衬垫的盖子密封,培养管用漩涡振荡器短暂振摇5 ~ 10 s后,放入100℃沸水浴中5 min,取出后振摇5 ~ 10 s,放回100℃沸水浴中继续加热25 min。
2.3.3 甲基化培养管从100℃沸水浴中取出,冷却至常温,开盖,加入2 mL甲基化试剂,加盖后用漩涡振荡器短暂振摇5 ~ 10 s,振摇后,在80℃ ±1℃温度下加热10 min。
2.3.4 萃取培养管从80℃水浴中取出,冷却至常温,加入1.25 mL萃取试剂,封盖,在摇床上轻轻来回振摇10 min,开盖,将管底的水相部分用胶头滴管吸出弃去。
2.3.5 碱洗涤在培养管中加入3 mL碱洗涤试剂至有机相中,封盖,在摇床上轻轻来回振摇5 min,开盖,将上层2/3有机相加入密封的气相色谱样品管中待测。当水相和有机相界面不清时,滴入几滴饱和氯化钠溶液使界面分层清晰。
2.4 样品检测 2.4.1 色谱条件二阶程序温度升到170℃开始,每分钟升高5℃,至260℃止,再每分钟升高40℃,一直到310℃止,过程持续90s。气化室温度250℃,检测器温度300℃;载气为氢气2 mL·min-1;尾吹气为氮气30 mL·min-1,柱前压68.95kPa,进样量加1 uL,进样分流比100:1。
2.4.2 测定法将气相色谱样品管放入气相色谱仪中,自动进样进行检测,检测完成后打印检测报告。
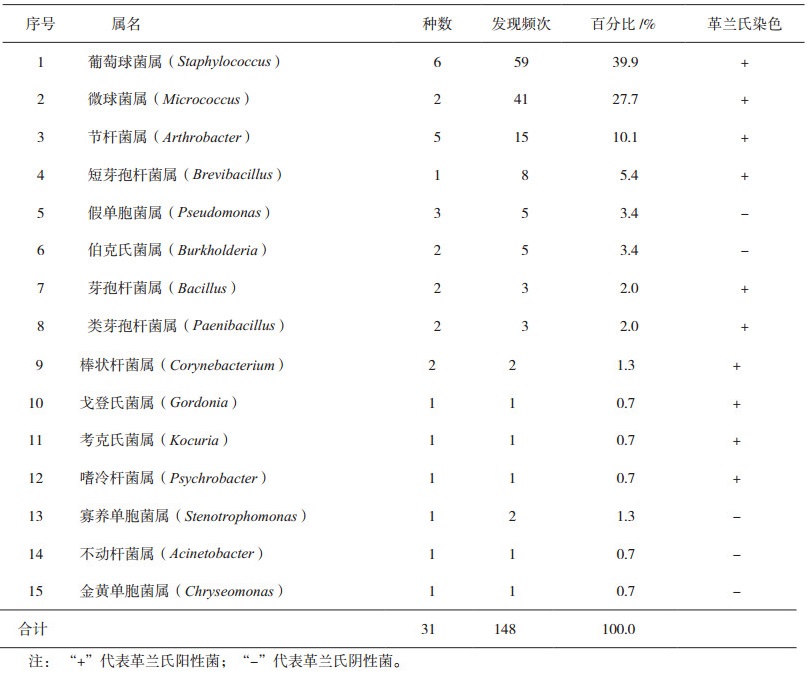
3 实验结果对生产车间洁净区环境监测中收集的148株菌株进行脂肪酸分析鉴定,微生物种属分布情况如表 1所示。在洁净区环境监测中,发现的148个分离菌株分属于15个属31个种,葡萄球菌属细菌占全部分离菌株的39.9%,微球菌属和节杆菌属占全部分离菌株的27.7%和10.1%,三个属细菌占全部分离菌株的77.7%。此外,按格兰氏染色表型特征分析,革兰氏阳性菌占90.5%,革兰氏阴性菌占9.5%。
|
|
表 1 生产车间环境微生物鉴定分属统计结果 |
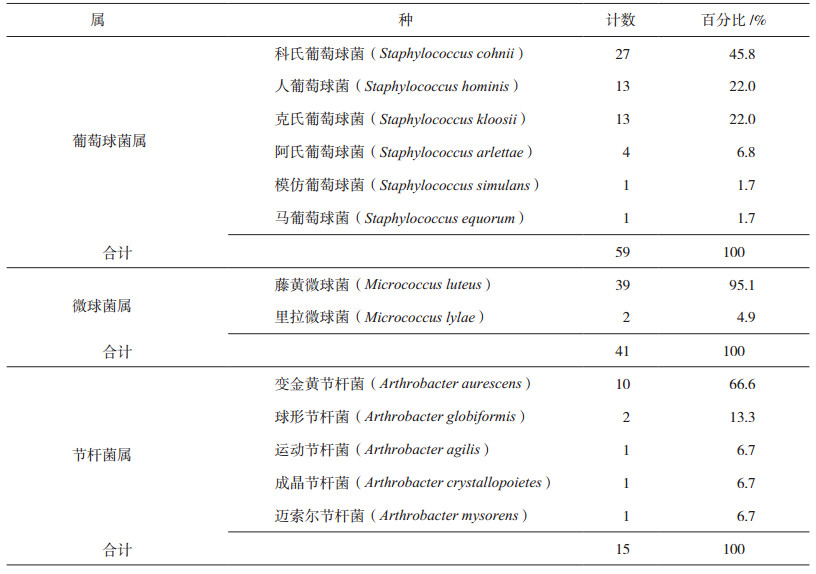
对洁净区环境微生物种的总体分布及葡萄球菌属、微球菌属和节杆菌属三个主要属种的分布情况进行分析,结果见表 2和图 1。
|
|
表 2 生产车间洁净区三个主要种属微生物分布情况 |
|
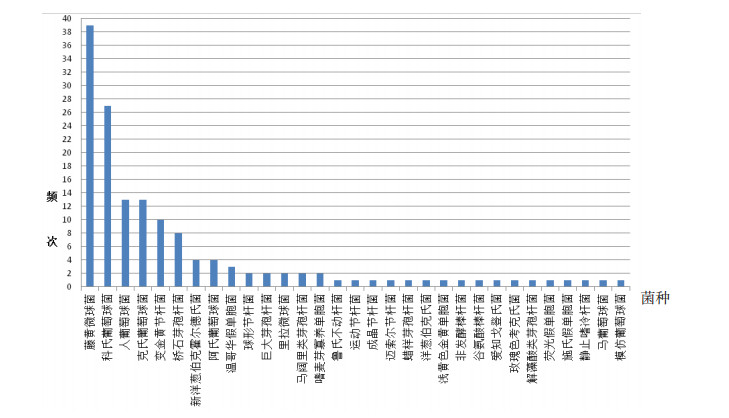
图 1 生产车间洁净区环境微生物种的分布 |
从表 2和图 1可以看出,在葡萄球菌属中以科氏葡萄球菌为主,占该属全部分离菌株的45.8%,在微球菌属中以藤黄微球菌为主,占该属全部分离菌株的95.1%,在节杆菌属中以变金黄节杆菌为主,占该属全部分离菌株的66.6%。
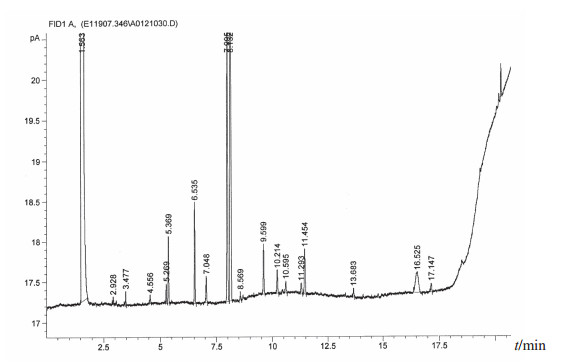
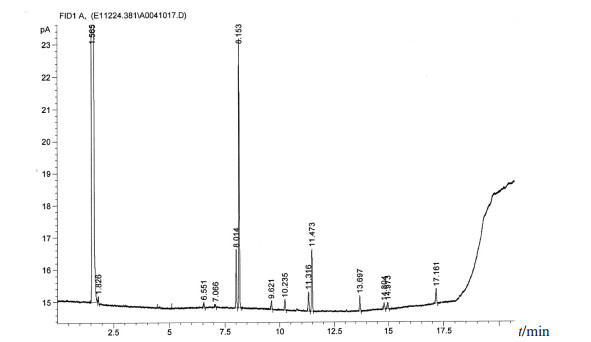
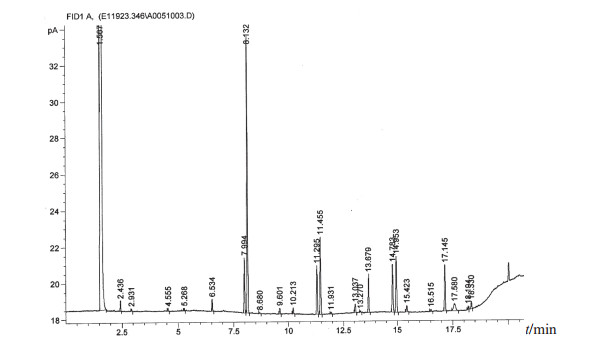
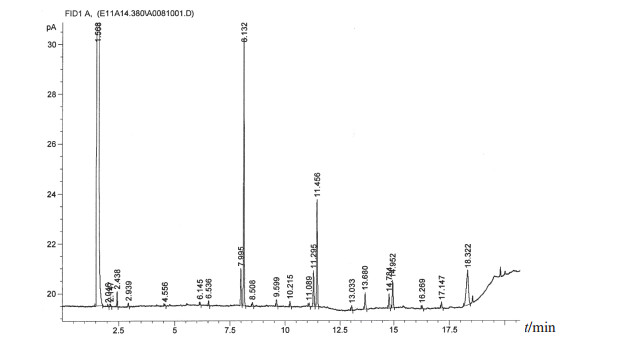
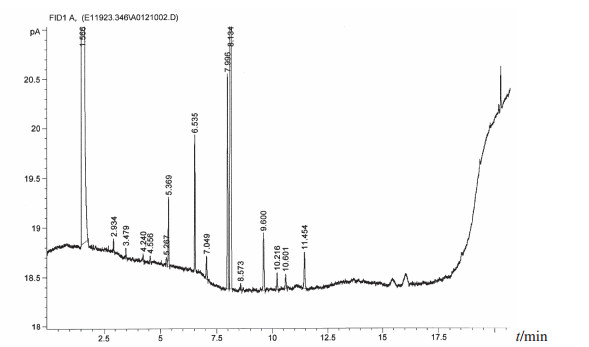
在所有分离菌株中出现频次较高的菌株依次为藤黄微球菌(39株,占26.4%)、科氏葡萄球菌(27株,占18.2%)、人葡萄球菌(13株,占8.8%)、克氏葡萄球菌(13株,占8.8%)和变金黄节杆菌(10株,占6.8%),5种分离菌株占全部分离菌株的69.0%,主要分离菌株的脂肪酸分析图谱见图 2~图 6。
|
图 2 藤黄微球菌脂肪酸分析图 |
|
图 3 科氏葡萄球菌脂肪酸分析图 |
|
图 4 人葡萄球菌脂肪酸分析图 |
|
图 5 克氏葡萄球菌脂肪酸分析图 |
|
图 6 变金黄节杆菌脂肪酸分析图 |
从该项研究微生物菌株所发现的频次看,较高频次的检出菌株主要为人体皮肤上的微生物,如葡萄球菌属、微球菌属等,按表型归类为革兰氏阳性球菌的类群,这个结果与范一灵等[7]报道的结果一致,他们采用生化鉴定和16SrDNA测序技术,发现生产环境细菌性微生物污染以人源性葡萄球菌属细菌为主。由于人体为最大的污染源,因此,规范进入洁净区的人员行为规范和科学合理的清洁消毒程序,将有助于减少由人员导致的微生物污染。
此外,根据原国家药品监督管理局发布的无菌工艺模拟试验指南(无菌制剂),培养基模拟灌装试验所选择的培养基,除按照中国药典要求进行促生长能力试验使用的标准菌株外,还可考虑加入环境监测和无菌检查中发现的典型微生物[8]。通过该项研究发现的典型微生物包括藤黄微球菌、科氏葡萄球菌、人葡萄球菌、克氏葡萄球菌和变金黄节杆菌,药品生产企业可以针对这些环境微生物进行培养基的促生长能力试验,以证明培养基模拟灌装试验所采用的培养基能够监测到日常生产中所发现的典型微生物。
微生物污染是无菌药品质量评价的重要指标,洁净区环境受到污染时,调查溯源非常困难,因此,建立环境污染菌库和微生物污染溯源方法具有重要意义,而微生物污染菌库的建立与微生物鉴定技术密切相关。通过洁净区环境微生物的鉴定和种属分布研究,初步建立了企业环境微生物数据库,但从微生物污染溯源的角度还需建立起原辅料、包装材料、中间体、成品、工艺用水、直接接触药品的压缩空气和氮气、实验室洁净区环境、生产操作和检验人员等的微生物数据库,为微生物污染溯源提供更有力的技术支撑。
现代生物学中可应用于微生物鉴别的技术分为3类:一是生理生化方法,经典技术为法国梅里埃公司的API试剂条和VITEK 2 Compact型全自动微生物鉴定分析仪进行微生物鉴定;二是微生物特征图谱分析方法,经典技术是采用美国MIDI公司Sherlock®微生物鉴定系统进行微生物鉴定;三是分子生物学方法,经典技术是采用细菌16SrRNA和真菌ITS基因测序方法进行微生物鉴定。基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)是最新发展起来的快速微生物鉴定方法,是以微生物核糖体蛋白质作为生物标记物进行的微生物特征图谱分析方法。本研究采用的脂肪酸分析方法是将菌分为需氧、厌氧及酵母在对应的条件下培养一定时间,通过脂肪酸抽提操作后,进行气相色谱检测和全自动分析得到结果,操作简单,实验过程采用普通试剂,成本低,鉴定过程采用Sherlock软件进行GC图谱识别,并与菌种脂肪酸数据库比对,无需人为判断,但该方法受微生物培养情况、脂肪酸抽提过程的干扰影响结果的判断,后期可以结合细菌16SrRNA和真菌ITS基因测序的分子生物学方法进行鉴定,使鉴定结果更为准确。
| [1] |
U.S.Food and Drug Administration.Guidance for Industry, Sterile Drug Products Produced by Aseptic Processing[S]. 2004.
|
| [2] |
国家药典委员会.中国药典2015年版四部[S]. 2015.
|
| [3] |
王勇, 罗惠波, 刘燕梅, 等. 浓香型大曲中多株芽孢杆菌的分离及鉴定[J]. 四川理工学院学报(自然科学版), 2015, 28(2): 5-8. |
| [4] |
宋绍华, 韩娇娇, 裘迪红. MIDI自动鉴定系统在贻贝菌相分析中的应用[J]. 水产科学, 2012, 31(4): 235-239. DOI:10.3969/j.issn.1003-1111.2012.04.011 |
| [5] |
刘燕梅, 王艳丽, 李永博, 等. 气相色谱及气相色谱-质谱联用研究窖泥微生物[J]. 环境化学, 2018, 37(4): 902-905. |
| [6] |
党亚攀, 兰善红. 制浆中段废水处理优势菌的鉴定及其对COD去除效果的研究[J]. 中国造纸, 2017, 36(3): 37-41. |
| [7] |
范一灵, 冯震, 钟玮, 等. 无菌药品生产企业核心区微生物污染调查与分析[J]. 中国药事, 2014, 28(6): 589-594. |
| [8] |
国家药品监督管理局. 2018年第85号关于发布除菌过滤技术及应用指南等3个指南的通告-无菌工艺模拟试验指南(无菌制剂)[ED/OL].(2018-09-11)[2019-04-01]. http://www.nmpa.gov.cn/WS04/CL2050/330190.html.
|
 2019, Vol. 33
2019, Vol. 33