无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药[1]。由于无菌检查无法对整批产品进行百分之百的检验,同时,用于无菌检查的培养基也无法保证能检出所有微生物,所以,药品无菌检查合格并不意味着整批产品一定无菌。在这种情况下,无菌工艺模拟试验作为一种工具,提供了一个评价非终端灭菌产品无菌保障水平的有效方法[2-3]。
无菌工艺模拟试验是指采用适当的培养基或其他介质,模拟制剂或原料药生产中无菌操作的全过程,评价该工艺无菌保障水平的一系列活动。无菌工艺模拟试验也称为“培养基模拟灌装试验”或“培养基灌装”(以下简称模拟试验)[4]。为加强药品生产监管,指导和规范药品生产企业科学系统地开展模拟试验,国家药品监督管理局组织制定了《无菌工艺模拟试验指南(无菌原料药)》和《无菌工艺模拟试验指南(无菌制剂)》,作为实施《药品生产质量管理规范(2010年修订)》的指导性文件,自2018年10月1日起施行[5]。
为正确把握《无菌工艺模拟试验指南》的技术要求,了解模拟试验开展过程中存在的问题,帮助企业规范开展模拟试验,本文统计分析了近三年山东省药品GMP认证中无菌工艺模拟试验方面存在的主要问题并提出了解决对策。
1 检查基本情况2016年1月1日至2018年12月31日山东省共完成无菌制剂药品GMP认证94家/次,其中非最终灭菌产品企业54家/次,占比57%。非最终灭菌产品企业中存在模拟试验缺陷的企业有26家/次,占比48%。无菌制剂检查统计情况见图 1。
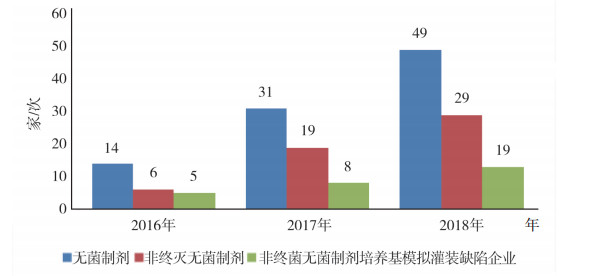
|
图 1 2016-2018年山东省无菌制剂检查情况统计 |
2016年1月1日至2018年12月31日山东省共完成原料药药品GMP认证141家/次,其中无菌原料药企业31家/次且均为非最终灭菌产品。无菌原料药中存在模拟试验缺陷的有4家/次,占比13%。原料药检查统计情况见图 2。
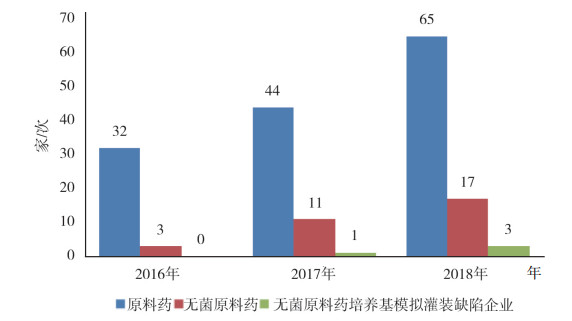
|
图 2 2016-2018年山东省原料药检查情况统计 |
从统计情况可知,无菌制剂检查中模拟试验缺陷比例远大于无菌原料药,这一方面说明无菌制剂中模拟试验问题更为突出,另一方面也说明无菌制剂检查相比无菌原料药检查更为关注模拟试验开展情况。
2 模拟试验问题统计根据无菌药品检查中模拟试验缺陷内容并结合《无菌工艺模拟试验指南》,归纳模拟试验缺陷主要有以下几个方面:人员培训与操作、模拟介质评价、最差条件、干预设计、培养与观察、记录、偏差处理等。对2016-2018年药品GMP认证中存在模拟试验缺陷的30家/次企业缺陷项进行分类统计,发现缺陷频次集中的方面依次是培养与观察、最差条件选择、干预设计、记录、模拟介质评价、人员培训与操作。记录方面问题多是企业在模拟试验开展过程中部分岗位操作或信息未记录造成的,记录方面缺陷往往与其它方面缺陷交叉存在。缺陷问题统计见表 1。
|
|
表 1 模拟试验缺陷问题统计 |
模拟试验的目标是灌装产品零污染。试验结果的可靠性依赖于灌装产品的规范培养与观察,模拟试验的灌装产品须在合适的条件下进行培养,放弃培养的灌装产品应按照标准剔除并记录,在培养期间应定期观察培养情况并在培养结束后逐支进行无菌检查[6]。
灌装产品的培养条件应适宜于一般微生物及环境分离菌的恢复生长。由于灌装产品批量大且需要全部培养,生化培养箱体积往往不能满足培养需求,在这种情况下,很多企业选择自行建设培养室进行培养。现场检查中,培养室温度分布验证不充分、温度监控布点不规范等问题较为集中,企业应该关注这方面的问题。
灌装产品的剔除应按标准进行,并记录剔除原因和数量。如果实际工艺中明确规定受干预影响的产品(容器)应从生产线上剔除,模拟试验时也可剔除;灌装中有密封性缺陷的灌装产品可以作为废品剔除;其他情况如外观缺陷、灌装量异常等均不可剔除。剔除不规范的问题往往从物料平衡中体现出来,企业应关注模拟灌装数量、培养数量、剔除数量、培养后检查数量的平衡,对于出现的偏差进行调查。
培养观察主要包括培养期间的定期观察和培养结束后的无菌检查。在培养期间,应定期观察培养基的培养情况,如在培养期间发现有密封缺陷的灌装产品应进行调查记录。培养结束后,应对所有模拟灌装产品逐支进行无菌性检查,检查方法应经过确认,通常应在合适的照度下进行目视观察。培养观察记录应该及时、准确、全面。
3.2 利用风险评估工具,合理设计最差条件最差条件是指在正常工作条件边缘下对工艺条件进行挑战,以确保所有的工作条件均能保证产品无菌。如果在最差条件下挑战,仍能够达到预期的可接受标准,那么在正常条件下,对系统的可靠性将有更高的信心[3]。应注意的是,最差条件并不是人为创造的超出允许范围的生产状况和环境,也不能用模拟试验结果来为不合理的操作进行辩护。最差条件的合理设计是模拟试验关注的重点。
在实际操作中,最差条件应通过风险评估并结合无菌生产工艺特点来设计。风险评估可以识别、定义和评价无菌生产工艺中对产品无菌潜在的不利影响,常用鱼骨头和失效模式影响分析两种风险评估工具进行[7-9]。风险评估过程中还应结合企业无菌生产线的具体情况,比如生产过程的最多人数可能是造成微生物污染的最差条件,但如果人员减少后操作强度和活动范围增加又会成为新的最差条件。因此,最差条件应是在风险评估的同时结合无菌生产工艺、设备装备水平、人员数量和干预等各方面因素最终确定。
3.3 基于日常生产数据,确定模拟试验干预干预是指由操作人员按照相关规定参与无菌工艺生产的所有操作活动。干预可分为固有干预和纠正性干预。固有干预是指常规和有计划的无菌操作,如设备安装、装载胶塞、更换料桶、取样、环境监控等;纠正性干预是指对无菌生产过程的纠正或调整,如生产过程中清除破碎的瓶子、剔除倒瓶、排除卡住的胶塞、更换部件、设备故障排除等。固有干预及经常发生的纠正性干预一般应在每次模拟中都实施;偶发性的干预可周期性地模拟,如无菌生产过程意外暂停或重启、无菌状态下设备偶发故障排除等。模拟试验中干预设计应与实际的生产活动保持一致,模拟试验不应挑战不合理的干预,以证明其合理性。
试验方案中合理的干预设计是确保干预规范开展的关键。首先,要对日常生产干预进行研究,每半年开展模拟试验前对上一阶段日常生产中的干预类型和干预次数进行回顾和统计分析,确定日常生产的所有干预类型和最大干预次数,确保模拟试验中干预设计与实际的生产活动保持一致。其次,无菌生产过程中所有干预的类型、次数和时间必须以文件的形式确定下来,在试验方案中详细写明干预清单和实施计划。最后,模拟试验中的干预必须逐一记录,并在模拟试验报告中进行确认。
3.4 合理选择模拟介质,充分进行介质评价模拟介质包括促进微生物生长的培养基和安慰剂。模拟介质的选择应该充分考虑被模拟产品的特点以及模拟介质的特性,不合理的模拟介质选择会使模拟试验结果缺乏可信度。通常选择胰酪大豆胨液体培养基,在产品需充惰性气体、储存在无氧条件或环境中反复发现厌氧菌时可选择硫乙醇酸盐液体培养基。此外,还可根据剂型特点、生产工艺及设备选择适当的模拟介质,在使用模拟介质前应对其适用性进行确认,包括无菌试验、抑菌试验、溶解度试验等。
应规范开展培养基的促生长试验,考虑因素包括试验时间、菌种类型、接种量、培养条件等。促生长试验时间选择应在无菌工艺模拟试验开始前及14天培养后。选用菌种包括白色念珠菌、黑曲霉、枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌和生孢梭菌(必要时),还应考虑加入环境监测和无菌检查中发现的典型微生物[10]。促生长试验接种量应小于100 CFU。
模拟试验应充分考虑抑菌因素。抑菌因素主要从模拟介质本身是否存在抑菌特性、模拟工艺过程是否会对微生物有抑制(如模拟冻干过程、模拟充氮操作等)、共线的药物残留是否会抑制微生物生长等方面考虑,模拟试验中应尽量避免抑菌因素的影响。
3.5 重视人员培训,规范人员操作证实人员的无菌操作能力能够满足无菌生产要求,是实施模拟试验的目的之一。模拟试验的参加人员应接受相关培训并通过资格确认,模拟试验过程中应对人员进入洁净区进行控制并记录。
人员培训内容应涵盖无菌工艺涉及的所有方面,至少应包括药品GMP、无菌更衣、无菌操作、微生物知识、洁净室行为规范、无菌工艺模拟试验方案等。进入B级区的所有人员,包括操作人员、检验人员、维修人员等,需要连续3次更衣确认合格才能取得进入B级区资格。
人员控制主要包括记录各区域的进入人员,规定每个人员所允许的无菌操作项目。实际生产中在关键区域进行操作的所有人员均应参加每次的培养基灌装;授权在生产时进入无菌灌装间的所有人员,包括观察人员和维修人员,每年至少应参加一次成功的培养基灌装试验。模拟试验过程中关键区域人员的进入和操作应该进行记录[11]。
4 讨论无菌药品必须满足其质量和预定用途的要求,应最大限度降低微生物、各种微粒和热原的污染。无菌药品的生产须严格按照精心设计并经验证的方法及规程进行,生产过程中人员、操作、设备、工艺过程、环境等方面的控制是达到上述目标的关键[12]。无菌工艺模拟试验是对非最终灭菌药品生产过程中的无菌保障水平的综合评估,通过模拟试验可以证明企业的无菌控制水平能否适应于其无菌产品的生产。
在开展模拟试验过程中,培养与观察、最差条件选择、干预设计、记录、模拟介质评价、人员培训与操作是问题较为集中的方面。企业应该在对无菌生产工艺有充分认知和经验累积的基础上,结合工艺、设备、人员和环境等要素,通过风险评估识别生产过程风险点,科学设计试验方案,确保模拟试验的说服力和可靠性[13]。
虽然模拟试验能有效评价企业无菌保障水平,但同时也有其局限性[5]。首先,企业不能通过模拟试验来证明其某些低于GMP要求的无菌控制方法的合理性。其次,当产品无菌检查出现阳性时,也不能以模拟灌装试验结果来排除生产过程所带来的污染可能性。
| [1] |
国家食品药品监督管理总局.国家食品药品监督管理总局第16号公告《药品生产质量管理规范(2010年修订)》无菌药品等5个附录[S]. 2011.
|
| [2] |
Parenteral Drug Association. PDA Technical Report No.22 Revised Process Simulation for Aseptically Filled Products[S]. 2011.
|
| [3] |
Parenteral Drug Association. PDA Technical Report No.28 Revised Process Simulation Testing for Sterile Bulk Pharmaceutical Chemicals[S]. 2008.
|
| [4] |
方芳, 马其胜, 尹群. 无菌工艺模拟试验的研究[J]. 中国医药工业杂志, 2013, 44(4): 415-419. |
| [5] |
国家药品监督管理局.国家药品监督管理局关于发布除菌过滤技术及应用指南等3个指南的通告[EB/OL]. (2018-07-31)[2019-01-10]. http://www.nmpa.gov.cn/WS04/CL2050/330190.html.
|
| [6] |
国家食品药品监督管理总局食品药品审核查验中心. 2017年度药品检查报告[M]. 北京: 中国医药科技出版社, 2018: 5-20.
|
| [7] |
国家食品药品监督管理局药品认证管理中心. ICH质量管理文件汇编[M]. 北京: 中国医药科技出版社, 2010: 251-261.
|
| [8] |
PIC/S. Recommendation on the Validation of Aseptic Processes[EB/OL]. (2011-01-01)[2019-01-10]. http://www.picscheme.org.
|
| [9] |
Parenteral Drug Association. PDA technical Report No. 44 Quality Risk Management for Aseptic Processes[S]. 2008.
|
| [10] |
中华人民共和国药典: 四部[S]. 2015.
|
| [11] |
曹鸿雁, 韩莹, 胡敬峰. 山东省无菌制剂生产质量风险分析与探讨[J]. 中国药事, 2018, 32(7): 36-40. |
| [12] |
国家食品药品监督管理局药品认证管理中心. 药品GMP指南:无菌药品[M]. 北京: 中国医药科技出版社, 2011: 270-283.
|
| [13] |
刘燕, 申志峰, 陈成. 基于风险评估的吹灌封无菌工艺的验证[J]. 化工与医药工程, 2018, 39(2): 31-37. |
 2019, Vol. 33
2019, Vol. 33 
