药典是一个国家记载药品标准、规格的法典,一般在国家法律中引用并由政府机构执行。国际性药典由公认的国际组织或区域性有关国家协商编订。据世界卫生组织统计,目前全球有30多家药典机构在运作,其中一些拥有悠久的历史,另一些于最近建立[1]。
全球经济一体化发展,进一步促进了生产的国际化。当前,全球医疗健康产业跨越国家和地区的边界。在美国,患者可以从加拿大的药房拿到处方,获得在欧洲生产的药品[2]。药典是各国药品进出口贸易的重要技术桥梁,通过药典的协调,可以促进全球医药产品的自由贸易,确保无论在何地生产销售,世界各地的患者都能获得一致的高质量药品。例如区域性的欧洲药典(EP)、多边的欧美日药典讨论组(PDG),其目标就是协调各方标准,从而尽可能减少技术壁垒,为贸易自由化铺平道路。
2016年,原国家药品监督管理局加入了国际人用药品注册技术协调会(ICH),药品标准的国际协调问题越来越引起监管机构和制药行业的重视,《中华人民共和国药典》(以下简称《中国药典》)与世界主流药典间的协调已是大势所趋。但药典国际协调应遵循的原则、与哪些国际药典协调?如何采用国际协调的药典标准?如何在国际协调基础上坚持本国特色,这些问题目前并没有指导性文件可遵循。本文试图从国外药典的国际协调情况、药品标准外我国其他标准的国际协调法规中探析《中国药典》国际协调的思路。
1 药典国际协调的现实意义对患者而言,药典通过制定适用于大多数企业的标准来促进药品的可及性和质量一致性。对于监管机构,药典为非药品生产质量管理规范(GMP)覆盖的领域提供了方法和指导,促进药品注册,支撑药品监管[2]。采用国际协调的药典分析方法和限度,第一可避免药品监管机构和药品注册申请人在不同地区进行药品注册审评、制定药品标准时可能出现的冲突和重复。第二,药典的国际协调可提高利益相关方(药品行业界、药典机构和药品监管机构)对资源的利用率,同时也降低了国际间药品注册和检查的复杂性。第三,国际协调的药典标准综合了当代先进的科学技术成果,是参与制定的各国药典机构的集体经验的积累。采用国际协调的药品标准有利于提高药品质量,开拓国际市场,也有利于提高制药工业科学技术和生产力的水平。第四,采用国际协调的标准是加入ICH后我国应当履行的义务。第五,采用国际标准是我国法规的明文规定,在《采用国际标准管理办法》(中华人民共和国国家质量监督检验检疫总局令第10号2001年12月4日)第五条规定:制定(修订)我国标准应当以相应的国际标准(包括即将制定完成的国际标准)为基础。对于国际标准中通用的基础性标准、试验方法标准应当优先采用[3]。
2 药典国际协调的情况简介EP代表了在欧洲建立协调统一药典的国际合作模式,是36个欧洲国家以及欧盟的法定药典要求,保证整个欧洲国家的药品质量。EP创建于1964年,在此之前欧洲存在多种药品标准。目前EP还有20多个观察员,包括世界卫生组织、俄罗斯、中国、澳大利亚、巴西和加拿大的药典机构[2]。
1990年,EP、美国药典(USP)和日本药典(JP)三方代表组成了PDG,致力于协调统一三方药典。PDG把药典各论或通则的协调定义为:“当原料药或制剂通过协调的测定方法产生相同的结果并且达到同样的接受或拒绝的决定时,药典通则或其他药典文本是协调的” [1]。当使用完全协调的药典各论或通则时,分析工作者将执行相同的程序,作出相同的接受或拒绝决定,而不用考虑所引用的药典,这被称为具有“互换性”。每个药典将以适当的方式确定每个完全协调的各论和通则。由于药品各论标准协调的复杂性,PDG首先从通用方法的协调入手,并通过ICH Q4B指导原则“药典内容的评估并推荐为用于ICH地区”对协调结果进行审查,在ICH区域内可互换使用,为实现全球统一的药典标准创造了新的机会[4],如表 1所示。
目前,发达国家药典主导国际药品标准的制定。尽管全球许多药典机构都在参与推进药典的国际协调,但大多数是通过参照PDG协调案,USP、EP、英国药典(BP)等国际主流药典,以及ICH指导原则进行协调。例如,在欧洲,作为EP中的关键成员,法国在生物制品、细胞和组织、致敏产品、防腐剂、儿科用药、传统草药等具体议题做出了贡献。俄罗斯药典的未来计划也包括与世界主流药典相应各论的协调。乌克兰支持世界主流药典在发展中国家的协调实施,以促进高质量药品的自由贸易。在乌克兰药典增补本中,根据“复制和采用USP”协议的规定,收载了USP 11项各论标准。在亚洲,JP作为PDG的一方,已协调14个通用方法、11个通则和31个辅料各论。韩国药典的通用方法已经与PDG协调。印度药典通过与世界主流药典协调,提供高质量的药品。哈萨克斯坦药典将进一步与EP、USP协调。在南美洲,巴西药典委员会也在考虑实施PDG协调案。墨西哥虽然还没有与其他药典机构建立正式协调程序,但其60%~100%的药品各论与BP、EP、USP一致。阿根廷药典委员会优先考虑通过在区域内联合制定标准物质、协调通用方法和各论,加强南美洲区域内的药典协调,建立相似的标准。在北美,USP作为PDG的一方,已经协调28个通则和41个辅料。国际药典(Ph. Int.)在全球范围内与各药典机构进行合作,2010年,有3个BP标准被Ph. Int.采纳,并有19个标准正在制定中;2011年,有12个PDG协调案被Ph. Int.采纳,更多的分析方法和通用要求正在制定中[1]。在最新版EP 10.0版和制定中的JP 18版,均逐步扩大了对PDG协调案的收载,同时与ICH Q3A、Q3B、Q3C和Q3D等指导原则更加一致[5-6]。
3 药典国际协调应考虑的问题 3.1 药典国际协调应坚持国家整体利益第一的原则目前,药典国际协调的发展过程主要是由少数西方工业国家药典机构制定,推动发展中国家药典机构接受。制定国家标准和与国际标准协调的方式,都是国家主权的范畴。长期以来,在广大发展中国家经济上处于弱势的情况下,主权成为发展中国家抵御发达国家的实力压迫政策、反对外来干涉和侵略,争取在国际政治经济秩序中获得平等权利和待遇的重要法律武器[15]。《中国药典》应坚持国家整体利益第一的原则,在国际规则下通过合理的行为进行药典的协调,并要求给予《中国药典》充分参与制定国际药品标准的权利。
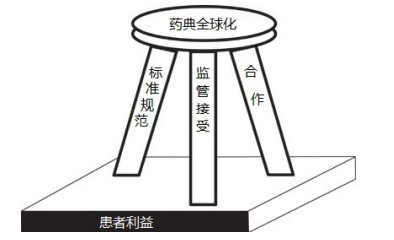
3.2 药典国际协调应遵循“三腿凳子”理论Wiggins J M等[2]认为制定全球协调的药典需要遵循标准化的药典质量规范、加强药典合作,以及须经药品监管机构接受的“三腿凳子”理论,如图 1所示。凳子建立在患者利益的基础上,通过“三条腿”的平衡支撑来实现全球统一药典的目标。
|
图 1 制定全球统一药典的三原则 |
药典国际协调的第一个原则是制定一个标准化的药典质量规范,供各药典在制定标准时参考使用,如见表 2所示。统一的理念、组织、原则、技术规范和质量管理体系将确保制定的药典全球范围内适用,也是各国监管机构接受药典间互换的先决条件。标准化的药典质量规范有些已经在单个药典使用,但未在所有药典中实现统一和全面的应用。
|
|
表 2 标准化药典质量规范应考虑的因素[2] |
药典国际协调的第二个原则是加强药典合作。国际各药典机构间的合作可以建立在现有伙伴关系的基础上,建立标准制定、实施、维护和共享的新机制。各药典机构间合作成功的基础是制定和遵循标准化的药典质量规范,成功的关键是监管部门接受通过标准化实践和合作所完成的工作。药典合作主要考虑的因素包括:1)在制定全球统一和可互换的药典标准方面,寻求并加强药典机构间的合作;2)加强药典和利益相关方之间在药典标准制定和执行方面的合作;3)通过药典机构之间共享信息和资源来提高药典编制的效率;4)前瞻性的协调新增药典各论和通则[2]。
3.2.3 必须经药品监管机构接受和批准药典国际协调的第三个原则是必须要经监管机构的接受和批准。只有监管机构参与并实质支持基于标准化的药典质量规范和药典合作制定出的国际协调的药典,协调的药典标准才具有法律约束力,才有现实意义。面对日益复杂的全球供应链所带来的挑战,协调一致的药典和可互换的标准将有助于监管机构保障药品质量安全有效,同时减少在注册和检查时进行的额外审查和批准。
3.3 采用和参与制定国际协调的药典标准缺一不可采用和参与制定国际协调的药典标准是权利和义务不可偏废的两方面。不参加制定通常必然导致不采用,要采用国际协调的药典标准,先要参加制定工作。在世界贸易组织(WTO)的《技术性贸易壁垒协议》(TBT协议)中明确规定:为避免各成员国通过技术壁垒给国际贸易制造不必要的障碍,WTO的成员国必须采用国际标准,同时也赋予成员国充分的权利参与制修订国际标准[15]。为使《中国药典》标准与国际标准协调一致,要尽可能参加有关国际药典机构组织的、与其已采用或准备采用的标准项目相关的国际药典标准的制定工作。尽管在PDG 39项通则协调案中,《中国药典》已有对应的30项收载,但都尚未与之协调,与PDG协调案存在或大或小的差异。由于我国并未参与PDG的讨论和制定,所以对PDG协调案也无义务全盘接受。
3.4 是否采用国际协调的药典标准应结合我国国情决定就目前而言,如果一项药品标准被I C H、PDG、USP或EP等采用,意味着该标准可能在世界市场广泛应用,带来巨大的经济利益,获得国际竞争优势。其他国家在采用该标准时,则要付出设备调整等费用,在国际竞争中将会处于劣势。在这种形势下,许多国家千方百计地在国际药典协调活动中争取主动权、发言权,并竭力反映本国的要求,体现本国利益[15]。例如ICH Q4附录9(即PDG协调案G06)片剂脆碎度检查法和附录5(即PDG协调案Q02)崩解时限检查法,《中国药典》与ICH(PDG)协调案在仪器装置参数上有所不同。《中国药典》方法仪器参数值的正负区间范围较窄,但都落在ICH方法规定的参数范围内。因此,使用《中国药典》方法在其他ICH区域内的国家进行药品注册时不会影响结果的判定,但使用ICH方法在我国进行药品注册时可能由于仪器参数值落在《中国药典》标准之外而存在判定结果为不合格的风险[16]。
目前,药典国际协调案可大致分为两类,一类是限定性的协调案,另一类是指导性的协调案。限定性的协调案例如上述PDG协调案和ICH Q4指导原则,是确定了达到特定结果的试验方法的一类标准。这类协调案很容易将执行者拘泥在单一解决方案上而没有机会采取其他既可以达到目标又具有经济性的方案[15]。指导性的协调案例如ICH Q8~11指导原则等,最大特点是具有灵活性。这种灵活性为监管机构和企业提供了采用新技术的空间,也容易获得相互承认,但与限定性的协调案相比,可执行性稍差。例如JP18版正在依据ICH Q8、Q11指导原则对与开发、制造相关的指南进行修订[6]。但无论是哪种,都应注意要深入分析是否须要采用国际协调的药品标准,避免盲目采用标准,造成国内市场的不适用。对确定要采用的已有的国际标准,在充分进行验证、试验分析的基础上采用;对在制定中的国际标准,在实质参与制定的基础上采用。
3.4.1 实现药典国际协调需要采用和互认标准在《采用国际标准管理办法》(以下简称《办法》)中,对于如何采用国际标准已有明确规定。该办法第二条明确了“采用国际标准”是指将国际标准的内容经过分析研究和试验验证,等同或修改转化为我国标准,并按我国标准审批发布程序审批发布。该《办法》第二章规定了采用国际标准的原则:制定(包括修订)我国标准应当以相应国际标准为基础。对于国际标准中通用的基础性标准、试验方法标准应当优先采用。除非这些国际标准由于基本气候、地理因素或者基本的技术问题等原因而对我国无效或者不适用。采用国际标准时,应当尽可能等同采用国际标准。由于基本气候、地理因素或者基本的技术问题等原因对国际标准进行修改时,应当将与国际标准的差异控制在合理的、必要的并且是最小的范围之内。如果没有相应的国际标准或者国际标准不适用时,可以采用国外先进标准。该《办法》第三章规定了采用国际标准程度分为等同采用和修改采用。等同采用是指与国际标准在技术内容和文本结构上相同,或者与国际标准在技术内容上相同,只存在少量编辑性修改。修改采用是指与国际标准之间存在技术性差异,并清楚地标明这些差异以及解释其产生的原因,允许包含编辑性修改[15]。加入ICH以后,为履行ICH成员国相关义务,也考虑到借助国际国外标准提高《中国药典》水平,在《中国药典》2020年版编制过程中,参照PDG协调案G02堆密度和振实密度测定法(ICH Q4附录13)、G19固体密度测定法、G11比表面积测定法增订了相关方法,并经过分析研究和试验验证,按照《中国药典》书写格式进行了少量编辑性修改[11-12]。这是《中国药典》等同采用国际协调药品标准的实例。
《TBT协议》鼓励各成员国之间通过签署相互认可协议(MRA)来承认对方的符合性评定程序结果,以避免重复检验。WTO的《实施卫生与植物卫生措施协议》(SPS协议)鼓励世界贸易组织成员以达成相互承认措施和标准的等效性为内容的双边或多边协定为目标进行磋商[13]。同样,各国药监机构和药典机构也应积极考虑接受其他药典标准为等效标准,即使这些标准与本国的不同,只要这些标准能足以实现本国药品监管的目标。由于大部分药典机构都是政府机构,不可避免的存在协调进程自由程度偏低的问题。每个药典都有不同的修订和审批流程,这使得通则和各论的国际协调变得复杂。在此方面,欧盟和美国药监机构做出了审批符合性的互认努力,欧盟指南“关于临床试验中药品化学和质量文件要求”指出,可以接受EP、USP或JP的标准[14-15]。美国食品药品监督管理局(FDA)“关于替代性药典标准可接受性的政策和程序手册”中,提出如果EP、JP等同或优于USP中的相应标准,可以接受申请人使用EP、JP中的辅料、原料药或制剂的标准作为注册申请的一部分[16]。
3.4.2 不采用国际协调的药典标准应有正当理由在WTO相关文件中,对不采用国际标准分为四种情况:一是《TBT协议》中规定的,涉及国家安全、阻止欺诈行为、保护人类健康或安全、保护动物或植物生命或健康、保护环境、基本气候或其他地理因素、基本技术或基础设施等问题,可不采用国际标准;二是《SPS协议》规定的,如存在科学理由,可以采用比国际标准高的国家标准;三是国际标准不考虑本国利益情况下也可不采用;四是各国以正当目标为借口设置技术法规贸易障碍[15]。例如《中国药典》2015年版中9101分析方法验证指导原则的准确度数据要求项下规定“在规定范围内,取同一浓度(相当于100%浓度水平)的供试品,用至少测定6份样品的结果进行评价;或设计3种不同浓度,每种浓度分别制备3份供试品溶液进行测定,用9份样品的测定结果进行评价。”在《中国药典》2020年版的编制过程中,不断有药品审评机构、外资企业向国家药典委员会提出意见,由于中国已加入ICH,希望参照ICH Q2、USP < 1225>分析方法验证指导原则的相关规定进行修改,即删除“取同一浓度(相当于100%浓度水平)的供试品,用至少测定6份样品的结果进行评价”的内容。但此举遭到了部分中药专家和企业的强烈反对,他们提出ICH Q2、USP指导原则在制定中并没有考虑中药分析的特点:一是中药成分一般含量较低,“3个浓度9份样品”的试验方法即使设定为50%、100%、150%加入浓度,所测范围仍有限。中药成分复杂,测定时存在“本底”或基质的影响,测定成分含量较低(或多组分测定含量较低的成分),以低浓度加入时,本底对测定结果的准确测定影响较大;二是中药化学单体对照品一般价格较高,设定3个浓度加入,会明显增加对照品消耗,加大试验成本;三是中药多组分测定时评价中药质量的新趋势,多组分中有些需使用新建立或其他来源的对照品,因研发阶段制备量有限或来源困难,达不到多浓度加入的使用量。鉴于此,经过专家的反复多次讨论,在《中国药典》2020年版草案中,仍保留了准确度实验中“同一浓度6份样品”的实验方法,不删除此项规定,照顾了中药的分析特点,相当于设置了贸易保护措施。”
3.5 在国际协调基础上坚持《中国药典》特色并转化为国际标准各国药典机构的国际协调因地理和经济原因而异,取决于各地区国际一体化进程。在协调的基础上,各药典机构仍保持着自己的特色,侧重点各有不同。国际药典考虑了发展中国家的分析成本,致力于维持其国际适用性。EP支持创新和灵活性,同时不失去药典的目标,即提供官方公认的和可靠的标准,例如过程分析技术(PAT)、近红外分光光度法(NIR)和大样本的可接受标准。除了对EP的贡献外,德国药典聚焦于分析方法,例如利用指纹图谱鉴定材料,使用无损的光谱方法,基于成像技术的制剂评价、痕量杂质分析、认证原料药的简化鉴定。法国药典机构在国家和欧洲两个层面上提出了其未来战略。在线出版物定义新的政策,并根据新的法国法律和国家战略加强实践。USP正在研究光谱成像方法,以确保现场分析的鉴定结果与其他药典或实验室内控精密方法一致[1]。
对具有中国自主知识产权的特色药品标准,应争取将该标准转化为国际标准,或通过出口、技术交流等途径使其他药典机构采用《中国药典》标准。例如《中国药典》2015年版新增的《中药材DNA条形码分子鉴定法指导原则》,利用基因组中一段公认的、相对较短的DNA序列进行物种鉴定,用于中药材(包括药材及部分饮片)及基原物种的鉴定,是传统形态鉴别方法的有效补充。2016年,BP派人专程到该指导原则的起草单位学习DNA条形码、高通量测序、药材质量分析和生物信息技术[17],并在2017版《英国药典》第五卷补充信息中收载了“DNA条形码技术作为植物鉴定草药的工具”一章[18]。这是国外药典采用《中国药典》先进特色标准的实例。
4 对《中国药典》国际协调的建议 4.1 建立健全国际协调的制度规范一是建立完善的国际和国外药典标准跟踪机制,及时跟踪国际和国外药典标准,全面掌握国际国外标准核心动向,把适用的国际标准转化为《中国药典》标准,为重点参与、主导制定国际标准提供依据,为开展前瞻性的协调指明方向。二是制定相关制度文件,明确不采用国际标准、为了我国国家利益等正当目标有针对性、抑制性和限制性地阻挡国外产品进入我国等情形应采取的措施。
4.2 充分行使制定国际药品标准的权利在2020年版《中国药典》的编制过程中,ICH其他成员国的外企十分关注《中国药典》和ICH、USP、EP等国际国外药典标准协调一致的问题,担忧《中国药典》没有充分采用ICH Q4指导原则给本企业产品进入中国造成障碍。但是,由于大多数国际协调的药品标准是以欧美日发达国家标准为基础制定,对发达国家适用,难以反映我国的技术要求和经济利益。另一方面,部分PDG和ICH Q4指导原则的制定日期已在十年前,虽然有一些正在修订,但部分实际上已经是相对落后、急待更新的标准。国内市场是《中国药典》可以依靠的最大阵地,在推进采用国际标准的同时,要保障《中国药典》充分行使制定国际标准的权利,更多地反映中国的利益。在相互竞争的技术标准中,优先扶持国内药品标准的研究和开发,将我国在国际上处于领先地位的科研成果及重大的技术变化及时转为技术标准,并推荐为国际标准,在国际贸易中采用,使其得到更大的发展,为我国药品顺利进入市场创造条件。
随着中国经济与世界经济的不断接轨,《中国药典》需要进一步加大参与国际药典协调的力度,积极参加国际药典的协调活动,扩大《中国药典》国际影响,参与国际药品标准的制修订,引进国外先进科学技术,提高我国药品标准水平,积极将我国药品标准纳入国际标准,促进对外贸易、国际药品质量认证和经济技术合作,维护我国的合法权利。
| [1] |
World Health Organization. Review of World Pharmacopoeias[EB/OL]. (2013-03)[2019-07-04]. https://www.who.int/medicines/areas/quality_safety/quality_assurance/resources/InternationalMeetingWorldPharmacopoeias_QAS13-512Rev1_25032013.pdf?ua=1.
|
| [2] |
Wiggins J M, Skutnik J A, Shimek-Cox J L, et al. The Ideal Pharmacopeia[J]. Pharmaceutical Technology, 2008, 32(11): 122-125. |
| [3] |
国家质量监督检验检疫总局.采用国际标准管理办法[E B/O L]. (2001-12-04)[2019-08-20]. http://www.aqsiq.gov.cn/xxgk_13386/jlgg_12538/zjl/20012002/200610/t20061027_239119.htm.
|
| [4] |
徐昕怡, 许华玉, 靳桂民, 等. 各国药典理化检验方法通则(附录)概况分析[J]. 中国药学杂志, 2018, 53(15): 1323-1332. |
| [5] |
Cathie VIELLE. 10th Edition of the Ph. Eur. Summary of Achievements[S]. 2019.
|
| [6] |
日本药品医疗器械综合机构(PMDA).日本药典的制作方针和药品各条的讨论体制[S]. 2019.
|
| [7] |
United States Pharmacopoeia. Harmonization Status for General Chapters[EB/OL].[2019-08-13]. https://www.usp.org/harmonized-standards/pdg/general-chapters.
|
| [8] |
United States Pharmacopoeia. Harmonization Status for General Methods[EB/OL].[2019-08-13]. https://www.usp.org/harmonized-standards/pdg/general-methods.
|
| [9] |
United States Pharmacopoeia. Harmonization Status for Biotechnology[EB/OL].[2019-08-13]. https://www.usp.org/harmonized-standards/pdg/biotechnology.
|
| [10] |
The International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use. ICH Q4B: Evaluation and Recommendation of Pharmacopoeial Texts for Use in the ICH Regions[EB/OL].[2007-11-01]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q4B/Step4/Q4B_Guideline.pdf.
|
| [11] |
国家药典委员会.堆密度和振实密度测定法[EB/OL]. (2019-5-24)[2007-11-01]. http://www.chp.org.cn/upload/userfiles/20190524/1581558686743821.pdf.
|
| [12] |
国家药典委员会. 《中国药典》2020年版四部通则(草案)[M].第一版.北京: 中国医药科技出版社, 2019: 297, 131, 136.
|
| [13] |
施海枢.论技术法规和产品标准的国际协调问题[D].北京: 中国政法大学, 2006.
|
| [14] |
徐昕怡, 刘贞, 张震, 等. 中国药典片剂脆碎度检查法增修订回顾及与ICH协调的展望[J]. 中国药师, 2019, 22(6): 1138-1140. DOI:10.3969/j.issn.1008-049X.2019.06.040 |
| [15] |
European Medicines Agency Inspections. European Guideline on the Requirements to the Chemical and Pharmaceutical Quality Documentation Concerning Investigational Medicinal Products in Clinical Trials[EB/OL].[2019-08-13]. https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-10/18540104en_en.pdf.
|
| [16] |
US Food and Drug Administration. US Food and Drug Administration's Manual of Policies and Procedures on Acceptability of Standards from Alternative Compendia[EB/OL].[2019-08-13]. https://www.fda.gov/media/72412/download.
|
| [17] |
英国药典委员会专家来中药所学习中药DNA条形码鉴定技术[EB/OL].[2019-08-13]. http://www.catcm.ac.cn/zykxyydd/zhxw/201506/08d4ea32aa014315836191277a94ad77.shtml.
|
| [18] |
British Pharmacopoeia. Supplementary Chapters VⅡ D DNA Barcoding as a Tool for Identification of Herbal Drugs[S]. 2017.
|
 2019, Vol. 33
2019, Vol. 33