乙型脑炎病毒为黄病毒科黄病毒属的单股正链RNA病毒,其基因组全长约11kb,5’端有帽状结构,3’端无Poly A尾巴。黄病毒属病毒属于非逆转录RNA病毒,因其复制过程为RNA-RNA而不形成DNA中间体,故无法直接对其基因组进行操作。RNA病毒反向遗传学技术,又称为“病毒拯救”技术,通常是在低拷贝质粒载体中插入含有整个病毒基因组cDNA的大片段,构建感染性的全长cDNA克隆,线性化后通过体外转录得到病毒RNA,再把病毒RNA转染到敏感细胞中以拯救出活病毒。病毒拯救技术解决了病毒RNA基因组操作困难的问题,为进一步研究病毒RNA打下了良好的基础。目前,许多RNA病毒的全基因组感染性克隆已经构建成功,例如黄热病毒、登革病毒、EV71病毒等等,极大地推进了这些RNA病毒的研究。
报告基因是一种表达产物容易被检测到的基因,如荧光素酶基因等。在感染性克隆的病毒全基因组中插入报告基因,通过体外转录和细胞转染,拯救出携带报告基因的病毒,通过检测报告基因表达产物就可以清楚地掌握病毒的生长情况。由于具有检测耗时短、灵敏度高等优点,可用于病毒感染机制、感染动态分布、病毒滴度测定等多个方面。
本研究利用反向遗传学技术在乙型脑炎病毒全长cDNA克隆的基础上,尝试将其作为表达载体在病毒基因组5’非编码区(5’-UTR)与C蛋白编码区之间插入外源报告基因F-LUC,以期获得既能保持乙脑减毒疫苗株SA14-14-2的减毒特性,又能稳定表达F-LUC的重组病毒,用于乙脑病毒及疫苗的多种研究。
1 材料与方法 1.1 质粒、细胞、病毒与动物pACNR-JEV质粒由成都生物制品有限责任公司提供;pGl3(含F-LUC基因)购自promega公司;BHK21细胞由中国食品药品检定研究院虫媒病毒疫苗室传代与保存;乙脑病毒疫苗株SA14-14-2由成都生物制品有限责任公司提供;昆明种小鼠(KM小鼠)由中国食品药品检定研究院动物实验中心提供,动物合格证号:SYXK(京)2017- 0013。
1.2 主要试剂限制性内切酶BspEI(批号0061605)、AscI(批号10028227)和XhoI(批号10017550),绿豆核酸酶(批号10020225),Q5热启动超保真2×Master Mix(批号10022725)购于NEB公司;GoScript Reverse Transcription System(批号0000308495),体外转录试剂盒[RiboMAXTM Large Scale RNA Production Systems(SP6),批号0000341068],荧光底物Bright-GloTM Luciferase Assay System(批号0000253607)购于Promega公司;RNA提取试剂盒(Qiagen RNeasy Mini Kit,批号160021975),质粒大量提取试剂盒(QIAfilter Plasmid Maxi Kit,批号157026030)购于Qiagen公司;pEASY-Uni Seamless Cloning and Assembly Kit(批号M10116)购于北京全式金公司。
1.3 pACNR-FLUC-JEV全长cDNA的构建以pACNR-JEV为模板,扩增第1段序列(SP6- 5’UTR-C34),C34为C蛋白N端的34个氨基酸,提供病毒复制必须的顺式作用元件[1],以pGl3为模板,扩增第2段序列(F-LUC),以第1段和第2段序列为模板,融合PCR,扩增第1+2段序列(SP6- 5’UTR-C34- F-LUC);以pACNR-JEV为模板,扩增第3段序列(C-PrM-E-NS1);同时用BspEI和AscI双酶切pACNR-JEV质粒;用pEASY-Uni Seamless Cloning and Assembly Kit试剂盒将以上3个片段无缝拼接起来,即可获得pACNR-FLUC-JEV重组质粒。如图 1所示。
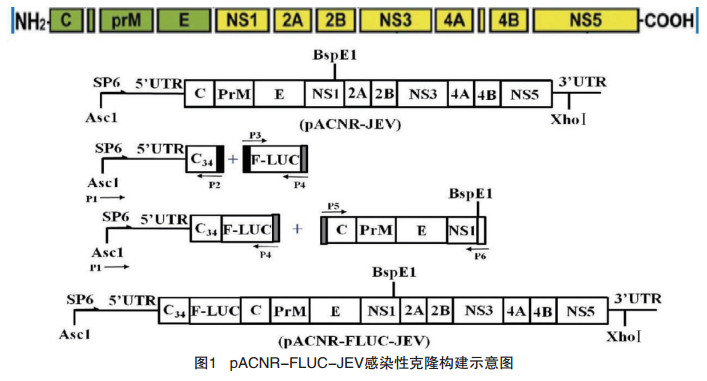
|
图 1 pACNR-FLUC-JEV感染性克隆构建示意图 |
利用内切酶XhoI对pACNR-FLUC-JEV重组质粒进行线性化,回收线性化后的质粒用于体外转录。用Qiagen RNeasy Mini Kit回收反应体系中的RNA,用无RNase的ddH2O溶解并测定RNA浓度。
1.5 电转染BHK21细胞提前预冷0. 2 c m电转杯,将1 6 0 μ L细胞BHK 21悬液(3~5×106)和35μL纯化好的RNA(2~3μg)加入电击杯中并混匀,用伯乐电转仪预设程序进行电转。转染24 h后换液,在37℃含5% CO2培养箱中继续培养,直到能够观察到细胞发生病变或者可能病变时收获病毒液。
1.6 重组病毒的RT-PCR及测序鉴定对拯救得到的重组病毒JEV-FLUC进行鉴定,提取病毒RNA经反转录后,设计引物用于扩增重组病毒的全部基因片段,送Invitrogen公司测序。
1.7 重组病毒的荧光鉴定(细胞水平)分别于转染细胞后12、24、48、72和96 h取病毒培养液上清,用多功能酶标仪检测荧光素酶活性。在第一孔中加入25μL待测病毒,之后依次向其后各孔做5倍稀释。将100μL BHK21细胞(5×105 cells·mL-1)加入各待测孔中,然后边缘使用200μL无菌水封边。将上述96孔板放于5%CO2,37℃培养箱中培养48 h后检测。每孔吸弃100μL液体,加入100μL Bright-GloTM荧光检测试剂,避光室温放置2 min后,反复吹打,转移150μL液体置空白酶标板中。使用多功能酶标仪检测F-LUC荧光值。
1.8 重组病毒的荧光鉴定(动物水平)取4只12~14 gKM小鼠,每只均经腹腔注射105PFU的JEV-FLUC重组病毒,分别在接种病毒后的24、48和72 h后通过腹腔途径注射戊巴比妥钠(100 mg·kg-1)将小鼠麻醉,同时将发光底物D-luciferin(100 mg·kg-1)腹腔途径注射,10 min后使用IVIS Lumina Series Ⅲ Imaging System动物活体成像系统获取图像。
2 结果 2.1 pACNR-FLUC-JEV感染性克隆的构建pACNR-JEV-FLUC感染性克隆经PCR鉴定正确(如图 2所示),同时测序结果表明该质粒的全长序列与目标序列完全一致。
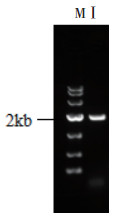
|
M:DNA marker (DL10000);I:pACNR-JEV-FLUC克隆。 图 2 PCR产物凝胶电泳鉴定JEV-FLUC阳性克隆 |
提取拯救出的重组病毒R N A,逆转录为cDNA,测序比对,发现该重组病毒的全基因组序列与JEV-FLUC感染性全长克隆完全一致,没有发生任何突变。
2.3 重组病毒在细胞水平的荧光表达JEV-FLUC感染性克隆体外转录获得的RNA转染到BHK21细胞后,随着时间的增加,荧光素酶的活性在逐渐增强(如图 3所示),表明重组病毒可成功表达荧光素酶,并且表达量与病毒复制增殖时间呈正相关。

|
图 3 重组JEV-FLUC病毒荧光素酶活性曲线 |
结果表明,重组JEV-FLUC病毒感染后第2天和第3天,可以在小鼠腹腔检测到FLUC阳性信号,表明病毒在小鼠体内正常扩增,带荧光素酶重组病毒拯救成功(图 4)。

|
图 4 小鼠腹腔感染重组JEV-FLUC病毒后活体成像图 |
RNA病毒的cDNA克隆制备在实际操作中常遇到许多常规分子生物学难以解释的问题,推测可能是在基因组5’端序列中存在潜在的启动子,使得转化到细菌后的全长克隆可表达对细菌生长有破坏作用的外源蛋白,同时使病毒自身的基因序列不稳定。许多研究表明黄病毒基因组cDNA全长或部分克隆不稳定,在大肠杆菌中倾向于插入外源序列、自发重排、缺失核苷酸或发生点突变而变异,严重影响了病毒基因组全长的完整性及病毒体外拯救效率[2]。随着反向遗传学技术的发展,目前,许多实验室已经可以逐渐解决这一难题并得到了完整的病毒全长感染性克隆,这些方法包括:(1)使用BAC、pACNR等低拷贝数的质粒载体和E. coli HB101菌株,使之易于得到稳定性的克隆[3-5];(2)将内含子插入到cDNA序列的易变区以阻止对宿主菌有害作用蛋白的产生,获得能在细菌中稳定生长的质粒,而内含子在真核细胞表达时被切除,可产生与病毒原来序列相同的RNA,目前,已有采用此策略成功地拯救出乙型脑炎病毒(JEV)的例子[6-7];(3)优化培养条件,通过降低摇床转速和抗生素使用量来降低病毒全长基因组在细菌中的扩增速度,最终降低病毒基因组对大肠杆菌的毒性效应来获得稳定的病毒全长感染性cDNA克隆。
乙型脑炎病毒为单股正链RNA病毒,其基因组为一个大的开放阅读框,两侧为非编码区。两端的非编码区虽然不直接参与病毒的生活周期,但对于病毒自身复制和转录调控非常重要[8-9]。非编码区的任何插入、缺失和点突变都可能影响到病毒的复制和转录,造成病毒拯救失败。目前,已有一些利用乙型脑炎病毒或与其同属于黄病毒科的其他病毒表达外源基因的报道[10-11]。Yun等人[12]通过在病毒3’非编码区的NsiI酶切位点插入外源基因的方式,获得了外源基因的表达,并通过在不同位置插入不同大小的外源基因对乙型脑炎病毒作为载体的研究进行了优化,不仅外源基因表达效率高,拯救病毒的滴度也较高。Bonaldo等[13]通过在黄热病毒的NS1和E基因之间插入外源基因表达,该方法拯救出病毒的滴度能够高达6.0 logPFU·mL-1,外源基因能够高效地表达。通过10次病毒传代,外源基因能够非常稳定地存在于黄热病毒基因组中。
但在随后对这类病毒载体的稳定性进行研究时发现,外源基因在乙型脑炎病毒载体中并非稳定存在,随着病毒传代次数的增加,出现外源基因丢失的情况。这是由于黄病毒属病毒本身存在基因组不稳定的情况,容易出现片段缺失、突变。况且插入外源基因之后,更加增加了宿主的压力,使得宿主在传代中适应性地造成外源基因的缺失。我们在乙型脑炎病毒基因组5’非编码区之后插入了F-LUC报告基因,经体外拯救获得的重组病毒能表达外源荧光素酶基因,且与病毒毒力强弱相关的E蛋白中8个关键位点氨基酸序列均未发生突变,至于拯救的重组病毒JEV-FLUC的后续传代稳定性如何还需进一步通过病毒传代来证实。
综上所述,本研究应用乙型脑炎病毒反向遗传学技术体系,探索性地尝试了以其作为载体用于外源基因的表达,为将来利用乙型脑炎病毒为载体来构建嵌合病毒类疫苗打下了坚实的基础。本研究成功构建了带有F-LUC荧光素酶报告基因的JEV SA14-14-2乙脑全长感染性克隆并成功拯救出了带荧光素酶的重组病毒。拯救出的重组乙脑病毒具有极大应用价值。首先,可以利用JEV-FLUC重组病毒对小鼠进行感染试验,通过动物活体成像系统检测F-LUC信号,从而对小鼠体内乙脑病毒感染过程和不同时间乙脑病毒的体内分布情况进行动态观察。其次,还可以将带荧光素酶的重组病毒用作乙脑疫苗免疫效果评估时中和用病毒,与乙脑血清中和后,通过检测荧光素酶活性而得出抗体效价情况,建立节省时间并具高灵敏度的乙脑中和抗体高通量筛选方法。
| [1] |
张波, 李晓丹, 秦成峰, 等.一种带有荧光素酶基因的JEV感染性克隆及构建方法和应用: CN 103497972 A[P]. 2014-01-08.
|
| [2] |
郭雄明, 吴东. 黄病毒属病毒感染性克隆的构建及应用[J]. 军医进修学院学报, 2007, 228(1): 75-77. DOI:10.3969/j.issn.1005-1139.2007.01.030 |
| [3] |
Yun S I, Kim S Y, Rice C M, et al. Development and Application of a Reverse Genetics System for Japanese Encephalitis Virus[J]. J Virol, 2003, 77(11): 6450-6465. DOI:10.1128/JVI.77.11.6450-6465.2003 |
| [4] |
Rasmussen T B, Risager P C, Fahnoe U, et al. Efficient Generation of Recombinant RNA Viruses using Targeted Recombination-mediated Mutagenesis of Bacterial Artificial Chromosomes Containing Full-length cDNA[J]. BMC Genomics, 2013, 14(1): 819. DOI:10.1186/1471-2164-14-819 |
| [5] |
Shi P Y, Tilgner M, Lo M K, et al. Infectious cDNA Clone of the Epidemic West Nile Virus from New York City[J]. J Virol, 2002, 76(12): 5847-5856. DOI:10.1128/JVI.76.12.5847-5856.2002 |
| [6] |
Yamshehikov V, Mishin V, Comineni F. A New Strategy in Design of RNA Virus Infectious Clones Enabling Their Stable Propagation in E. coli[J]. Virology, 2001, 281(2): 272-280. |
| [7] |
Pu S Y, Wu R H, Yang C C, et al. Successful Propagation of Flavivirus Infectious cDNAs by a Novel Method to Reduce the Cryptic Bacterial Promoter Activity of Virus Genomes[J]. J Virol, 2011, 85(6): 2927-2941. DOI:10.1128/JVI.01986-10 |
| [8] |
Fan Y H, Nadar M, Chen C C, et al. Small Noncoding RNA Modulates Japanese Encephalitis Virus Replication and Translation in Trans[J]. Virol J, 2011, 8: 492. DOI:10.1186/1743-422X-8-492 |
| [9] |
Chien H L, Liao C L, Lin Y L. FUSE Binding Protein 1 Interacts with Untranslated Regions of Japanese Encephalitis Virus RNA and Negatively Regulates Viral Replication[J]. J Virol, 2011, 85(10): 4698-4706. DOI:10.1128/JVI.01950-10 |
| [10] |
Bonaldo M C, Garratt R C, Caufour P S, et al. Surface Expression of an Immunodominant Malaria Protein B Cell Epitope by Yellow Fever Virus[J]. J Mol Biol, 2002, 315(4): 873-885. DOI:10.1006/jmbi.2001.5258 |
| [11] |
Li X F, Deng Y Q, Yang H Q, et al. A Chimeric Dengue Virus Vaccine using Japanese Encephalitis Virus Vaccine Strain SA14-14-2 as Backbone Is Immunogenic and Protective against Either Parental Virus in Mice and Nonhuman Primates[J]. J Virol, 2013, 87(24): 13694-13705. DOI:10.1128/JVI.00931-13 |
| [12] |
Yun S I, Choi Y J, Yu X F, et al. Engineering the Japanese Encephalitis Virus RNA Genome for the Expression of Foreign Genes of Various Size:Implications for Packaging Capacity and RNA Replication Efficiency[J]. J Neuro Virol, 2007, 13(6): 522-535. |
| [13] |
Bonaldo M C, Mello S M, Trindade G F, et al. Construction and Characterization of Recombinant Flaviviruses Bearing Insertions between E and NS1 Genes[J]. Virol J, 2007, 4: 115. DOI:10.1186/1743-422X-4-115 |
 2019, Vol. 33
2019, Vol. 33 
