根据药品注册的国际技术要求中杂质的含义,杂质分为有机杂质、无机杂质和残留溶剂。有关物质是杂质的一种,主要是指有机杂质,它可能是原料药合成过程中带入的原料药前体、中间体、试剂、分解物、副产物、聚合体、异构体以及不同晶型、旋光异构的物质,也可能是制剂过程或是在贮藏、运输、使用过程中产生的降解物[1]。
目前,有关物质的检查方法很多,主要有薄层色谱法、高效液相色谱法(HPLC法)、气相色谱法和紫外分光光度法等。其中,HPLC法由于分离效果好、专属性强、灵敏度高,在有关物质检查中最为常用[2-6]。在采用HPLC法对药物进行有关物质分析时,一般要求考察最大杂质峰面积或各杂质峰面积的和,将其与对照溶液的主峰面积(主成分自身对照品法)或总峰面积(面积归一化法)比较,规定应不超过某一特定的数值。但在实际检验过程中,排除配样引进或者是柱子没冲干净这些因素外,色谱图上仍然会出现保留时间较弱的峰,易被误认为是杂质峰,从而造成结果的误判。笔者结合日常检验工作和相关文献,选取了几个具有代表性的品种,将这些易被误认为是杂质峰的峰归纳为溶剂峰、有机酸盐峰、无机酸盐峰和辅料峰,并对这些峰的形成原因进行分析,以期对药物的有关物质HPLC方法的研究和常规检查提供参考。
1 溶剂峰在HPLC法中,由于溶解对照品或供试品的溶剂和流动相在某一波长的吸光值不一样,因此产生了吸光值的变化,表现为出现溶剂峰。溶剂峰可能是正常形状的峰,也可能是倒峰,还有可能是一组奇形怪状的峰。减小该类溶剂峰最有效的方法是使用流动相作为溶剂溶解样品,这样既可以避免样品溶剂和流动相之间任何强度或黏度的不匹配,也可以减少样品分析时基线的漂移[7]。
此外,值得注意的是,在进行有关物质分析时,要等基线平稳后,再进溶剂。一般进样2次,计算供试品溶液的杂质峰时,溶剂峰位置的峰是不参与计算的[8]。
2 有机酸盐峰《中华人民共和国药典》(以下简称《中国药典》)2 0 1 5年版(二部)[9]采用H P L C法对苯磺酸氨氯地平的有关物质进行控制。以甲醇-乙腈-0.7%三乙胺溶液(取三乙胺7.0 mL,加水至1000 mL,用磷酸调节pH值至3.0±0.1)(35:15:50)为流动相,色谱柱为十八烷基硅烷键合硅胶柱,检测波长为237 nm。标准规定:氨氯地平杂质I峰的峰面积乘以2与其他各杂质峰面积的和应不得大于对照溶液主峰面积的1.5倍(1.5%)。实际检测时,氨氯地平的出峰时间为17.5 min,但是在溶剂峰出峰的位置有响应较高的峰(保留时间3.0 min),色谱图见图 1。若将该峰判定为杂质峰,则会出现有关物质超标的情况。将苯磺酸配制成一定浓度进样后最终确定该峰为苯环酸的峰。也有研究[10]采用液相色谱-四级杆飞行时间质谱联用对苯磺酸的出峰予以确证。苯磺酸为一元有机酸,其pKa为0.7,在通常的流动相pH范围内,苯磺酸氨氯地平主要解离为氨氯地平阳离子(被质子化)和苯磺酸阴离子(C6H5SO3-),因此,苯磺酸氨氯地平会出现两个峰,一个是苯磺酸(保留时间较短),一个是氨氯地平。

|
a.供试品溶液;b.苯磺酸。 图 1 苯磺酸氨氯地平有关物质检查 |
同时,纪宇等[11]研究表明,采用反相HPLC法同时测定复方感冒药中的多种成分时,对马来酸氯苯那敏色谱峰的识别易出现判断错误,将马来酸的峰误认为是马来酸氯苯那敏。马来酸为二元有机酸,其pKa分别为2.00和6.26,在通常的流动相pH范围内,马来酸氯苯那敏主要解离为氯苯那敏阳离子(被质子化)和马来酸阴离子(HOOCCH=CHCOO-),因此,马来酸氯苯那敏也会出现两个峰。
在色谱系统开发过程中,一般会调节流动相pH,与目标化合物pKa相差2个单位以上,使药物全部解离或结合,这样才能准确定量。对于带有机酸根的化合物的液相检测,比如马来酸氯苯那敏、富马酸喹硫平、苯磺酸氨氯地平,在选择的流动相pH条件下,若目标化合物以离子型存在,则马来酸、苯磺酸和富马酸等有机酸也会以盐的形式存在,这些有机酸因含有共轭结构均有紫外吸收,从而在液相条件下也会出现一个色谱峰。因此,做此类物质的有关物质和含量测定时就应注意,不应将有机酸的峰误认为是杂质峰,或者是将有机酸的峰误认为是目标化合物的峰,造成结果的误判。
3 无机酸盐峰《中国药品标准》 [12]采用HPLC法检测盐酸左氧氟沙星氯化钠注射液的有关物质。以硫酸铜D-苯丙氨酸溶液(取D-苯丙氨酸1.32 g与硫酸铜1 g,加水1000 mL溶解后,用氢氧化钠试液调节pH值至3.5)-甲醇(82:18)为流动相,检测波长为293 nm。标准规定,供试品溶液色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液主峰面积。实际分析时,在3.3 min出现一个很大的峰,色谱图见图 2。经过分析,认为与盐酸稀释后进样的峰位相同,因而在计算有关物质时不应将该峰误认为是杂质峰。
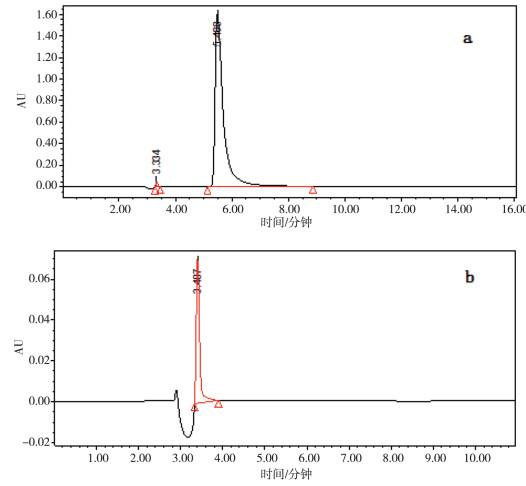
|
a.供试品溶液;b.稀盐酸。 图 2 盐酸左氧氟沙星氯化钠注射液有关物质检查 |
笔者在参与针对新版药典用的氢溴酸右美沙芬化学对照品的标化工作中,参照《中国药典》 2010年版(二部)[13]氢溴酸右美沙芬胶囊含量测定的方法,对氢溴酸右美沙芬进行有关物质检查,流动相为乙腈-磷酸盐缓冲液(取磷酸和三乙胺各5 mL,加水至1000 mL)(28:72),检测波长220 nm,实际检测时发现在2.5 min出了一个很大的色谱峰。为了验证该峰,用溴水稀释后直接进样分析,结果在同样位置出峰。见图 3。因此,在结果判定时,应注意不要误将该峰归纳入杂质峰。

|
a.供试品溶液;b.溴水。 图 3 氢溴酸右美沙芬有关物质检查 |
类似于含有有机酸的药物,含有无机酸的药物在通常的流动相pH条件下也均会发生解离,以盐形式存在的化合物进入液相系统后会以游离碱的形式存在,盐酸和氢溴酸是强酸,也在流动相里解离形成氯离子和溴离子。肖欣等[14]在对不同水中氯离子含量的比对分析中,用1 cm的石英比色皿,取一定浓度的氯化钠标准溶液作为待测液,采用紫外-可见分光光度计,扫描范围280~350 nm,确定了氯离子在波长为308.7 nm左右处有最大吸收。吕伟等[15]研究也验证了溴离子在200~220 nm波长范围内有较强的紫外吸收。分析原因,可能是氯离子和溴离子有8电子的稳定结构而导致紫外吸收,具体原因还有待进一步分析。
4 辅料峰药用辅料是指在药品制剂中经过合理的安全评价的不包括有效成分或前体的组分。例如,在配制注射剂时,可以根据药物的性质加入适宜的辅料,如渗透压调节剂、pH值调节剂、增溶剂、组溶剂、抑菌剂和抗氧剂等,注射剂中所用到的辅料应在标签及说明书中说明。对于在HPLC法中会出峰的辅料,在对药物进行有关物质检测时,应扣除辅料峰的影响。
《中国药典》2015年版(二部)[9]收载了利巴韦林原料及利巴韦林注射液,标准规定利巴韦林原料及其注射液中单个杂质的峰面积应不得大于对照溶液主峰面积的0.25倍(0.25%),各杂质峰面积的和应不得大于对照溶液的主峰面积(1.0%)。研究[16]发现,采用《中国药典》的方法检查利巴韦林注射液的有关物质时,对于加有氯化钠的利巴韦林注射液而言,氯化钠会在利巴韦林的杂质峰处同样出现吸收峰。文献[15]报道,氯离子在200~220 nm范围内有较弱的紫外吸收,而且氯离子在磺酸型阳离子交换柱上存在离子排斥,故氯化钠在色谱柱上基本不保留,对有关物质检查干扰很大,故在有关物质检测时应排除氯化钠峰的影响,或者建议企业在利巴韦林注射液的处方中标注氯化钠的量或不加氯化钠以利于检测。
同时,王琳等[17]在对硝酸甘油片有关物质研究中,建立了液质联用法确证了色谱图中保留时间2.8 min前的色谱峰为聚维酮K29/32的辅料峰,解决了硝酸甘油片质量标准中有关物质辅料峰的判定和扣除问题。在扣除辅料峰后,3批硝酸甘油片样品的有关物质结果均符合规定,为《中国药典》中硝酸甘油片质量标准修订提供了参考。
此外,《中国药典》2010年版二部[13]收载的阿奇霉素分散片的有关物质检验明确规定了计算时予以扣除相对保留时间0.12之前的色谱峰为辅料峰,必要时应取辅料进行对照。王文笙等[18]研究也表明,罗红霉素分散片中的辅料糖精钠的保留时间受仪器、色谱柱、流动相配比影响不大,在一定的流速范围内只根据保留时间就能很好地对其进行定性,在做有关物质检查时可以直接将其扣除。
国家药典委员会药典业化函[2007]8号文对杂质峰的问题作了如下规定:“杂质峰不包括溶剂峰和确认的辅料峰,药品说明书应列出制剂中所用辅料名称”。按照理解,已被确认的辅料峰在有关物质判定时不被认为是杂质峰,可以将其扣除。但将其扣除前必须对其进行研究,以确认其确实为某种辅料峰,而非辅料中的杂质峰,如无法确认是何种辅料则无法扣除。笔者建议,在制剂的有关物质方法开发中,也可以避开辅料存在的吸收波长,同时选取主成分和各杂质的特征波长,使辅料无吸收或有较低吸收,以消除或降低辅料峰的干扰;或者更改提取溶剂,利用药用辅料和主药的溶解性差异,在充分了解辅料和主药理化性质的情况下更换提取溶剂,将辅料峰降至最低干扰,以便可以忽略不计。
5 结语药物中有关物质的研究是药物研发和质量控制的一个重要方面,贯穿于药品研究、生产和储存的整个过程[19]。这就要求分析工作者对检验过程中出现的杂质峰予以重视,以免出现错误的结果。只有这样,才能真正使HPLC法测定有关物质的检验数据准确、可靠。
| [1] |
余振喜, 庾莉菊, 黄海伟, 等. 浅谈HPLC法测定有关物质时已知杂质的计算方法[J]. 中国药品标准, 2010, 11(4): 278-282. DOI:10.3969/j.issn.1009-3656.2010.04.015 |
| [2] |
谢沐风, 罗霞萍, 陈亚美. 如何建立HPLC法测定有关物质的方法[J]. 中国药品标准, 2002, 3(6): 6-8. DOI:10.3969/j.issn.1009-3656.2002.06.002 |
| [3] |
孔英梅, 杨伯群. 新药有关物质检查中的一些问题[J]. 中国新药杂志, 2000, 9(7): 462-464. |
| [4] |
徐润娟, 汤艳群. HPLC法在药品有关物质检查中的应用探讨[J]. 国际医药卫生导报, 2005(7): 96-97. DOI:10.3760/cma.j.issn.1007-1245.2005.07.034 |
| [5] |
徐润娟. 药物的杂质及杂质检查[J]. 中医学刊, 2005, 23(7): 1323-1325. |
| [6] |
凌大奎. 有关物质及其高效液相色谱测定法[J]. 中国药学杂志, 2000, 35(8): 567-569. |
| [7] |
王丽, 申兰慧, 陈国清. 浅谈样品溶剂对高效液相色谱行为的影响[J]. 中国药事, 2013, 27(2): 163-166. |
| [8] |
唐红军. 高效液相色谱法测定药品有关物质时的操作要点[J]. 中国药事, 2011, 25(7): 680-681. |
| [9] |
中华人民共和国药典: 二部[S].2015: 488, 624-625.
|
| [10] |
王丽, 申兰慧. HPLC法测定苯磺酸氨氯地平片的含量及其有关物质[J]. 中国药师, 2014, 17(12): 2046-2050. |
| [11] |
纪宇. 关于马来酸氯苯那敏色谱峰的识别[J]. 中国药品标准, 2004, 5(1): 31-32. DOI:10.3969/j.issn.1009-3656.2004.01.012 |
| [12] |
国家药品标准: 化学药品地方上升国家标准.第五十四册[S]. 2003: 195.
|
| [13] |
中华人民共和国药典: 二部[S].2010: 397, 558.
|
| [14] |
肖欣, 申湘忠. 不同水中氯离子含量的比对分析研究[J]. 湖南人文科技学院学报, 2014, 5: 133-137. |
| [15] |
吕伟, 吴介达. 紫外光度检测离子色谱法测定高浓度氯离子样品中的痕量溴、碘离子[J]. 色谱, 1990, 8(5): 333-335. |
| [16] |
王丽, 申兰慧, 陈国清. 对《中国药典》2010年版利巴韦林注射液有关物质检查方法的探讨[J]. 药学与临床研究, 2014, 22(6): 506-508. |
| [17] |
王琳, 余倩, 张喆, 等. 硝酸甘油片有关物质方法的辅料扣除及质谱定性研究[J]. 药物分析杂志, 2013, 33(11): 1953-1957. |
| [18] |
王文笙, 谢元超, 刘文娟, 等. 罗红霉素分散片中辅料峰的定性研究[J]. 齐鲁药事, 2008, 27(8): 469-471. |
| [19] |
金翔飞, 沈卫阳, 党柱, 等. 药物中有关物质的色谱分析近况[J]. 药学进展, 2009, 33(12): 542-547. DOI:10.3969/j.issn.1001-5094.2009.12.003 |
 2019, Vol. 33
2019, Vol. 33 