2. 北京亦度正康健康科技有限公司, 北京 100055;
3. 沈阳药科大学亦弘商学院, 北京 100027
2. Beijing Yeedozencom Healthcare Science & Technology Co. Ltd., Beijing 100055, China;
3. Yeehong Business School, Shenyang Pharmaceutical University, Beijing 100027, China
Ⅰ期临床试验(Phase I clinical trial)是初步的临床药理学及人体安全性评价试验,用以观察人体对于新药的耐受程度和药物代谢动力学,为制定给药方案提供依据[1]。药物的Ⅰ期临床试验通常是非治疗性的,根据我国药物临床试验指导原则,Ⅰ期临床试验的研究内容为人体耐受性(Tolerance Trial)研究、人体药物代谢动力学(Pharmacokinetics Trial)研究以及药代(PK)/药效(PD)研究,目的是了解药物在人体内的吸收、分布、消除的规律。2016年法国发生的BIA10-2474Ⅰ期临床试验悲剧[2]警醒我们,做好Ⅰ期临床试验的风险评估至关重要,可预防大范围的人员损伤。本文以质量风险管理理论为指导,根据药物Ⅰ期临床试验特点,对Ⅰ期临床试验实施阶段进行风险评估、风险控制研究,以期提高药物Ⅰ期临床试验质量。本文的研究对象确定为Ⅰ期临床实施阶段,主要是为了细化和深入研究,因此,有必要对所谓的实施阶段加以界定。Ⅰ期临床可以分为试验准备阶段、实施阶段、样本处理与统计分析阶段和报告形成阶段。此阶段是指方案确立、伦理通过完成后为起点,直到最后一位受试者完成所有的现场试验操作作为终点的全过程,不包括相关生物样本的分析。
1 质量风险管理及其适用工具质量风险管理是对药品整个生命周期进行质量风险的评估、控制、沟通、审核的系统过程[3]。质量风险管理通常有以下管理工具:判断图分析(FTA)、失效模式影响分析(FMEA)、失效模式、影响和危害性分析(Failure Mode Effect and Criticality Analysis,FMECA)、危害分析和关键控制点(HACCP)、危害的操作性分析(HAZOP)和预先危害性分析(PHA)等。
FMECA技术是从工程实践中总结出来的科学方法,由FMEA和CA(危害性分析)两部分组成,FMECA常被用于产品制造过程控制,但作为一种对系统的失效模式及其潜在影响的评估工具,可以定性和定量地分析系统中存在的各失效模式,即分析各失效模式的严重性、发生的可能性和可检测性,其评估结果用危害性分析的打分数值表示,可用于评价风险的等级,所以FMECA也成为管理过程风险控制的有效手段。
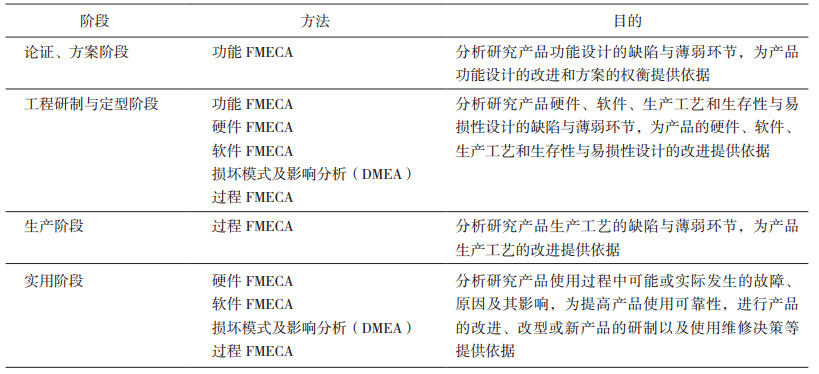
2006年10月1日实施的《故障模式、影响及危害性分析指南》将FMECA分为设计FMECA(包括功能及硬件FMECA、嵌入式软件FMECA以及DMEA)和过程FMECA[4]。在产品生命周期的不同阶段,选用不同的FMECA方法,如表 1所示。
|
|
表 1 在产品生命周期各阶段的FMECA方法 |
由于过程FMECA可用于产品生产过程、维修过程、使用操作过程、管理过程等,且通过查阅相关文献,发现在药物临床试验质量风险管理研究中,有不少文章用到过程FMECA方法,因此,结合I期临床实施阶段的特点,本文采用过程FMECA,用过程FMECA识别所有可能的失效模式、失效原因、潜在的安全性影响、风险的严重性和可能性,提出有效的风险控制建议。具体步骤如图 1所示。
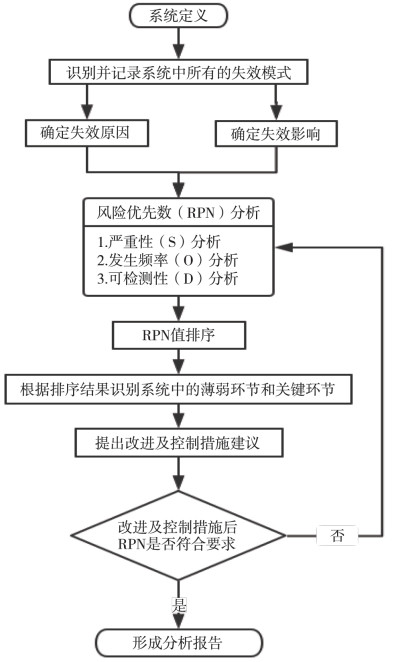
|
图 1 过程FMECA步骤 |
过程FMECA首先要根据研究对象进行系统定义,包括分析的基本条件及各个约定层次的定义;其次,根据研究的目标进行失效模式、失效原因和失效影响分析,即FMEA;在FMEA基础上,用风险优先数法(Risk Priority Number,RPN)进行危害性分析,并对RPN值进行排序;最后,根据RPN值的排序结果,找到系统中的薄弱和关键环节,针对这些环节提出相应的改进和控制措施并持续追踪RPN值是否能够达到要求,如果未符合要求需要再一次进行RPN分析,直到完成FMECA报告。
对药物Ⅰ期临床试验实施阶段而言,失效模式是指对药物Ⅰ期临床试验质量产生影响的风险事件,失效原因是指导致风险事件产生的风险因素,失效影响是指风险事件对药物Ⅰ期临床试验产生的损失。
FMEA中的失效原因、失效模式与失效影响分别对应风险三要素:风险因素,风险事故与损失。
2 风险评估风险评估包括识别危险因素与暴露在这些危险因素相关风险的分析和评估。质量风险评估开始于一个明确的问题或风险问题。当被讨论的风险被明确定义后,则将会很容易确定适当的风险管理工具和需要用于风险问题说明的资料类型[5]。风险评估具体步骤依次为风险识别、风险分析和风险评价。
2.1 风险识别为了确定药物Ⅰ期临床试验实施阶段各环节对药物Ⅰ期临床试验质量的影响,经过文献研究,将药物Ⅰ期临床试验划分成3个阶段:开始阶段、实施阶段以及结束阶段,并对药物Ⅰ期临床试验的实施阶段相关工作进行了梳理。在此基础上,通过专家问卷,结合专家意见,最终确定了3个约定层次,初始约定层次是“药物Ⅰ期临床试验实施阶段”,第二约定层次是“研究场地管理”“试验记录管理”“SOP管理”“质量保证”“受试者管理”“试验用药物管理”“生物样本管理”“安全性报告管理”8个环节,最低约定层次是8个第二约定层次下的34个子环节,见表 2。
|
|
表 2 药物Ⅰ期临床试验实施阶段FMEA层次划分 |
基于药物Ⅰ期临床试验实施阶段流程与相关工作的梳理,结合文献研究与专家意见,对药物Ⅰ期临床试验实施阶段的34个最低约定层次进行FMEA分析,共找出87个失效模式、274个失效原因。
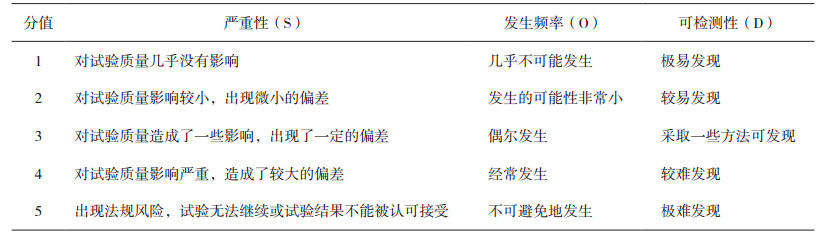
2.2 风险分析运用FMEA完成药物Ⅰ期临床试验实施阶段的风险识别后,对风险点进行危害性分析(CA)。危害性分析的方法很多,主要分为定量分析法和定性分析法[6]。本文采用风险优先数法(Risk Priority Number,RPN)进行定量的危害性分析。RPN是对潜在失效模式风险等级的评价,它反映了失效模式发生的可能性及其后果严重性的综合度量。RPN值由三部分构成:严重性(S)、发生频率(O)和可检测性(D),“严重性”指失效模式对试验质量影响的严重程度;“发生频率”指失效原因导致失效模式发生的概率;“可检测性”指失效原因导致失效模式发生的可检测的难易。三者相乘得RPN值(见公式1),RPN值越大表示风险越高。
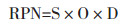
|
(公式1) |
本文采用的是5分制的S/O/D分值,S/O/D的评分准则见表 3。
|
|
表 3 S/O/D的评分准则 |
为了保证问卷的可靠性和准确性,需要确定问卷的样本量[7],样本量由计算得出,见公式2:
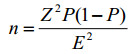
|
(公式2) |
公式中,n为样本量;Z为统计量,代表标准误差的置信水平;E为误差值,表示可接受的抽样误差范围;P是概率值,代表问卷的有效率。
令P=0.5,则P(1-P)为最大值0.25。选择样本的置信区间为90%,通过查表:Z=1.645,E=0.15,将数值带入公式2,得n=31,即本文在置信区间为90%,误差在15%以内,样本量至少为31。
通过问卷星,本轮问卷共回收37份,包含申办方7人,合同研究组织(Contract Research Organization,CRO)22人,临床试验现场管理组织(Site Management Organization,SMO)6人,医疗机构2人,具体占比如表 4。
|
|
表 4 问卷样本量来源占比 |
应用Excel和SPSS 22.0软件对问卷回收的数据进行处理,采用常用的Cronbach's α系数来衡量所得数据的一致性。α取值在0~1之间,当α在0.7~0.8之间表示数据信度可信;当α在0.8~0.9之间表示数据信度好;当α大于0.9表示数据一致性非常好,信度非常可信[8]。通过软件SPSS 22.0,测得严重性(S)、发生频率(O)和可检测性(D)的α值分别为0.993、0.997和0.998,均大于0.9,说明此次问卷回收的数据一致性非常好,信度非常可信。
运用Excel软件对37份问卷,每份588个总计21756个数据进行异常值剔除。由于选项设置相似,剔除74个数据;经过Grubbs检验,剔除了953个数据,总计剔除1027个数据。
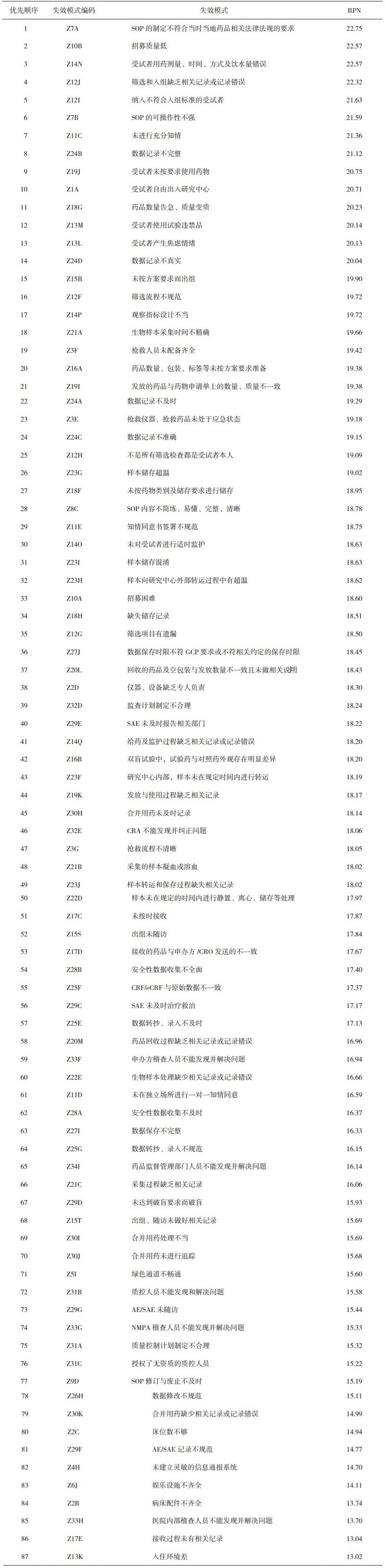
用Excel软件对药物Ⅰ期临床试验实施阶段所有的失效模式进行RPN值计算并排序,得出结果见表 5和图 2。
|
|
表 5 失效模式风险排序 |
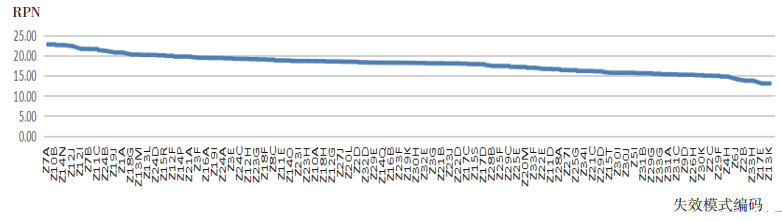
|
图 2 失效模式RPN值分布 |
结合图 2失效模式RPN值的分布情况,失效模式RPN值主要分布在3个区域:20~25分、15~20分及低于15分。本文将风险划分高、中、低3个等级。结合RPN分布情况及专家意见,失效模式RPN>20定义为高风险,不可接受,需要采取措施进行风险控制;15<RPN<20定义为中风险,需要警戒,可采取暂时措施或不采取措施;RPN<15定义为低风险,可接受,不需要采取措施。
由表 5可见,RPN>20的高风险失效模式共有14个。其中排名第2、3、4、5、7、12、13位的属于“受试者管理”;排名第1、6位属于“SOP管理”;排名第8、14位的属于“试验记录管理”;排名第9、11位的属于“试验用药物管理”;排名第10位的属于“研究场地管理”。
2.2.3 高风险点分析从受试者管理、SOP管理、试验记录管理、试验用药物管理和研究场地管理5个方面对药物Ⅰ期临床试验实施阶段的高风险点进行分析。
① 受试者管理过程中高风险点分析
受试者管理共20个失效模式,其中有7个失效模式属于高风险,分别是“筛选和入组缺乏相关记录或记录错误”“招募质量低”“受试者用药剂量、时间、方式及饮水量错误”“纳入不符合入组标准的受试者”“未进行充分知情”及“受试者使用试验违禁品和受试者产生焦虑情绪”,导致这些高风险失效模式产生的最主要的原因是受试者用药依从性差,其次是受试者来源复杂、参差不齐。
值得注意的是,“受试者用药剂量、时间、方式及饮水量错误”这一失效模式的严重性得分为4.42分,位于第一位,这表明受试者的用药剂量、时间、方式及饮水量的错误可能会对最终的药物Ⅰ期临床试验质量产生严重影响,造成较大的偏差。这提醒我们在进行药物Ⅰ期临床试验过程中对给药剂量、时间、方式及饮水量需要重点把握。
② SOP管理过程中高风险点分析
SOP管理共4个失效模式,其中有2个失效模式属于高风险,分别是“SOP的制定不符合当时当地药品相关法律法规的要求和SOP的可操作性不强”,导致这些高风险失效模式产生的最主要的原因是SOP制定人员对于法律法规的更新未及时学习,其次是SOP内容繁琐,语言不清晰、简练。
③ 试验记录管理过程中高风险点分析
试验记录管理共10个失效模式,其中“数据记录不完整”和“数据记录不真实”属于高风险,导致这两个试验记录高风险失效模式产生的最主要的原因是受试者描述不完整、临床监查员(Clinical Research Associate,CRA)监查不到位以及数据记录人员工作疏漏。
④ 试验用药物管理过程中高风险点分析
试验用药物管理共13个失效模式,其中“受试者未按要求使用药物”“药品数量告急”和“质量变质”属于高风险,导致这3个试验记录高风险失效模式产生的最主要的原因是受试者用药依从性差,其次是CRA监查不到位。
⑤ 研究场地管理过程中高风险点分析
研究场地管理共10个失效模式,其中“受试者自由出入研究中心”属于高风险,导致该失效模式产生的最主要的原因是研究中心未配备门禁人员或门禁系统,其次是研究中心人员分工不合理。
3 风险控制结合对高风险的失效模式及其失效原因的分析结果,本文从受试者管理、SOP管理、试验记录管理、试验用药物管理和研究场地管理5个方面对药物Ⅰ期临床试验实施阶段的高风险点提出风险控制建议,以期降低风险。
3.1 受试者管理风险控制建议试验过程中,与受试者接触最多最密切的是研究者,所以本文重点从研究者角度,给出受试者管理的风险控制建议:①对受试者进行依从性教育,叮嘱受试者一旦出现任何不适,及时与研究者联系;②让受试者有足够的时间充分知情、了解试验意义,并就前期试验结果、试验药物本身的药理毒理作用、本次试验内容、用药方案和参与试验的受益与风险等方面对其进行培训[9];③利用官方受试者数据库,避免纳入不合格的受试者,保障受试者质量。
3.2 SOP管理风险控制建议① 药物Ⅰ期临床试验SOP应由最熟悉该工作的相关人员起草后,研究室负责人或其授权的人员应对SOP草稿进行审阅和讨论,保证文件简练易懂、具有逻辑性和可行性。
② S O P的管理是一个动态的不断完善的过程[10]。当最新的法律法规、指导原则与现行的SOP不符时、研究室有技术更新、引进新设备、研究操作的过程有重大变更时、在SOP的执行过程中发现新的问题时以及在现场稽查或核查过程中专家提出修订建议时,都需要对SOP进行及时重新修订。
3.3 试验数据记录管理风险控制建议试验数据的记录涉及参与试验的所有人员,结合重点失效原因,从受试者、协调研究员(CRC)、申办方及质控人员几个方面给出试验数据记录管理风险控制建议。
① 受试者:质量高且依从性好的受试者,能完整、清楚地描述不良反应和回答相关问题,有助于研究者准确、完整地记录数据。
② 协调研究员(CRC):建议药物Ⅰ期临床试验研究中心引进国际通行的现场管理组织(SMO)模式,CRC能分担研究者文件记录负担,承担协调和管理临床试验任务[11]。
③ 申办方:借鉴英国先进经验,申办方确保所有的研究中心都应有自己的质量控制和质量保证系统,如ISO 9001,参与试验的工作人员必须遵守。研究中心试验记录和试验的每个步骤都应有所遵守的有书面授权的程序[12]。
④ 质控人员:要加强项目组、专业组和机构办公室三级质量控制,对临床试验数据记录进行全程监管,做到及时发现、解决问题[13]。
3.4 试验用药物管理风险控制建议建议药物Ⅰ期临床试验研究中心在条件允许情况下,安装无线或有线的温湿度监控系统,保证24小时实时监控,并将不同保存条件的药物分区管理,定期检定或校准监控标签,保证试验用药物在试验期间稳定和试验结束后留样阶段的温湿度条件可控、可溯源[14]。
3.5 研究场地管理风险控制建议在对研究场地进行管理中,受试者自由出入研究中心存在较高风险。建议药物Ⅰ期临床试验研究中心建立全面门禁系统、设立厕所、病房等管控人员,保障受试者自进入研究中心到离开研究中心,所进行的各项活动都有相应人员的监护。
| [1] |
国家食品药品监督管理总局.药品注册管理办法[EB/OL].(2007-07-10)[2019-03-10]. http://samr.cfda.gov.cn/WS01/CL0053/24529.html.
|
| [2] |
陈霞. BIA 10-2474药物临床研究中5例健康受试者神经系统损害及死亡事件的启示[J]. 协和医学杂志, 2018, 9(3): 256-260. DOI:10.3969/j.issn.1674-9081.2018.03.013 |
| [3] |
杨晓宇. 药品生产过程质量风险产生的原因及控制[J]. 黑龙江科技信息, 2016(6): 15. DOI:10.3969/j.issn.1673-1328.2016.06.014 |
| [4] |
中国人民解放军总装备部.国家军用标准GJB/Z1391-2006故障模式、影响及危害性分析指南[S]. 2006.
|
| [5] |
刘新立. 风险管理[M]. 第2版. , 北京大学出版社, 2015.
|
| [6] |
龚兴华, 张逸迁, 张少东, 等. 基于FTA与CA的地铁车辆塞拉门系统可靠性研究[J]. 铁道机车车辆, 2015, 35(4): 79-83. DOI:10.3969/j.issn.1008-7842.2015.04.18 |
| [7] |
武松. SPSS统计分析大全[M]. 北京: 清华大学出版社, 2014.
|
| [8] |
于振凡. 数据的统计处理和解释[M]. 北京: 中国标准出版社, 2008.
|
| [9] |
罗永红. 药物临床试验在我院临床医疗和科研中的意义[J]. 大家健康(下旬版), 2016(9): 147. DOI:10.3969/j.issn.1009-6019.2016.09.197 |
| [10] |
盛晓燕, 许俊羽, 梁雁, 等. Ⅰ期药物临床试验标准操作规程的制定和管理[J]. 中国临床药理学杂志, 2017, 33(14): 1357-1359. |
| [11] |
汶柯.药物临床试验记录文件中常见问题及规范做法探讨[C]//中国药学会, 江苏省人民政府.中国药学大会暨第十二届中国药师周论文集, 2012: 6. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-YYWS201211001563.htm
|
| [12] |
Association of the British Pharmaceutical Industry. Guidelines for Phase 1 Clinical Trials 2018[EB/OL].[2019-03-10]. http://www.abpi.org.uk, 2018.
|
| [13] |
汶柯, 白楠, 梁蓓蓓, 等. 药物临床试验记录文件中常见问题及规范实施办法探讨[J]. 中国药物应用与监测, 2013, 10(1): 51-54. DOI:10.3969/j.issn.1672-8157.2013.01.015 |
| [14] |
陶蕾, 马鹏程. Ⅰ期临床试验用药品的管理[J]. 江苏科技信息, 2017(15): 27-29. DOI:10.3969/j.issn.1004-7530.2017.15.011 |
 2019, Vol. 33
2019, Vol. 33