近年来,随着人们对胶原结构和功能等研究的不断深入,基于胶原的产品在世界范围内的需求快速增长。胶原在医疗领域的应用日益广泛,包括敷料、植入材料以及组织工程医疗产品等。胶原是结缔组织的主要蛋白,也是与机体的细胞、组织和器官功能紧密相关的功能性蛋白,具有良好的生物相容性和生物可降解性、一定的机械强度和低免疫原性,并具有止血以及促进细胞生长等性能。因此,胶原在再生医学领域的应用备受关注,各类大中小企业纷纷介入相关产品的研发,显示了巨大的市场潜力。然而,相对于迅速发展的市场,胶原质量评价指标的要求、方法等标准和规范的建立相对滞后,制约了相应产业的规范、健康发展。美国材料和试验协会(American Society of Testing Materials,ASTM)发布了关于胶原产品及其相关的胶原-细胞相互作用表征和标准化指南[1],为胶原类产品的质量评价提供了参考。
胶原类产品在医疗领域的应用主要包括:作为初始材料用于制备外科植入物、组织工程医疗产品(Tissue Engineered Medical Products,TEMPs)的支架、敷料、治疗用细胞支架或药物的载体,以及用于基础研究、药物开发和毒性测试的体外三维(3D)组织系统或模型的构建。
胶原相关产品形式多样,其实际应用应基于材料的生物相容性和预期特定应用的功能性指标(包括物理、化学和生物学检测与评价的数据)进行设计开发。因此,规范胶原类产品质量和安全性相关的性能指标和建立相应的检测评价方法,对于产品研发、生产、质量控制、检测评价以及技术审评都具有重要意义。
2 适用范围本文为基于特定的医疗用途,例如(但不限于)创伤或止血敷料、外科植入物及组织工程医疗产品等,在筛选、表征和规范合适的胶原时提供参考。
本文所列参数主要适用于Ⅰ型胶原纯化产物及自组装I型胶原产品(统称Ⅰ型胶原类产品)。重组的胶原或者其它类型的胶原也可参考,但并不一定适用于全部胶原产品。对于某一特定的I型胶原类产品也不一定需要检测所有指标。
3 术语和定义 3.1 胶原(Collagen)一类含有至少20种在遗传学上不同类型的分泌蛋白质家族,主要担任机体的结构支撑功能,具有独特的由三条多肽链(被称为α链)组成的三螺旋构型,并具有一定的生物学功能。
3.2 胶原聚合物(Collagen Polymer)纯化的胶原产物,在不引入外源物质(如交联剂)的条件下具有自组装或聚合成为更高级结构的能力。
3.3 胶原仿生多肽(Collagen Mimetic Peptide)是胶原的三螺旋结构部分的特定氨基酸序列,是天然胶原的三螺旋构型的基本序列,通常是“脯氨酸-羟脯氨酸-甘氨酸”—[-(Pro-HypGly)-]。
3.4 前胶原(Procollagen)由三条羧基化多肽链(α链)组成的胶原分子,其多肽链的氨基(NH2-)-和羧基(COOH-)-端前肽均保持完整(见图 1)。
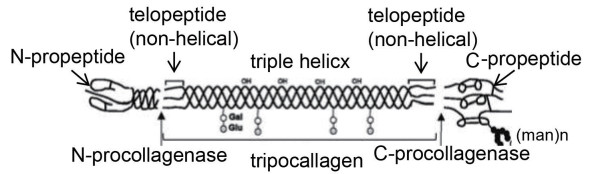
|
图 1 前胶原分子和相关的前肽、端肽和三螺旋区域示意图 |
用前胶原酶通过酶切去除前胶原分子的氨基-和羧基-端前肽即获得原胶原(见“3.7”节)。
3.5 前肽(Propeptide)单个前胶原多肽链(α链)中氨基-和羧基-端的非三螺旋区域,决定三螺旋折叠和前胶原分子的形成(见图 1);胶原成纤维过程和自组装过程以前肽的去除为基础。
3.6 前胶原多肽链(Protocallagen)由核糖体合成的单个胶原α多肽链。
3.7 原胶原(Tropocollagen)由去除了氨基-和羧基-端前肽的三条α链组成的胶原分子(见图 1);羧基-和氨基-端的端肽仍保持完整。原胶原能进行自组装形成纤维化网络。
3.8 端肽(Telopeptide)原胶原α链上氨基-和羧基-端的非三螺旋区域。端肽对于成纤维过程和分子间交联键的形成至关重要(见图 1)。
3.9 去端肽胶原(Atelocollagen)端肽区域被部分或全部从原胶原分子中去除的三螺旋分子。这是基于酶提取法(如胃蛋白酶等)从组织中纯化胶原过程的产物。
3.10 单体(Monomer)单个的原胶原分子(见图 1)。
3.11 寡聚体(Oligomer)两个或多个原胶原分子通过分子间天然交联形成的共价聚合物。
3.12 重组胶原蛋白/多肽(Recombinant Collagen Protein/Peptide)利用重组技术获得的胶原或类似胶原的多肽,如通过在微生物、昆虫、植物或动物宿主中表达核苷酸序列编码的蛋白或多肽,通常含有GlyX-Y的三联体,其中Gly表示甘氨酸,X和Y可以相同也可以不同,并且通常是脯氨酸或羟脯氨酸,但也可以是任何其它已知的氨基酸。
3.13 自组装(Self-assembly)一个复杂大分子(如胶原)或超分子系统(如病毒)由其组成单元自发组装的过程。
3.14 成纤维过程(Fibrillogenesis)原胶原单聚体组装形成成熟的纤维,并形成纤维网络结构的过程。
3.15 凝胶(Gel)胶原分子间通过大分子链相互作用形成的三维网络结构。在本质上这种相互作用可能是大分子链间的共价键、离子键、氢键或疏水键作用。
3.16 力传导(Mechanotransduction)细胞将机械刺激转化成一种化学响应的过程。
3.17 渗透性(Permeability)多孔材料传送液体的能力,液体通过多孔材料的速率。
3.18 黏附(Adhesion)稳定或牢固的附着;对于胶原而言,黏附是指细胞通过细胞膜表面蛋白质(如整合素等)以物理贴附或结合的方式连接到胶原及其自组装结构物上的能力。
3.19 胶原降解(Collagen Degradation)胶原在化学、物理及生物因素的作用下,发生水解或氧化还原反应,最终导致胶原化学键断裂的过程(源于YY 0954-2015),包括生理条件下蛋白水解酶(又称胶原酶)在中央三螺旋区域内的定点切割过程。
3.20 基质(Matrix)细胞外的松散网状结构或连接组织的排列物。基质中的胶原具有不可溶的纤维网络,或被间质液环绕的无定型的纳米结构。
3.21 溶解性(Solubility)胶原的溶解性是指在某一溶液中(部分、全部或多数)的溶解程度,可分为酸可溶和盐可溶,即在稀酸或中性盐溶液中的溶解性。
3.22 自组装胶原基产品(Self-assembled Collagen Products)由提纯的胶原自主装后形成的,如可注射的胶原溶液,原位聚合形成的单层薄片、颗粒、微球、纤维、海绵、凝胶、涂层、薄膜或其它形态。
4 胶原类产品的性能和评价胶原类产品的性能及评价方法的选择宜依据胶原的型别(如Ⅰ型、Ⅱ型)和来源(如组织提取的胶原,或者合成的胶原多肽)[2]。应确保所选择方法的合理性,或采用可接受的蛋白质、聚合物、生物及生物材料的通用分析方法。同时,测试方法应有动态范围、检测限和灵敏度。
4.1 胶原的特性及评价方法胶原类产品的性能包括物理、化学和生物学性能。以下列出了I型胶原类产品的各种性能及其相应的表征方法(包括但不限于这些方法),其专属性和灵敏度不尽相同,在具体使用过程中应充分了解这些方法的适用性和局限性;这些方法可能不完全适用于所有产品,也可以使用其它经过验证的方法。
4.1.1 胶原浓度胶原浓度(含量)以“质量/体积”或“质量/质量”表示。可选择检测羟脯氨酸的氨基酸分析方法或凯氏定氮法(可参照YY/T 1453[3]或GB/T 9695.2 [4]),或天狼星红胶原染色比色法(仅适用于非交联的胶原),也可以采用液相色谱质谱联用法,通过特征肽标准品做定量曲线,通过胶原酶解产物中特征肽含量的定量检测,实现胶原的定量[5]。
4.1.2 黏度(动力黏度)胶原类产品的黏度取决于多种因素,包括但不限于溶剂种类、分散/悬浮状态、浓度、分子组成、分子大小、温度、操作条件等。黏度的测量通常用黏度计或流变仪,可参照《中华人民共和国药典》2015年版四部[6]黏度测定法(0633)进行测定,需要详细描述实验条件。
4.1.3 胶原类型和鉴别用于分离Ⅰ型胶原的组织通常会含有其它类型的胶原。结缔组织和器官中Ⅰ型胶原最丰富,如皮肤、骨、肌腱、角膜和细胞间质。Ⅱ型胶原主要分布在软骨。Ⅳ型胶原是基底膜的主要成分。胶原类型的构成是决定胶原聚合程度和性能的重要因素。已有研究证明Ⅲ型和Ⅴ型胶原会影响Ⅰ型胶原的自组装动力学及产物。因此,根据不同动物组织以及纯化方法所获得的Ⅰ型胶原纯度会有所不同。在I型胶原产品的生产工艺中,其它类型胶原的水平宜进行充分评价和控制。
(1)用不同类型的胶原对照品和待测样品一起进行蛋白质电泳(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法,SDS-PAGE),参考YY 0954[7],可粗略分析胶原类型。
(2)采用特异性抗体,通过蛋白质免疫印迹(Western Blot)或酶联免疫吸附测定(ELISA)法可进行胶原类型分析[8],但是宜采用标准化的方法,采用非标准化方法时应进行抗体特异性分析及方法学验证。可参考《中华人民共和国药典》2015年版四部免疫印迹法(3401)。
(3)采用液相色谱质谱联用技术,通过Ⅰ、Ⅱ、Ⅲ、Ⅵ等类型胶原的特征肽测定进行鉴别[9]。
对产品中存在的其它类型胶原宜进行风险分析。如果其它类型胶原疑似存在,宜对潜在的宿主反应进行评价。是否有必要进一步分析取决于其它类型胶原作为不纯物在特定胶原产品中的风险程度。
4.1.4 重组或转基因细胞的DNA序列可验证重组产品中重组或转基因细胞的胶原DNA序列,如COL1A1、COL1A2,或者胶原相关的蛋白或者肽。
4.1.5 氨基酸组成氨基酸分析可以提供胶原的氨基酸组成信息。对于组织提取的高纯度胶原,在酸性条件下可溶,其氨基酸组成应与公开数据(如NCBI/Uniprot数据库或文献)中氨基酸组成相对应。可参考YY/ T 1453-2016的附录B第二法,也可使用反相高效液相色谱法(HPLC)进行氨基酸的组成分析。由于色氨酸的残留在非三螺旋端肽末端,可以作为端肽完整性的指示物。
4.1.6 肽图肽图被用于鉴别寡聚体和胶原类型组成,常用溴化氰消化液测定。降解产物可用SDS-PAGE、HPLC、质谱(MS)及基质辅助激光解吸电离(MALDI)等方法进行分析[10-12]。
4.1.7 分子间交联组成从组织中分离纯化的胶原,基于所采用的具体提取工艺,可能存在去端肽胶原、胶原单体、寡聚体、多聚体及其复合物。因此,依据特殊的工艺过程,宜最大程度地减少寡聚体和多聚体,或者利用酶解和二次纯化的方法进行去除,或使用年轻的动物,或使用特殊的方法(如山黧豆中毒)抑制胶原分子间交联的产物。
由于胶原分子的完整性和组成,包括分子间交联,在其自组装动力学和程度方面起到了重要作用,因此,组织提取胶原的分子表征宜包括分子间交联的分析。可用于分子间交联的定量分析方法包括:
(1)高效液相色谱法(HPLC):阳离子交换高效液相色谱法可快速、敏感地定量未成熟的(可还原的、二价的)和成熟的(非还原性的、三价的)交联组成,已被用于分析胶原或生物组织的水解产物。可参考《中华人民共和国药典》2015年版四部高效液相色谱法(0512)。
(2)液相色谱串联质谱法(LC/MS):基于串联质谱的多反应离子监测,如LC/MS也可用于分子间交联分析。可参考《中华人民共和国药典》 2015年版四部质谱法(0431)。
(3)比色法:吡咯交联物常通过比色方法进行定量检测。可参考《中华人民共和国药典》2015年版四部紫外-可见光光度法(0401)。
不同的分子间交联含量常表示为mol/mol胶原。
4.1.8 分子量胶原分子量依据其来源及产品分子量不同变化很大,胶原合成肽约1000 g/mol,组织提取的胶原单体或寡聚体超过300000 g/mol。小分子(小于100000 g/mol)的胶原肽或蛋白质可用MS和动态光散射(DLS)法检测;大分子(100000 g/mol或以上)的胶原用SDS-PAGE或分子排阻色谱法检测,可参照《中华人民共和国药典》2015年版四部电泳法(0541)或分子排阻色谱法(0514)。
4.1.9 CD光谱圆二色(CD)光谱法用于测量对左旋和右旋圆偏振光的差异吸收,已被用于胶原的结构表征,尤其是胶原的三螺旋的结构及其变化[13]。
4.1.10 热稳定性差示扫描量热分析(DSC)可用于胶原类产品的解聚温度分析。胶原的热变性温度可提供结构转变信息,进而提供了样品一级序列、结构状态和样品纯度相关信息[14]。可参考《中华人民共和国药典》2015年版四部热分析法(0661)。
4.1.11 胰蛋白酶敏感性胰蛋白酶敏感性可以检测在纯化步骤(如酸碱处理、溶剂处理等)中发生变性的胶原部分。胰蛋白酶可消化胶原中的变性部分,通过测定消化液中羟脯氨酸含量分析变性的胶原。三螺旋胶原能抵御大多数蛋白酶的消化。对胰蛋白酶或其它适宜的蛋白酶的敏感性可以通过胶原在酶中的暴露和对降解后消化液进行分析[9, 15]。
4.1.12 杂质Ⅰ型胶原溶液中存在的杂质主要指外源性物质和材料。引起关注的杂质主要包括(但不限于):内毒素、糖胺聚糖、弹性蛋白、脂类、供体DNA、供体细胞成分、细胞培养组分、重金属、生物负载、病毒、传染性海绵状脑病(TSE)载体、酶及制备/处理/提取或溶解过程中使用的试剂(如酸、表面活性剂、溶剂等)。这些杂质可以采用Western Blot、ELISA、气相色谱-质谱(GC/MS)0431等方法进行检测。其中DNA残留检测可参照YY/T 0606.25[16]。
杂蛋白是指在胶原纯化过程中残留的除I型胶原外的其它蛋白质。主要包括(但不限于):弹性蛋白、宿主细胞污染物、细胞培养污染物、酶制剂等。与Ⅰ型胶原伴随的Ⅲ型胶原不作为杂蛋白考虑(见YY/T 1453)。
建议根据产品的预期用途和使用性能要求,考虑对纯化的胶原中未正确排列胶原分子,即部分解聚的胶原分子(如胶原三螺旋结构发生部分解聚)是否有必要作为杂质或杂蛋白进行控制。可通过CD光谱或凝胶过滤色谱检测胶原三螺旋结构的变化情况。
关于胶原中存在的加工助剂和其它杂质问题,生产者或供应商应提供工艺中可能引入的杂质信息,并进行风险分析和必要的质控。
(1)弹性蛋白
弹性蛋白是组织提取胶原中的一种杂质成分,可以通过测定锁链素进行检测,可使用MS、Western Blot和ELISA或其它方法进行分析[17]。
(2)碳水化合物
可以用气相色谱法和液相色谱法或者光度测量法进行碳水化合物分析[18-19],可参照《中华人民共和国药典》2015年版四部紫外-可见光光度法(0401)、气相色谱法(0521)、液相色谱法(0512)。基因重组或非常见动物组织提取的胶原,其糖基化模式或糖链模式可能与人类胶原存在差异。如果使用了特殊来源的胶原,且其糖基化特征不清楚,存在引起自身免疫疾病的风险,这种情况下需要对胶原的糖基进行分析,在此基础上,开展风险评估。必要时进行胶原糖基化特性的系统分析,并分析其导致自身免疫疾病发生的潜在风险。
(3)内毒素
内毒素检测方法有凝胶法和光度测定法,可参照《中华人民共和国药典》2015年版四部细菌内毒素检查法(1143)。
(4)重金属
依据材料来源和工艺,对可能存在的重金属进行总含量检测和必要的单项重金属含量检测,如铅、汞、铋、砷、锑、锡、镉、银、铜和钼。检测方法包括(但不限于):光谱法、比色法、质谱法以及原子吸收法,具体可参照《中华人民共和国药典》2015年版四部原子吸收分光光度法(0406)、电感耦合等离子体原子发射光谱法(0411)、电感耦合等离子体质谱法(0412)、重金属检查法(0821)。对毒性风险高的重金属应给出残留量的限量要求,如铅、汞、镉、砷、锑等。
(5)微生物安全性评价
细菌、病毒和真菌均是生物样本中可能存在的污染物。应对灭菌过程进行验证并表征其对产品的影响。如微生物限度、无菌检查和细菌内毒素检查等,可参照《中华人民共和国药典》2015年版四部无菌检查法(1101)、非无菌产品微生物限度检查:微生物计数法(1105)、非无菌产品微生物限度检查:控制菌检查法(1106)、细菌内毒素检查法(1143),并按照GB 18280.1 [20]、GB 18279.1 [21]的要求进行灭菌和无菌保证水平的工艺验证。
按照YY/T 0771.1 [22]标准和《动物源医疗器械注册技术审查指导原则》(2017年版)[23]进行风险管理和开展病毒灭活验证研究。
4.1.13 胶原的纯度纯化的胶原产物宜是不低于胶原蛋白总量的98%,杂质水平低于其质量2%的高度纯化的物质(干重)。医用胶原类产品应根据预期的临床应用目的规定其纯度要求。Ⅰ型胶原作为植入剂时应符合YY 0954的要求(其杂蛋白总量应在总蛋白的1%以下,当任意一种杂蛋白含量超过1%时,应进行定性定量分析)。
胶原的纯度可以用SDS-PAGE凝胶电泳法对聚合物直接分析,或分析特殊的酶(细菌胶原酶、胰酶)裂解后产物,或分析化学(溴化氰)分解后产物。通过采用液相色谱质谱联用技术,利用特定类型胶原的特征肽标准品进行特征肽定量检测,从而实现较精确的含量测定,可用于纯度的判定。
(1)SDS-PAGE可参考《中华人民共和国药典》2015年版四部电泳法(0541),YY/T 1453- 2016及其附录A。
(2)肽图可参考《中华人民共和国药典》2015年版四部肽图检查法(3405)第一法进行测定。
(3)氨基酸N-末端测序可采用Edman降解法[24],用氨基酸序列分析仪测定,序列应与相应动物来源胶原的N末端氨基酸序列一致。可参考《中华人民共和国药典》2015年版三部重组人促红素注射液(CHO细胞)中“氨基酸N-端测序”的描述。
(4)特殊的非胶原杂质的检测,如:氨基己糖(即糖蛋白的测定)、脂肪、总糖、锁链素(可间接表征弹性蛋白含量)和氨基酸组成分析(胶原组成全貌,包括非胶原氨基酸)。其中,总糖含量的测定可参考YY/T 1453-2016的附录E。脂肪含量的测定可参考YY/T 1453-2016的4.11条款。
4.1.14 聚合反应/自组装能力胶原自组装或聚合成超分子结构的能力的差异常取决于胶原制备过程。胶原的聚合能引起不同的组装产物和组装动力学,有可能影响其在特定应用中的适宜性。
自组装动力学参数通常使用光度计或黏度计分别监测浊度或黏度(如剪切储存模量)随时间的变化来确定。这些分析常常产生S形的聚合曲线,通过曲线可定量一些聚合动力学参数,包含阻滞期时间、线性增长期的增长率以及聚合的半周期。但是,从分光光度计(浊度)数据中并不能得到聚合微结构的相关信息。基于图像的一些方法,如延时共聚焦反射显微镜可用来观察结构。可以通过浊度和黏弹性的动力学监测,结合实时的共聚焦反射显微镜观察结构的变化,来评价胶原的聚合反应/自组装能力[25]。
4.1.15 胶原聚合能力为保证胶原类产品在制备过程中的高度一致性和减少在性能上的批间差异,宜建立评价胶原聚合能力的标准化方法或质量控制方法。如通过定量自组装胶原产品的黏弹性(剪切储存模量、基质硬度)和发生聚合反应的胶原浓度之间的函数关系评价聚合能力。这些标准化策略能改善自组装胶原产品在体外与细胞及体内与宿主之间反应的预测性和可重复性[26-27]。
4.1.16 纳米和微米结构许多成像技术和分析工具已被用来观察和定量自组装胶原产品在多种尺度下的结构信息。电镜可获得有纳米级分辨率的图像。透射电镜(TEM)和扫描电镜(SEM)均能提供高分辨率代表样品表面形貌的二维图像。连续横截面TEM和连续块体表面SEM可用来进行三维分析。冷冻扫描电镜(Cryo-SEM)的样品预处理能更好地保存胶原材料真实的结构细节且带来的人工假象较少。
电子显微图片通常用来确定纤维类材料的微结构参数,如孔隙率、纤维面积比例、纤维直径和纤维的周期性D带。周期性D带是沿纤维长轴以67 nm为间隔的横纹,是胶原分子交错排列的特征。电子显微镜也被用来确定不同纳米结构的尺寸和形状,包括由胶原仿生多肽形成的微丝、球形聚合体以及纳米纤维。
共聚焦和多光子显微镜的成像技术,不经过额外的样品处理和染色,则可以获得胶原自组装材料的三维微结构细节。由于胶原纤维和周围环境的反射指数不同,反射模式的激光共聚焦显微镜能采集从完全含水的胶原微结构样品中反射出的或被散射的光线,从而减少样品处理带来的假象。
在胶原聚合过程中进行延时的激光共聚焦成像也能提供自组装动力学和分子机制方面有用的信息。
另外,胶原固有的非中心对称(不是关于某一中心点的对称)三螺旋结构能产生非线性的、光的二级极化。二级谐波的生成(SHG)产生散射光,沿着螺旋轴极化,使得入射的多光子冲击波长减半。由于胶原自带荧光,它的自发荧光也能通过共聚焦和多光子显微镜观察到。但是自发荧光的强度通常相对较低,会影响成像的质量和分辨率。
对于固定的样品,胶原特异性的抗体和探针已被证实能改善信噪比和胶原微结构图像的质量。三维微结构信息的获得能支撑更复杂的、定量的微结构的描述,如纤维密度(纤维体积比)、纤维直径、纤维分支相交的程度以及总的和平均的纤维长度。
原子力显微镜(AFM)成像通常用来观察干燥的或含水的胶原材料表面的纳米结构。因为该测量要求AFM探针尖和表面相互接触,通常它的应用仅限于在二维平面上。从这些图像中常能测量到纤维的粗糙度和直径(高度)。AFM也被用来观察和定量纤维周期性D带的差异。
可根据具体样品情况,选择SEM、TEM、Cryo-SEM、AFM及激光共聚焦显微镜中的一项或数项技术进行自组装胶原基产品的纳米和微米结构分析。
4.1.17 黏弹性和机械性能胶原的黏弹性和机械性能是决定基本细胞行为和细胞诱导材料重建特性的关键因素。胶原的机械性能可通过包括剪切、振荡剪切、压缩和拉伸(单轴或多轴)在内的测试方法进行表征。
蠕变、应力-松弛和动态力学测试常被用来测量时间相关的机械性能或黏弹性。胶原的机械性能不仅取决于材料的尺寸和形状,也取决于力的加载方式(应变率、动态加载的频率)以及加载过程中材料所处的条件(温度、介质)。因此,测量时应明确这些力学测试的参数和条件。
材料性质的测量通常包括模量、失效应力、失效应变以及泊松比。其它常见的力学测试,如缝线的拔出试验、球破试验和微米或纳米压痕试验,可根据产品的结构特性和预期使用性能进行确定。
由于测试装置通常只提供单一尺度的力学信息,有些新建立的试验体系和方法可用于胶原产品多尺度力学行为的评价。
4.1.18 物质转运特性胶原材料或工程化的组织构建物中液体和溶质的转运对于引导细胞基础行为、组织形态和修复、组织结构及其功能的维持以及组织病理学(如癌症)方面发挥着关键作用。材料通过以下方式实现对细胞微环境的调控:(1)营养物质传递和代谢废物的移除;(2)可溶因子的时空分布;(3)物理因素(如剪切力)等。
材料的渗透性和扩散性是设计基于生物材料的治疗用细胞、药物或分子递送系统的关键因素。渗透性决定了施压条件下流体通过多孔材料的难易程度。测定扩散率的实验方法涉及有限空间内胶原材料上的压力梯度和平均流速,达西定律可用来计算渗透率。扩散性能取决于浓度梯度驱动的溶液的随机运动。
消光后的荧光恢复(FRAP)方法是将一稀释的荧光标记物均匀分布于材料内,通过激光诱导光褪色产生出一定的浓度梯度,再通过分析标记物浓度随时间恢复的特征来获得扩散系数。集成光学成像(IOI)是通过微注射创建一种荧光标记物的点发射源,随后通过图像技术测量它们在时间和空间分布的扩散系数。
4.1.19 胶原酶降解自组装胶原产品的降解通常通过细菌胶原酶处理后测量羟脯氨酸随时间的变化,也可通过胶原酶处理后胶原材料在宏观形貌或特定机械性能(如应力松弛率、剪切储存和耗损模量等)的变化进行分析。
4.1.20 胶原-细胞相互作用细胞在体内对基于胶原的细胞外微环境的响应是通过生物化学和生物物理两个方面进行调控的。胶原固有的细胞信号传导能力在很大程度上受以下三个方面驱动:(1)支持整合素介导的细胞黏附;(2)通过结构和材料特性施加物理和机械的作用;(3)参与细胞诱导的动态重建过程(如生物降解、结合生长因子和微结构的变形)。
由于胶原类产品在分子组成、微结构、物理性能方面可能差异显著,应检测材料与细胞之间相互作用及其引导细胞基础响应的性能。
(1)主要测试方法,包括:在胶原聚合之前,通过把细胞混悬在胶原溶液中,细胞很容易进入自组装胶原网内,或者将细胞接种到自组装后的胶原材料表面。
(2)细胞响应的参数,包括:细胞形态、面积和体积,均可通过二维(2D)或三维(3D)图像技术可视化评价。细胞骨架成分(如肌动蛋白)的协同作用被用来评价细胞与基质间的黏附与收缩解离。
(3)抗体阻断试验,可用来确定细胞表面的何种受体参与了与胶原的作用,如整合素或盘状结构域受体(DDRs)。
(4)在单个细胞或多细胞水平上评价细胞引导的收缩解离的方法有多种,如:自由漂浮组织构建物的尺寸随时间的变化、施加在培养-力学监测系统上力的大小以及单个细胞在胶原网络的应力和形变。
(5)其它常规检测的细胞响应参数,包括:存活率、增殖率、程序化凋亡以及迁移。
(6)其它适用于干细胞和祖细胞类型的细胞-胶原相互作用的功能性检测,包括细胞株的定向分化、特定干细胞或祖细胞的增殖,或组织形态发生(始于内皮祖细胞的血管形成)。
上述关于胶原-细胞相互作用(生物学活性)的功能性测定也可作为产品标准化和质量控制的方法。三维支架材料中细胞活性评价方法可参考YY/T 1562 [28]。
4.2 胶原类产品的性能评价指标确定所使用的胶原类材料,包括用于外科植入物、TEMPs等的要求时,需要考虑以下方面:胶原的来源、杂质成分,以及综合物理、化学和生物学的表征和测试。同时,需要参照监管机构关于医疗器械、生物制品、药物和相关组合产品的法规、标准和批准上市的文件及其它相关指南。
胶原类产品作为医疗器械的原材料应具有严格的质量标准,全面涵盖物理、化学和生物学性能。以下列举了表征特定胶原类产品时适用的指标。并非所有指标都要求表征,宜根据胶原材料的来源、制备工艺和终产品的形态、特性,合理选择适用的指标和方法,以达到对产品进行严格质量控制的目的。
4.2.1 Ⅰ型胶原纯化产物的评价项目纯化的胶原产物可考虑如下评价项目:
(1)物理性能外观、性状。
(2)化学性能
1)浓度;
2)黏度;
3)纯度分析,包括:非I型胶原的类型、弹性蛋白、黏多糖、非胶原类蛋白质、脂类及碳水化合物、核酸、氨基酸及其序列分析等;
4)分子间交联分析;
5)分子量、平均聚合物分子量;
6)端肽完整性、螺旋结构含量;
7)热解离;
8)胰蛋白酶敏感性分析;
9)杂质组成,包括重金属分析、内毒素、生物负载;
10)聚合反应动力学;
11)聚合能力;
12)pH值;
13)添加物(药物、分子物质及灭菌剂残留)。
(3)胶原-细胞相互作用
播种细胞的Ⅰ型胶原产品应进行胶原-细胞相互作用评价,包括生物相容性和基本的细胞响应,如:
1)引起不同细胞响应的材料形貌变化;
2)细胞-支架收缩解离特性;
3)细胞增殖;
4)细胞凋亡;
5)细胞分化;
6)细胞形态发生(细胞的形态变化和运动、细胞的识别和黏着等过程);
7)细胞的迁移。
4.2.2 自组装Ⅰ型胶原产品评价项目自组装Ⅰ型胶原产品可考虑如下评价项目:
(1)物理性能
1)形貌、纳米/微米结构;
2)液体传输性能(渗透性、扩散性);
3)机械性能/黏弹性;
4)收缩/解聚温度。
(2)化学性能
1)pH值;
2)添加物(药物、分子物质及灭菌剂残留);
3)胶原酶降解。
(3)胶原-细胞相互作用
播种细胞的I型胶原产品的胶原-细胞相互作用评价项目同以上“4.2.1”节中“(3)”。
5 产品的质量控制和风险管理胶原类产品的质量管理主要包括以下几个方面:
(1)存储条件/货架期稳定性;
(2)灭菌方法及灭菌过程对产品的影响(若适用);
(3)来源控制;
(4)病毒和传染性海绵状脑病病毒因子的灭活;
(5)胶原类产品的安全性和毒理学评价。
5.1 存储条件/货架期稳定性理想的储存条件和货架期稳定性取决于胶原的物理形态(如溶液或冻干品)。具体产品的货架期稳定性和储存条件受产品状态、制造工艺、包装形式等因素影响,应根据产品特性进行确定和验证。
组织提取的冻干胶原类产品宜在带干燥剂的环境下储存。组织提取的胶原的酸溶液宜在低温条件下储存。宜避免将组织提取的任一形式的胶原反复冻融,因为会产生变性。当进行胶原和相关自组装胶原产品的储存和货架期测试时,最相关的指示稳定性的参数是那些与胶原成品或材料的功能性相关的指标。根据最终胶原成品所要求的功能,可考虑下述参数,如:黏度(表观的和固有的)、聚合动力学、聚合能力、微结构、物理性质和生物学活性及其它认为相关的参数。可参照YY/T 0681.1 [29]。
5.2 灭菌方法及灭菌过程对产品的影响使用者宜确认灭菌方法不会对胶原类产品造成不利影响。胶原可通过不同的方法进行灭菌,例如(但不限于)γ-射线辐照、电子束或环氧乙烷,或利用无菌工艺进行制备。
宜对胶原潜在的降解产物或灭菌剂残留进行评估以确定对产品的影响。胶原溶液多通过(1)在胶原溶液黏度许可的情况下过滤灭菌;或(2)γ-射线辐照灭菌。灭菌方法的选择主要取决于对终产品有效性的影响。所选方法需经过验证以确定灭菌方式的有效性。
相关标准可参照GB 18280.1[20]和GB 18279.1 [21]。
5.3 原材料来源控制包括适宜的动物供体筛查及组织采集程序,以保证控制原材料外源因子污染的风险。
胶原可通过任一方法从组织或细胞培养中分离出来,包括但不限于用稀酸或稀盐溶液进行提取,或通过酶消化组织进行提取。尽管Ⅲ型胶原分布不广泛,但除骨组织和肌腱外,通常与Ⅰ型胶原同时存在。Ⅴ型胶原也常和Ⅰ型胶原共存。非Ⅰ型胶原可能会影响其聚合特性,也可能增加其免疫原性风险。因此,宜对组织来源进行控制和相应的风险评估[30-33]。
可参照YY/T 0771.1/2[22, 34]相关标准、《动物源性医疗器械注册技术审查指导原则》(2017年版)的要求进行源头控制。
5.4 病毒和TSE的灭活病毒和传染性海绵状脑病病毒因子(TSE)可通过原材料或外来途径被引入终产品中。应采取经过验证的灭活工艺,确保可能存在于终产品中的病毒和TSE被完全灭活或清除。
病毒清除:对人源或动物源的初始材料,应对人源高风险传染病、人畜共患疾病的病原体进行筛查,以减少或消除潜在的传染性,参照GB/T 36988[35]或YY/T 0771.1进行风险评价和风险管理。
病毒清除方法,包括但不限于清洁剂处理、酸或碱(高或低pH)处理、尿素处理或其它化学处理,以及过滤和其它纯化方法。但是,即使这些较为严格的处理方法也不能保证病毒完全被灭活。病毒清除过程宜在适宜的经过验证的病毒清除研究方案中进行。宜确认病毒清除工艺与原材料和成型的终产品是相匹配的。
对于动物来源的材料可参照YY/T 0771. 3[36]及《动物源性医疗器械注册技术审查指导原则》(2017年版);对于人体组织来源的材料参照《同种异体植入性医疗器械病毒灭活工艺验证技术审评指导原则》 [37]进行病毒灭活工艺验证。
TSE来源问题和TSE清除率:对于能耐受灭活TSE因子所要求的严苛处理方式的产品来说,宜对原材料的来源,去除潜在TSE因子的工艺设计,以及灭活TSE因子的处理方式有细致的考量[38-40]。尽管在一种组织中检测到普遍存在的朊病毒的蛋白酶耐受性,常常意味着这种组织含有传染性因子,不适合用于制备植入人体或动物体的胶原材料,但是反过来却不一定正确。因此,仅仅一项耐蛋白酶朊病毒测试的阴性结果可能不足以保证用于制备胶原的原材料是安全的。可参照YY/T 0771.4[41]进行风险管理。
5.5 安全性和毒理学评价胶原类产品在生物医学和药学领域的应用以及用于TEMPs方面的安全性应根据现行的国家标准,如《中华人民共和国药典》2015年版有关生物制品和生化药品部分、国际人用药品注册技术要求国际协调会(ICH)相关指南、GB/T 16886系列标准和组织工程产品相关标准以及相关的指导原则进行全面的临床前评价及生物学评价。特别是需要临床试验审批的临床前安全性评价研究,需根据相关生物制品或医疗器械指导原则的要求进行全面的安全性和毒理学评价。
用于药物缓释的胶原的安全性评价宜结合对预期的临床给药途径和产品的制剂进行考虑,对于一些特定研究,给药途径和制剂形式可能与临床实际情形不一致。非临床毒性研究的需求、时机以及如何开展,均可参照药物研发和申报相关指导原则。这些研究可能包括但不限于:
(1)急性毒性试验,与预期的临床使用治疗机制和时间相关的重复给药毒性试验(ICH M3)[42];
(2)超敏反应试验;
(3)遗传毒性试验(GB/T 16886.3[43]、ICH S2A[44]、ICH S2B[45]);
(4)根据预期的药物使用(如适用)还包括生殖/发育毒性试验(GB/T 16886.3、CH S5A[46]、ICH S5B[47]);以及致癌性试验[GB/T 16886.3、ICH S1A[48]、ICH S1B[49]、ICH S1C[50]、ICH S1C(R)[51]];
(5)另外一些试验可能是针对特定给药途径的,例如注射部位刺激试验:眼刺激试验、皮肤致癌性试验或光毒性和光联合致癌潜力试验。
5.6 生物相容性评价Ⅰ型胶原在结构方面存在较少的种属间差异。Ⅰ型胶原的主要结构和更高级的结构在不同种属间也有高度的相似性,这解释了为什么动物源的胶原能被作为一种可接受的材料用于植入人体。然而,胶原材料的生物相容性还取决于其纯度、杂质成分、工艺中使用的化学试剂残留等因素。
胶原类产品可按照下述标准进行生物相容性评价:G B / T 1 6 8 8 6系列标准(如G B / T 16886.1/9/17 [52-54])、YY/T 0771.1/3、组织工程医疗器械产品的相关标准。
免疫原性:胶原的免疫原性根据材料来源的不同而不同(可以是提取的或重组来源的),尽管上文提到一些原因,仅仅基于种属间差异引起的免疫反应是不常见的。不同生产商的产品可能在性质方面存在如下差异(但不限于):胶原纤维质量(纯度、杂质成分、端肽有无)及羟脯氨酸百分比等。胶原在结构和化学方面的差异可能导致潜在的免疫反应的变化。生产商宜确定对天然胶原在结构上的改变(例如通过化学交联或其它仿生方法)可能在多大程度上影响(增强或减弱)胶原植入人体后的免疫原性。
胶原制备工艺中使用的化学试剂也可能引起胶原免疫原性的改变。免疫原性试验宜考虑但不限于皮肤致敏试验(GB/T 16886.10[55])及动物体内的免疫毒理学试验(GB/T 16886.20[56]),具体要求可参照《动物源性医疗器械注册技术审查指导原则》(2017年版)的附录A。如果植入材料是可降解的,开展动物体内的免疫毒理学试验时宜充分评价降解周期内的免疫原性风险,至少涵盖最坏情况(Worse Case,植入材料大量降解,潜在免疫原充分暴露的时期),以评价剩余免疫原性风险是否可接受。
起草单位和起草人:
中国食品药品检定研究院:徐丽明、陈亮、邵安良、柯林楠、魏利娜、段晓杰、李天任;
中国科学院过程工程研究所:张贵锋、高建萍、邢芳毓、赵磊磊;
四川省食品药品检验检测院(四川省医疗器械检测中心):刘兴兰、王晓亮、郭欢;
国家药品监督管理局医疗器械技术审评中心:刘文博、郭晓磊;
中国医学科学院生物医学工程研究所:张其清;
西北大学化工学院:范代娣;
中国人民解放军总医院:郭全义;
中国人民解放军空军军医大学:金岩。
反馈意见单位:
四川大学生物材料工程研究中心、广州创尔生物技术股份有限公司、北京市医疗器械检验所、悦景(镇江)生物科技有限公司、北京银河巴马生物技术股份有限公司、苏州博创同康生物工程有限公司、中国医学科学院生物医学工程研究所。
责任编辑:
徐丽明,中国食品药品检定研究院医疗器械检定所;张贵锋,中国科学院过程工程研究所。
| [1] |
American Society for Testing Materials. ASTM F3089 Standard Guide for Characterization and Standardization of Polymerizable Collagen-Based Products and Associated Collagen-Cell Interaction[S]. West Conshohocken, 2014.
|
| [2] |
Abraham L C, ZuenaE, Perez-Ramirez B, et al. Guide to Collagen Characterization for Biomaterial Studies[J]. J Biomed Mater Res Part B:ApplBiomater, 2008, 87B: 264-285. DOI:10.1002/jbm.b.31078 |
| [3] |
国家食品药品监督管理总局. YY/T 1453组织工程医疗器械产品Ⅰ型胶原蛋白表征方法[S]. 2016.
|
| [4] |
国家质量监督检验检疫总局. GB/T 9695.23肉与肉制品羟脯氨酸含量测定[S]. 2008.
|
| [5] |
孙坤, 杨帆, 孔英俊, 等. 基于生物质谱的胶原蛋白定量检测方法[J]. 生物工程学报, 2015, 31(11): 1660-1668. |
| [6] |
中华人民共和国药典: 四部[M].北京: 中国医药科技出版社, 2015.
|
| [7] |
国家食品药品监督管理总局. YY 0954无源外科植入物Ⅰ型胶原蛋白植入剂专用要求[S]. 2015.
|
| [8] |
Dusemund B, Barrach H J. Double-antibody Enzyme-linked Immunosorbent Microassay for Quantification of Collagen Types Ⅰ and Ⅱ[J]. J Immunol Methods, 1982, 50(3): 255-268. |
| [9] |
Zhang G, Sun A, Li W, et al. Mass Spectrometric Analysis of Enzymatic Digestion of Denatured Collagen for Identification of Collagen Type[J]. J Chromatography A, 2006, 1114: 274-277. DOI:10.1016/j.chroma.2006.03.039 |
| [10] |
Deyl Z, Novotna J, Miksik I, et al. Quantitation of Collagen Types Ⅰ, Ⅲ and Ⅴ in Tissue Slices by Capillary Electrophoresis after Cyanogen Bromide Solubilization[J]. Journal of Chromatography B:Biomedical Sciences and Applications, 1997, 689(1): 181-194. DOI:10.1016/S0378-4347(96)00349-0 |
| [11] |
Pataridis S, Eckhardt A, Mikulikova K, et al. Determination and Quantification of Collagen Types in Tissues Using HPLC-MS/MS[J]. Current Analytical Chemistry, 2009, 5: 316-323. DOI:10.2174/157341109789077704 |
| [12] |
Novotna J, Deyl Z, Miksik I. Capillary Zone Electrophoresis of Collagen Type I CNBr Peptides in Acid Buffers[J]. Journal of Chromatography B:Biomedical Sciences and Applications, 1996, 681(1). |
| [13] |
Drzewiecki K E, Grisham D R, S Parmar A S, et al. Circular Dichroism Spectroscopy of Collagen Fibrillogenesis. Biophysical Journal[J]. 2016, 111(11): 2377-2386.
|
| [14] |
Schroepfer M, Meyer M. DSC Investigation of Bovine Hide Collagen at Varying Degrees of Crosslinking and Humidities[J]. International Journal of Biological Macromolecules, 2017, 103: 120-128. DOI:10.1016/j.ijbiomac.2017.04.124 |
| [15] |
Pataridis S, Eckhardt A, Mikulikova K, et al. Identification of Collagen Types in Tissues Using HPLC-MS/MS[J]. J Sep Sci, 2008, 31: 3483-3488. DOI:10.1002/jssc.200800351 |
| [16] |
国家食品药品监督管理总局. YY/T 0606.25组织工程医疗产品第25部分: 动物源性生物材料DNA残留量测定法[S]. 2014.
|
| [17] |
Kaga N, Soma S, Fujimura T, et al. Quantification of Elastin Cross-linking Amino Acids, Desmosine and Isodesmosine, in Hydrolysates of Rat Lung by Ion-pairliquid Chromatography-mass Spectrometry[J]. Analytical Biochemistry, 2003, 318: 25-29. DOI:10.1016/S0003-2697(03)00134-9 |
| [18] |
American Society for Testing Materials. ASTM E1821 Standard Test Method for Determination of Carbohydrates in Biomass by Gas Chromatography[S]. West Conshohocken, 2008.
|
| [19] |
American Society for Testing Materials. ASTM E1758 Standard Test Method for Determination of Carbohydrates in Biomass by High Performance Liquid Chromatography[S]. West Conshohocken, 2007.
|
| [20] |
国家质量监督检验检疫总局. GB 18280.1医疗保健产品灭菌辐射第1部分: 医疗器械灭菌过程的开发、确认和常规控制要求[S]. 2015.
|
| [21] |
国家质量监督检验检疫总局. GB 18279.1医疗保健产品灭菌环氧乙烷第1部分: 医疗器械灭菌过程的开发、确认和常规控制的要求[S]. 2015.
|
| [22] |
国家食品药品监督管理总局. YY/T 0771.1动物源医疗器械第1部分: 风险管理应用[S]. 2009.
|
| [23] |
国家食品药品监督管理总局.动物源性医疗器械注册技术审查指导原则[S]. 2017.
|
| [24] |
史新昌, 杨靖清, 韩春梅, 等. N-末端氨基酸测序数据估计N-末端不均一的单链重组蛋白制品主肽链比例方法的建立[J]. 中国生物制品学杂志, 2016, 29(10): 1073-1081. |
| [25] |
Brightman A O, Rajwa B P, Sturgis J, et al. Time-lapse Confocal Reflection Microscopy of Collagen Fibrillogenesis and Extracellular Matrix Assembly in Vitro[J]. Biopolymers, 2000, 54(3): 222-234. DOI:10.1002/1097-0282(200009)54:3<222::AID-BIP80>3.0.CO;2-K |
| [26] |
闫婷婷, 郑学晶, 刘捷, 等. 胶原大分子自组装研究进展[J]. 高分子通报, 2016(8): 18-28. |
| [27] |
Kar K, Amin P, Bryan M A, et al. Self-association of Collagen Triple Helix Peptides into Higher Order Structures[J]. J Biol Chem, 2006, 281(44): 33283-33290. DOI:10.1074/jbc.M605747200 |
| [28] |
国家食品药品监督管理总局. YY/T 1562组织工程医疗器械产品生物支架材料细胞活性评价指南[S]. 2017.
|
| [29] |
国家食品药品监督管理总局. YY/T 0681.1无菌医疗器械包装试验方法第1部分: 加速老化试验指南[S]. 2018.
|
| [30] |
Rubin A, Drake M P, Davison, et al. Effects of Pepsin Treatment on the Interaction Properties of Tropocollagen Macromolecules[J]. Biochemistry, 1965, 4: 181-190. DOI:10.1021/bi00878a001 |
| [31] |
Helseth D L, Veis A J. Collagen Self-assembly In Vitro Differentiating Specific Telopeptide-dependent Interactions Using Selective Enzyme Modifications and the Addition of Free Amino Telopeptide[J]. J Biol Chem, 1981, 256: 7118-7128. |
| [32] |
Capaldi M J, Chapman J A. The C-terminal Extrahelical Peptide of Type I Collagen and Its Role in Fibrillogenesis In Vitro[J]. Biopolymers, 1982, 21: 2291-2313. DOI:10.1002/bip.360211115 |
| [33] |
Gelman R A, Poppke D C, Piez K A. Collagen Fibril Formation In Vitro:The Role of the Nonhelical Terminal Regions[J]. J Biol Chem, 1979, 254: 11741-11745. |
| [34] |
国家食品药品监督管理总局. YY/T 0771.2动物源医疗器械第2部分: 来源、收集与处置的控制[S]. 2009.
|
| [35] |
国家市场监督管理总局. GB/T 36988组织工程用人源组织操作规范指南[S]. 2018.
|
| [36] |
国家食品药品监督管理局. YY/T 0771.3动物源医疗器械第3部分: 病毒和传播性海绵状脑病(TSE)因子去除与灭活的确认[S]. 2009.
|
| [37] |
国家食品药品监督管理局.食药监办械函[2011] 116号同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则[S]. 2011.
|
| [38] |
Hellman K B, Asher D M. Meeting Report:International Workshop on Clearance of TSE Agents from Blood Products and Implanted Tissues[J]. Biologicals, 2000, 28: 189-192. DOI:10.1006/biol.2000.0248 |
| [39] |
Cooley W A, Clark J K, Ryder S J, et al. Evaluation of a Rapid Western Immunoblotting Procedure for the Diagnosis of Bovine Spongiform Encephalopathy(BSE) in the UK[J]. J Comp Pathol, 2001, 125(1): 64-70. DOI:10.1053/jcpa.2001.0478 |
| [40] |
Handley J, Zubritsky E. Blood-based Prion Test[J]. Anal Chem, 2001, 73(9): 252A. |
| [41] |
国家食品药品监督管理局. YY/T 0771.4动物源医疗器械第4部分: 传播性海绵状脑病(TSE)因子的去除和/或灭活及其过程确认分析的原则[S]. 2015.
|
| [42] |
International Conference on Harmonisation (ICH). M3 Guidance on Nonclinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorization for Pharmaceuticals[S]. 2010.
|
| [43] |
国家质量监督检验检疫总局. GB/T16886.3医疗器械生物学评价第3部分: 遗传毒性、致癌性和生殖毒性试验[S]. 2008.
|
| [44] |
International Conference on Harmonisation (ICH). S2A Guidance on Specific Aspects of Regulatory Genotoxicity Tests for Pharmaceuticals[S]. 1996.
|
| [45] |
International Conference on Harmonisation (ICH). S2B Genotoxicity: A Standard Battery for Genotoxicity Testing for Pharmaceuticals[S]. 1998.
|
| [46] |
International Conference on Harmonisation (ICH). S5A Detection of Toxicity to Reproduction for Medicinal Products[S]. 1994.
|
| [47] |
International Conference on Harmonisation (ICH). S5B Detection of Toxicity to Reproduction for Medicinal Products: Addendum on Toxicity to Male Fertility[S]. 1996.
|
| [48] |
International Conference on Harmonisation (ICH). S1A Guideline on the Need for Carcinogenicity Studies of Pharmaceuticals[S]. 1995.
|
| [49] |
International Conference on Harmonisation (ICH). S1B Testing for Carcinogenicity of Pharmaceuticals[S]. 1997.
|
| [50] |
International Conference on Harmonisation (ICH). S1C Dose Selection for Carcinogenicity Studies of Pharmaceuticals[S]. 2008.
|
| [51] |
International Conference on Harmonisation (ICH). S1C(R) Addendum: Addition of a Limit Dose and Related Notes[S]. 2005.
|
| [52] |
国家质量监督检验检疫总局. GB/T 16886.1医疗器械生物学评价第1部分: 风险管理过程中的评价与试验[S]. 2011.
|
| [53] |
国家质量监督检验检疫总局. GB/T 16886.9医疗器械生物学评价第9部分: 潜在降解产物的定性和定量框架[S]. 2017.
|
| [54] |
国家质量监督检验检疫总局. GB/T16886.17医疗器械生物学评价第17部分: 可沥滤物允许限量的建立[S]. 2005.
|
| [55] |
国家质量监督检验检疫总局. GB/T16886.10医疗器械生物学评价第10部分: 刺激与皮肤致敏试验[S]. 2017.
|
| [56] |
国家质量监督检验检疫总局. GB/T 16886.20医疗器械生物学评价第20部分: 医疗器械免疫毒理学试验原则和方法[S]. 2015.
|
 2019, Vol. 33
2019, Vol. 33