pH敏感性生物医用材料是随着外界pH的变化而产生自身体积、形态改变或发生化学键断裂的一类材料。其分子内部一般都包括对H+或OH-敏感的基团,使其能够随着外界pH的变化而产生聚合物分子内或分子间作用力的变化,从而表现出宏观上各种性质的改变,进而实现疾病治疗过程中药物载体的控制释放或者靶向给药的作用[1]。一些pH敏感性生物材料具有良好的生物降解性,可减少毒副作用,增加药物靶向性及给药部位的浓度,提高药物生物利用度,在口服给药系统和肿瘤靶向系统中已取得一定成果,但现在大多研究还停留在试验阶段。本文梳理了常见pH敏感性生物材料(包括pH敏感性脂质体、pH敏感性水凝胶、pH敏感性胶束、pH敏感性复合材料)的定义、作用机理以及在药物研究中的应用,并讨论其未来的研究方向与面临的挑战,期望早日实现真正的产品化和临床化。
1 pH敏感性脂质体 1.1 pH敏感性脂质体的定义脂质体在药物传递系统中常作为如药物/抗原/DNA和/或诊断材料的控制和靶向递送等的药物载体。其大小易被优化,以便穿过细胞间隙进入细胞基质,并通过内吞/吞噬作用有效地吸收药物。此外,其表面可以配备亲水聚合物如聚乙二醇(polyethylene glycol,PEG),以尽量减少网状内皮系统(Reticuloendothelial system,RES)的识别与吸收,从而通过高渗透长滞留效应(enhanced permeability and retention effect,EPR),在肿瘤组织中具有更长的被动积累循环时间[2-3]。经过表面修饰的靶向脂质体能够绕过生物环境施加的屏障,甚至达到细胞和亚细胞水平[4]。利用位点定向配体,对其表面进行修饰为靶向脂质体药物传递提供了途经。而专门设计可以控制其内容物释放的脂质体来响应内部环境的酸性pH值,即为pH敏感性脂质体(pH-sensitive liposomes)[5]。
pH敏感性药物给药的概念是1980年提出的[6]。此后研究[7-8]发现,在肿瘤细胞外环境等不同位置pH值的改变,有利于设计针对特定癌细胞靶向的pH敏感性脂质体,增强细胞内化和细胞内药物快速释放,位点定向配体在pH敏感性脂质体上的锚定通过靶向药物传递增强了这种作用[9-10]。此外,pH敏感性脂质体能够相互作用,促进膜融合或增强其不稳定性,从而有效地将包封物释放到细胞胞浆中。pH敏感性脂质体在细胞内传递药物是克服多药耐药的有效手段[11]。
1.2 pH敏感性脂质体的作用机理pH敏感性脂质体又称酸敏脂质体。磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)[12]是脂质体中常用的组分,其水化程度最低,与相应的烃链相比首端基团较小。尽管存在层状相,但其呈锥状结构。由于极性首端基团的胺基与磷酸基的相互作用,锥状有利于在相变温度以上形成倒六角形相。当在PE中插入含有可质子化酸性基团的两亲性分子时,它会在生理pH值下形成稳定的双层结构;但在低pH时,两亲体的酸性基团质子化导致脂质体的不稳定,pH敏感性脂质体会迅速失稳,脂肪酸羧基会发生质子化,从而导致形成六角相。因此,选择pH敏感的脂质和两亲性稳定剂,以形成稳定的pH敏感脂质体,需要确定细胞内化程度、融合能力、pH敏感性和生物液体中的稳定性等性质。二油酰基磷脂酰乙醇胺(Dioleoyl Phosphoethanolamine,DOPE)是pH敏感性脂质体的关键成分之一。含有磷脂酰甘油、磷脂酰丝氨酸、磷脂酰胆碱和胆甾醇基半胱氨酸复合物的脂质体,当在酸性核内体中孵育培养,由于DOPE的存在而失去稳定性。这是由于在酸性条件下带有DOPE的低水合极性首端基团转化为六角形倒置相位,进而形成非层状结构,进而失去稳定性。
有一些带有负电荷的脂质体如二油酰基卵磷脂(Dioleoyl Phosphatidylcholine,DOPC)也可用于诱导pH敏感性。这些脂质体在体内酸化时被中和导致失稳,促使脂质体膜和核内体膜相互融合,能够快速将药物从脂质体中释放出来[13-14];而在正常组织部位的膜破裂较慢,使药物释放缓慢,从而使药物大量地聚集在肿瘤部位,既实现细胞内靶向作用又控制药物释放。
人体的病理组织(如在肿瘤间质液、局部缺血区域以及被感染或有炎症的区域),pH常为5.0~6.5,明显比周围正常组织偏低,出现异常酸化。对于这些部位,由于pH敏感性脂质体会被RES的吞噬细胞识别和隔离,应用会受到限制,使其作为载体的半衰期很短。为避免此影响,有研究[15]建议将聚乙二醇磷脂交联在脂质体膜上,使pH敏感性脂质体一定程度上避免溶酶体降解并增加包封物摄取量和稳定性,有效地将包封物转运至胞浆,可获得比非pH敏感性脂质体更好的转运效果。
1.3 pH敏感性脂质体的应用pH敏感性脂质体已被应用于包括化疗在内的药物传递中。Karanth H等[16]研究出一种药物载体,能够通过EPR效应而在肿瘤区域自发积累。这些脂质体表面同时携带着细胞穿透肽,如转录反激活肽(TATp)片段和保护性PEG链。聚乙二醇化的脂质体通过EPR效应在靶细胞中积累,但在“酸化”的肿瘤缺血组织中,由于pH诱导的水解作用降低而失去了PEG层,并通过现已暴露的TATp片段渗透到细胞内,从而发挥作用[17]。
在免疫治疗中,pH敏感性脂质体常用来传递治疗性高分子。脂质体药物在目标组织中的积累可以通过连接配体来改善。配体能够识别和结合受体存在于细胞,而抗体及其片段可以很容易地锚定在脂质体表面,而不改变脂质体的完整性和抗体特性。单克隆抗体诱导的免疫脂质体有望成为肿瘤靶向药物传递的载体[18]。Kim等[19]利用表皮生长因子受体抗体(epidermal growth factor receptor,EGFR)开发了长循环pH敏感性脂质体,并在A549细胞和BALB/c-nu/nu小鼠肿瘤模型上进行了试验。开发的制剂为EGFR抗体过表达的肿瘤提供了高效和靶向的吉西他滨递送。
pH敏感性脂质体是开发热激动剂和多模态成像探针的理想选择。当pH发生变化时,它们会释放出被捕获的成像探针/放射性试剂,这些变化通常在几种疾病(如肿瘤)早期无症状期就被发现。有研究[20]报道,带有99mTc的pH敏感性脂质体在荷瘤小鼠体内的闪烁成像现象,这个系统在肿瘤组织中有较高的蓄积性,可以作为一种潜在的肿瘤药物诊断方法。
目前,也有些pH敏感性脂质体作为治疗性和预防性疫苗载体的研究。这些脂质体主要被用于传递小肽以产生有效免疫反应并降低其毒性。Chang等[21]通过将T淋巴细胞(CTL)表位包封到pH敏感性脂质体中,成功地将其传递给靶细胞,CTL表位被转移到内质网(Endoplasmic reticulum,ER),可以与一类主要组织相容性复合体(major histocompatibility complex,MHC)相关联。Lee等[22]研究了包覆荧光素异硫氰酸酯(FITC)共轭H-2Kb CTL表位的pH敏感性脂质体的免疫潜力,免疫治疗3天后,pH敏感性脂质体对递呈的抗原产生显著的CTL活性,这表明pH敏感性脂质体是一种强肽佐剂,可用于开发治疗性或预防性疫苗的肽传递。
2 pH敏感性水凝胶 2.1 pH敏感性水凝胶的定义水凝胶是由交联成三维网络结构的聚合物材料构成[23-24]。水凝胶的聚合物链上存在有大量亲水基团,如-NH2、-OH、-COOH、-SO3等,随着毛细管作用和渗透压的增大,水凝胶由于其聚合物链之间的交联,在周围介质中不易溶解。水凝胶中的交联可以是物理性的或化学性的。物理性交联是其聚合物链上极性基团之间的二级氢键形成的,而化学性交联是通过特殊的交联剂促进聚合物链上不同的官能团之间的共价键形成的。物理性交联及化学性交联如图 1所示[25]。

|
a.水凝胶结构;b.物理性交联水凝胶结构;c.化学性交联水凝胶结构。 图 1 水凝胶的物理性与化学性交联结构示意图 |
此外,水凝胶上的亲水性基团可以和不同的生物组织形成非共价键。这些结构上的优势可以在链与链之间的间隙中吸收并保持大量的水分,即使是在压力作用下被吸收的溶液也不能从溶胀的水凝胶中去除。水凝胶另一个特性是对不同刺激的可逆反应,如光、pH、温度、电场、磁场、溶液离子强度、氧化还原和生物分子等,这使得它们在生物医学的广泛应用中特别重要。刺激反应型水凝胶在一定的刺激下导致体积相变时,会发生突然的收缩和膨胀。在刺激反应型水凝胶中,pH敏感性水凝胶是研究最多的水凝胶。
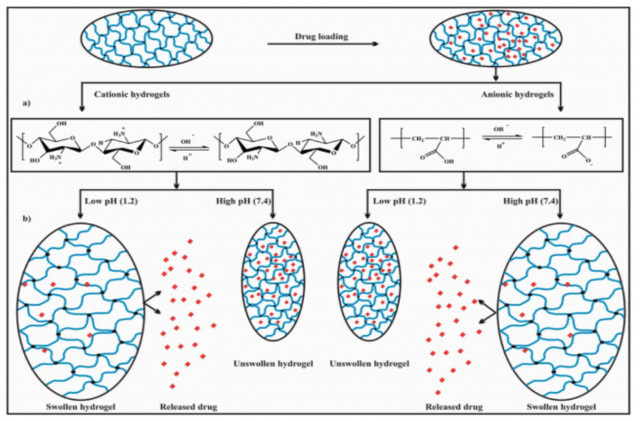
2.2 pH敏感性水凝胶的作用机理pH敏感性水凝胶溶胀是由于其带有带电荷的悬垂基团,受到离子电荷、可电离基团的pKa或pKb值、电离程度、亲水性、聚合物浓度、溶胀介质的pH等因素控制。其中,控制pH敏感性水凝胶性能的关键因素主要包括:1)组成水凝胶的聚合物的性质,如交联密度、亲水性、疏水性、浓度、离子电荷、酸性悬垂基团的pKa值或碱性悬垂基团的pKb值;2)溶胀介质的性质,如离子强度、pH值和反离子等[26]。水凝胶聚合物链上酸性或碱性基团的溶胀作用取决于周围介质相对其各自pKa和pKb值的pH值。一方面,带有阴离子悬垂基团(如羧基等)时,当周围介质的pH值大于聚合物链上酸性基团的pKa值时,酸性基团的电离作用导致聚合物链上产生固定的负电荷和溶液中流动的正电荷。因此,水凝胶的亲水性增加,固定负电荷的数量增加,导致水凝胶网络膨胀的链之间的静电斥力增加,反之亦然(当pH值小于pKa时)。另一方面,当带有阳离子悬垂基团(如氨基等)时,如果周围介质的pH值小于悬垂基团的pKb值,悬垂基团发生电离质子化,导致聚合物链上固定的正电荷增加,溶液中流动的负电荷增加。由于聚合物链亲水性质的增加、固定正电荷的数量增加,链与链之间的静电斥力导致了膨胀。当pH值大于pKb时,反之亦然[27-28]。pH敏感性水凝胶的一般机制如图 2所示[25]。
|
a.水凝胶酸性或碱性基团基于pH质子化膨胀;b. pH敏感性膨胀和药物释放机制。 图 2 pH敏感性水凝胶的一般作用机制示意图 |
阳离子水凝胶如壳聚糖(CS)和聚亚胺(乙烯亚胺),由于氨基/亚胺基团的质子化,带正电荷的分子在聚合物链上引起排斥,而在低pH(酸性介质)下膨胀。这些类型的水凝胶可以用于药物(抗生素)输送到胃溃疡或作为载体的注射药物输送系统。而像阴离子水凝胶在较高的pH值(碱性介质)下,由于酸性基团的电离,聚合物链上的带负电荷的悬垂基团之间会引起排斥,导致膨胀。这种性质的水凝胶可用于pH 7.4的肠内给药[29]。
2.3 pH敏感性水凝胶的应用pH敏感性水凝胶已被广泛应用于生物医学领域,尤其是利用胃肠道pH变化进行药物传递的应用。由于载体对特定刺激如温度、pH等的敏感性,口服给药是将治疗药物送到选定部位的主要途径。胃肠道pH梯度变化较大,口腔唾液pH范围为6.7~7.3[30],胃的pH范围为1.0~3.0,肠的pH范围为5.0~8.0,这些可以作为pH敏感性水凝胶用于药物传递的刺激因素。以CS为基础的水凝胶根据身体病变部位pH值不同,在胃癌、胃炎和胃十二指肠溃疡等治疗中具有不同的局部释放作用。ElMahrouk等[31]制备了pH敏感性壳聚糖基水凝胶,与负载甲硝唑的三聚磷酸盐交联,用于清除胃中的幽门螺杆菌,制备的水凝胶在胃液pH值下比在肠液pH值下具有更高的溶胀度和更大的释药量。Risbud等[32]制备了由CS与聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)组成的pH敏感性水凝胶,PVP与戊二醛交联,用于胃靶向释放抗生素。
另外,CS及其衍生物和其共混物被用作药物载体[33]来延长药物在胃内停留时间和延长药物的缓释时间。Kumar等[34]制备了用于克拉霉素胃靶向给药的pH敏感性水凝胶,以过硫酸铵为引发剂与乙烯基吡咯烷酮共混,以戊二醛和N, N-亚甲基双丙烯酰胺为交联剂,采用自由基聚合法以丙烯酸为原料来接枝CS。可以发现,这些共价交联水凝胶在胃环境中对pH值敏感,由于一个氨基的质子化达到了靶向缓释,所以在低pH值下,它们表现出最大的肿胀和药物释放。引入丙烯酸作为接枝剂目的是为了控制肿胀(避免爆裂释放),实现抗生素的持续释放。
尽管pH敏感性水凝胶已经在从药物传递到组织工程的各领域得到了应用,但开发一种能在酸性和碱性条件下以理想方式发挥作用的水凝胶仍面临挑战。同时,在组织工程应用中,对可在一定时间内降解的水凝胶的开发也提出了很高的要求。因为在组织再生过程中,液体的吸收是一个关键因素,溶胀行为对水凝胶非常重要。然而,由于溶液的吸收,一些水凝胶失去了它们的机械强度。为了克服这一缺点,研究人员正致力于通过接枝或单体共聚来合成新的聚合物,同时发现新的无毒交联剂。这些新的合成方法将使水凝胶具有全面、无毒、生物相容性和生物降解性,具有高的载药量/包封效率和对刺激的快速反应。
3 pH敏感性胶束 3.1 pH敏感性胶束的定义聚合物胶束可以用于抗肿瘤药物的传递和控制释放,从而提高药物的疗效并减少副作用[35-36]。多数肿瘤病理特征不同于正常组织器官,如肿瘤血管生长迅速、结构完整性差,缺乏肿瘤组织淋巴回流系统,存在有大量肿瘤血管通透性因子[37]。值得注意的是,生长中的实体瘤血管通透性增加,孔径为200~780 nm,而载药纳米颗粒足够小(一般在60~500 nm),可以通过这些孔隙从血液到肿瘤间质内[38]。纳米聚合物胶束通过EPR效应将抗肿瘤药物传递和积累到肿瘤组织,实现有效的靶向给药系统(transdermal drug delivery systems,TDDS)[39]。然而,聚合物药物在到达肿瘤部位前释放过快会引起毒副作用,降低靶区药物浓度;而释放过慢会降低靶区药物疗效,增加肿瘤细胞的耐药性。为了克服这些障碍,研究设计对环境敏感的聚合物,可以响应和感知外源性刺激(光、温度、超声波等)或肿瘤微环境刺激物(pH、酶活性、氧化还原特性),来触发药物释放[40]。在这些刺激反应系统中,pH敏感性胶束是目前药物传递系统研究的热点。pH敏感性胶束是由两亲性嵌段共聚物在水中自组装形成的聚合物胶束和可以对pH产生敏感性响应的结合位点构成,可以根据作用部位的酸碱敏感度进行靶向治疗,在一定程度上避免了胶束本身载药效率低、聚合物与药物相容性差、靶向性差及释放速度难以控制的弊端[1]。
3.2 pH敏感性胶束的作用机理pH敏感性胶束在药物传递系统中的作用机制通常是以下两种类型:
一种是在V型H+ ATP酶的活性下,通过内吞作用结合的pH敏感纳米载体形成明显的酸化腔(pH 4.5~5.5)[41]。然后,酸敏材料可以捕获质子,引起氯离子流入,导致溶酶体渗透压增加,最终溶酶体破裂,药物和载体释放到细胞质(质子海绵机制)。这种“内溶酶体逃逸”现象可以避免溶酶体对内容物的降解,提高生物利用度[42-43]。
另一种是相对于正常组织而言,肿瘤组织的酸性环境可以触发pH敏感性胶束以低pH释放包膜/结合药物。肿瘤细胞即使在正常条件下也会产生过多的乳酸,而实体肿瘤具有缺氧性,肿瘤细胞的能量主要来源于糖酵解,因此,肿瘤细胞糖酵解率高的特点是肿瘤pH值低的主要原因[44]。肿瘤组织间质细胞呈弱酸性(pH<7.0),而正常组织和血液细胞外pH值保持在7.2~7.4,这为pH敏感性胶束的开发和应用提供了重要的理论基础。pH敏感性胶束通过EPR效应到达肿瘤部位,然后通过细胞内化后的核内体(pH 5.5~6.0)或溶酶体(pH 5.0)途径转运。在此过程中,pH值从正常生理状态(pH 7.4)下降到pH 5.0左右[45]。到目前为止,已经设计出多种pH敏感性胶束,药物可以被物理封装或与胶束发生化学偶联。这些胶束在生理pH值保持稳定,和水不溶性药物封装在疏水核心,在漫长的体循环过程中并不泄露,但在低pH环境下会发生反应(如核内体)失去稳定性,从而释放药物,以帮助实现所需的抗肿瘤效应。
为了响应肿瘤的酸性微环境,可以根据两种主要形式设计聚合物胶束。一种是纳米胶束材料由具有可电离化学基团的聚合物组成,这些聚合物可以接受或贡献质子来响应环境pH值的变化。这些可电离的阳离子/阴离子聚合物在生理pH值下,仍然处于去质子化/去离子状态,导致聚合物在酸性pH值下质子化或电荷反转,引起结构破坏从而特异性释放包膜药物[46]。第二种形式是利用酸不稳定键增加细胞内药物释放或核内体逸出。药物与聚合物之间或聚合物内部的酸不稳定键水解被认为是一种很有前途的策略,通过在酸性pH下破坏酸不稳定键将药物递送到肿瘤组织并释放药物[47]。
3.3 pH敏感性胶束的应用Gu等[48]基于三嵌段共聚物聚(乙二醇)-聚(组氨酸)-聚(L -丙交酯)的自组装,开发了PEG-PH-PLLA纳米粒子,将抗肿瘤药物盐酸阿霉素(Doxorubicin,DOX)包埋在纳米颗粒中。从理论上讲,自组装纳米粒子可分为疏水PLLA段、pH敏感PH块和亲水PEG链三层。在不同的pH值下,PH层随着质子化/去质子化而膨胀或收缩,以控制DOX的释放。24.5 h后,pH 5.0中纳米粒子的累积释放速率接近80%,而pH 7.4中纳米粒子的累积释放速率小于40%。体外HepG2细胞的研究表明,载药纳米粒的抗肿瘤作用亦优于游离载药。
Zhong等[49]设计并制备了核内pH敏感性紫杉醇(pachitaxel.Taxol,PTX)前药胶束纳米粒,并研究了其对人类癌细胞的体外生长抑制作用。体外药物释放谱显示,PTX前药纳米粒的药物释放具有高度的pH依赖性,其中,在37℃下作用48 h后,pH为5.0、6.0、7.4时,PTX前药释放率分别为86.9%、66.4%和29.0%。四唑盐比色法检测表明,和PTX耐药的A549细胞一样,这些pH敏感性PTX前体药物纳米粒子对于KB和HeLa细胞亦表现出较高的抗肿瘤效应。
氯己定(Chlorhexidine,CHX)是阳离子广谱抗菌剂,一直应用于牙科治疗中,而在口腔中持续使用CHX会导致牙齿染色和味觉障碍。为了有必要减少CHX对口腔组织的毒副作用,Benoit等[50]开发了pH活化的阳离子纳米粒子,带负电荷胞外多糖(Exopolysaccharides,EPS)具有优异的吸附亲和性,实现了在致龋生物膜微环境中靶向抗菌药物的传递。Shi等[50]设计了一个高效的抗菌药物传递系统,该系统使用pH反应性混合壳聚合物胶束。这些胶束在低pH条件下带正电荷,以带负电荷的细菌细胞膜为目标,细胞膜随后被细菌脂肪酶水解,胶囊药物快速释放。从以上研究可以得出,pH敏感的酸性不稳定基团聚合物纳米载体可用于降低CHX的副作用,提高药物的传递效率。
pH敏感性胶束因其具有对pH敏感的药物释放特性,在肿瘤靶向药物传递系统中具有独特的优势。为了进一步完善pH敏感性胶束给药系统,还需要进一步系统研究其他因素,包括包封药物的组成结构、粒径、Zeta电位、表面特性和性能。此外,pH敏感性的肿瘤靶向给药系统也是一个重要的研究策略。虽然pH敏感性胶束给药系统的开发还存在很多问题需要解决,但对于克服化疗可能出现的不良反应、提高治疗效果具有不可忽视的作用,是肿瘤靶向给药系统的理想选择。
4 pH敏感性复合材料 4.1 pH敏感性复合材料的定义近年来,pH敏感性生物材料的研究热点在于在pH敏感性高分子材料上引入其他材料来构成复合材料,不仅可以利用引入部位特有的电磁学或光学性质进行载体靶向或成像研究,还可以利用药物载体对于pH的敏感响应,使其在特定的部位发挥相应的药物释放作用[1, 51]。
4.2 pH敏感性复合材料的作用机理pH敏感性复合材料由于引入的成分多种多样,如无机磁性材料、荧光材料、热敏材料等,其作用机理随着其添加的复合材料的不同和需达到的效果而有所变化。如Guanghui Hou等[52]研制了一种二羟基苯基/肼双官能化羟乙基壳聚糖(dihydroxyphenyl/hydrazide bifunctionalized hydroxyethyl chitosan,DHHC)-金纳米棒(gold nanorod,GNR)偶联物修饰的pH敏感性透明质酸来实现乳腺癌光热联合化疗。GNR作为最有效的光热剂之一,纵向表面等离子体共振(LSPR)可调,且光热转换效率高。研究人员将阿霉素(Doxorubicin,DOX)通过不稳定的联氨酰亚胺(酰肼)连接到偶联物上。负载的偶联物在中性水溶液中表现出良好的稳定性,并表现出pH反应性药物释放和表面电荷反转行为。体外生物学研究表明,该结合物可被乳腺癌MCF-7细胞有效内化,具有协同治疗作用,在乳腺癌光热联合化疗中具有巨大的应用潜力。
4.3 pH敏感性复合材料的应用Beloqui等[53-54]采用聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]和聚甲基丙烯酸酯(ES100)制备了pH敏感的PLGA-ES100纳米粒。释药结果表明,在pH较低的模拟胃液中PLGA-ES100纳米粒释药受到抑制,而在肠液中释药迅速,这是由于ES100结构中的羧基在偏碱性时发生去质子化,致使ES100膨胀并溶解,促使包载其中的药物迅速释放,因此,PLGA-ES100纳米粒用于口服给药时,可将药物特异性靶向于结肠部位。
Qingxuan Li等[55]采用CS、苯十二烷基二甲基溴化铵和盐酸阿霉素3种不同的阳离子制备了肝素基多离子复合物(heparin-based polyion complexes,HPICs)。它们的形态可以通过HPIC中肝素的含量进行调节,并表现出pH敏感性分解。以乙酰肝素-苯并十二烷基二甲基溴化铵PIC为原料,将阿霉素包封在胶束和囊泡载体中,乙酰肝素-阿霉素PIC可直接作为药物载体。这种药物载体具有明显的pH敏感性释药行为,且对肿瘤细胞具有明显的细胞毒性,该载体能够将抗肿瘤药物递送到肿瘤细胞的细胞核内。这意味着HPIC在药物载体的应用上具有广阔的前景。
Cunfeng Song等[56]合成了含有链内交联球粒和pH敏感的线性聚合物链的超细单链蝌蚪聚合物(single-chain tadpole polymers,SCTPs)。这些聚合物的自组装依赖于线性聚合物链长和聚合物组装时的pH值。聚合物自组装结构的可逆性转变对pH值的依赖性可以实现肿瘤组织深度穿透的可能性。研究结果表明,在体外肿瘤多细胞球体中确实存在pH依赖的深部组织穿透。此外,多蝌蚪组装体(multi-tadpole assemblies,MTAs)可以稳定地包封疏水分子,已用于PTX的包封,这些PTX/MTAs在4T1异种移植小鼠模型中显示出良好的治疗效果和生物安全性。创新多室聚合能够随着微环境的变化实现结构相关的功能转变,这对于丰富复杂生物制剂的设计具有极大的潜力。
当叠加多种功能单元时,pH敏感性复合材料可能会因为功能单位彼此之间的相互干扰而导致其功效削弱或消失,这就需要进行合理的选择、修饰及整合,进而制备出多种功能单元协同的复合材料来应用于临床。
5 结束语目前,新型pH敏感性生物医用材料有很多,研究也日益成熟。但大多研究还停留在试验阶段,还存在很多问题尚未解决,例如一些pH敏感性材料的生物相容性、机械性能、生物降解性与有效性的协同作用、作为载体的生物医用材料的药物毒理学作用、包封率和聚合物选择等。今后pH敏感性生物材料的研究面临最大的挑战即是选择、修饰以及整合相应材料,设计并制备出安全有效的pH敏感性生物医用材料,解决由于不同生物材料结构特点而产生的技术难题,进而实现真正的产品化和临床化。
| [1] |
杨燕, 周亮, 舒婷. pH敏感型药物载体材料的研究进展[J]. 化学工程师, 2015, 29(10): 37-39,50. |
| [2] |
Andresen T L, Jensen S S, Kent Jørgensen. Advanced Strategies in Liposomal Cancer Therapy:Problems and Prospects of Active and Tumor Specific Drug Release[J]. Progress in Lipid Research, 2005, 44(1): 68-97. DOI:10.1016/j.plipres.2004.12.001 |
| [3] |
Yu B, Tai H C, Xue W, et al. Receptor-Targeted Nanocarriers for Therapeutic Delivery to Cancer[J]. Molecular Membrane Biology, 2010, 27(7): 286-298. |
| [4] |
Paliwal S R, Paliwal R, Agrawal G P, et al. Liposomal Nanomedicine for Breast Cancer Therapy[J]. Nanomedicine, 2011, 6(6): 1085-1100. |
| [5] |
Hong M S, Lim S J, Oh Y K, et al. pH-Sensitive, Serum-Stable and Long-circulating Liposomes as a New Drug Delivery System[J]. Journal of Pharmacy and Pharmacology, 2002, 54(1): 51-58. |
| [6] |
Atvin M B, Kreutz W, Horwitz B, et al. Induced Drug Release from Lipid Vesicles in Serum by pH-Change[J]. Biophys Struct Mech, 1980, 6(3): 233-234. DOI:10.1007/BF00537296 |
| [7] |
Bertrand N. Serum-Stable, Long-Circulating, pH-Sensitive PEGylated Liposomes[J]. Methods in Molecular Biology, 2010, 605(Suppl 3): 545. |
| [8] |
Sawant R M, Hurley J P, Salmaso S, et al. "SMART" Drug Delivery Systems:Double-Targeted pH-Responsive Pharmaceutical Nanocarriers[J]. Bioconjugate Chemistry, 2006, 17(4): 943-949. |
| [9] |
Simard P, Leroux J C. pH-Sensitive Immunoliposomes Specific to the CD33 Cell Surface Antigen of Leukemic Cells[J]. International Journal of Pharmaceutics, 2009, 381(2): 86-96. |
| [10] |
Simard P, Leroux J C. In Vivo Evaluation of pH-Sensitive Polymer-Based Immunoliposomes Targeting the CD33 Antigen[J]. Molecular Pharmaceutics, 2010, 7(4): 1098-1107. |
| [11] |
Chen H, Zhang H, Thor D, et al. Novel pH-Sensitive Cationic Lipids with Linear Ortho Ester Linkers for Gene Delivery[J]. European Journal of Medicinal Chemistry, 2012, 52: 159-172. |
| [12] |
Paliwal S R, Paliwal R, Vyas S P. A Review of Mechanistic Insight and Application of pH-Sensitive Liposomes in Drug Delivery[J]. Drug Delivery, 2015, 22(3): 231-242. |
| [13] |
Drummond D C, Zignani M, Leroux J C. Current Status of pH-Sensitive Liposomes in Drug Delivery[J]. Progress in Lipid Research, 2000, 39(5): 409-460. |
| [14] |
Venugopalan P, Jain S, Sankar S, et al. pH-Sensitive Liposomes:Mechanism of Triggered Release to Drug and Gene Delivery Prospects[J]. Pharmazie, 2002, 57(10): 659-671. DOI:10.1159/000058350 |
| [15] |
Momekova D, Rangelov S, Lambov N. Long-Circulating, pH-Sensitive Liposomes[J]. Methods in Molecular Biology, 2010, 605(605): 527. |
| [16] |
Karanth H, Murthy R S R. pH-Sensitive Liposomes-Principle and Application in Cancer Therapy[J]. Journal of Pharmacy and Pharmacology, 2007, 59(4): 469-483. |
| [17] |
Kale A, Torchilin V. "Smart" Drug Carriers:PEGylated TATp-Modified pH-Sensitive Liposomes[J]. Journal of Liposome Research, 2007, 17(3): 197-203. |
| [18] |
Abra R M, Bankert R B, Chen F, et al. The Next Generation of Liposome Delivery Systems:Recent Experience with Tumor-Targeted, Sterically-Stabilized Immunoliposomes and Active-Loading Gradients[J]. Journal of Liposome Research, 2002, 12(1-2): 1-3. |
| [19] |
Kim I Y, Kang Y S, Lee D S, et al. Antitumor Activity of EGFR Targeted pH-Sensitive Immunoliposomes Encapsulating Gemcitabine in A549 Xenograft Nude Mice[J]. Journal of Controlled Release, 2009, 140(1): 55-60. |
| [20] |
André Luís Branco de Barros, Mota L D G, Daniel Crístian Ferreira Soares, et al. Tumor Bombesin Analog Loaded Llong-Circulating and pH-Sensitive Liposomes as Tool for Tumor Identification[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(24): 7373-7375. |
| [21] |
Chang J S, Choi M J, Cheong H S, et al. Development of Th1-Mediated CD8+Effector T Cells by Vaccination with Epitope Peptides Encapsulated in pH-Sensitive Liposomes[J]. Vaccine, 2001, 19(27): 3608-3614. |
| [22] |
Lee K Y, Chun E, Seong B L. Investigation of Antigen Delivery Route in Vivo and Immune-Boosting Effects Mediated by pH-Sensitive Liposomes Encapsulated with Kb-Restricted CTL Epitope[J]. Biochemical and Biophysical Research Communications, 2002, 292(3): 682-688. DOI:10.1006/bbrc.2002.6711 |
| [23] |
Yar M, Shahzad S, Siddiqi S A, et al. Triethyl Orthoformate Mediated a Novel Crosslinking Method for the Preparation of Hydrogels for Tissue Engineering Aapplications:Characterization and in Vitro Cytocompatibility Analysis[J]. Materials Science and Engineering:C, 2015, 56: 154-164. DOI:10.1016/j.msec.2015.06.021 |
| [24] |
Samanta H S, Ray S K. Controlled Release of Tinidazole and Theophylline from Chitosan Based Composite Hydrogels[J]. Carbohydrate Polymers, 2014, 106: 109-120. |
| [25] |
Muhammad R, Rosiyah Y, Aziz H, et al. pH Sensitive Hydrogels in Drug Delivery:Brief History, Properties, Swelling, and Release Mechanism, Material Selection and Applications[J]. Polymers, 2017, 9(12): 137. DOI:10.3390/polym9040137 |
| [26] |
Ullah F, Othman M B H, Javed F, et al. Classification, Processing and Application of Hydrogels:A Review[J]. Materials Science and Engineering C, 2015, 57: 414-433. |
| [27] |
Gupta P, Vermani K, Garg S. Hydrogels:from Controlled Release to pH-Responsive Drug Delivery[J]. Drug Discovery Today, 2002, 7(10): 569-579. |
| [28] |
Buenger D, Topuz F, Groll J. Hydrogels in Sensing Applications[J]. Prog. Polym. Sci., 2012, 37: 1678-1719. |
| [29] |
Du H, Liu M, Yang X, et al. The Design of pH-Sensitive Chitosan-Based Formulations for Gastrointestinal Delivery[J]. Drug Discovery Today, 2015, 20: 1004-1011. DOI:10.1016/j.drudis.2015.03.002 |
| [30] |
Baliga S, Muglikar S, Kale R. Salivary pH:A Diagnostic Biomarker[J]. Journal of Indian Society of Periodontology, 2013, 17(4): 461-465. |
| [31] |
El-Mahrouk G M, Aboul-Einien M H, Makhlouf A I. Design, Optimization, and Evaluation of a Novel Metronidazole-Loaded Gastro-Retentive pH-Sensitive Hydrogel[J]. AAPS PharmSciTech, 2016, 17(6): 1285-1297. DOI:10.1208/s12249-015-0467-x |
| [32] |
Risbud M V, Hardikar A A, Bhat S V, et al. pH-Sensitive Freeze-Dried Chitosan-Polyvinyl Hydrogels as Controlled Release System for Antibiotic Delivery[J]. Journal of Controlled Release, 2000, 68(1): 23-30. |
| [33] |
Shahzad S, Yar M, Siddiqi S A, et al. Chitosan-Based Electrospun Nanofibrous Mats, Hydrogels and Cast Films:Novel Anti-bacterial Wound Dressing Matrices[J]. Journal of Materials Science:Materials in Medicine, 2015, 26(3): 136. |
| [34] |
Gupta A K, Siddiqui A W, Datta M S, et al. Interpenetrating Polymeric Network Hydrogel for Stomach-Specific Drug Delivery of Clarithromycin:Preparation and Evaluation[J]. Asian Journal of Pharmaceutics, 2010, 4(4): 179. |
| [35] |
Kanapathipillai M, Brock A, Ingber D E. Nanoparticle Targeting of Anti-Cancer Drugs that Alter Intracellular Signaling or Influence the Tumor Microenvironment[J]. Advanced Drug Delivery Reviews, 2014, 79-80: 107-118. |
| [36] |
Zhang Y, Li P, Pan H, et al. Retinal-Conjugated pHSensitive Micelles Induce Tumor Senescence for Boosting Breast Cancer Chemotherapy[J]. Biomaterials, 2016, 83: 219-232. DOI:10.1016/j.biomaterials.2016.01.023 |
| [37] |
Maeda H. The Enhanced Permeability and Retention (EPR) Effect in Tumor Vasculature:The Key Role of Tumor-Selective Macromolecular Drug Targeting[J]. Adv Enzyme Regul, 2001, 41: 189-207. DOI:10.1016/S0065-2571(00)00013-3 |
| [38] |
Dreher M R, Liu W, Michelich C R, et al. Tumor Vascular Permeability, Accumulation, and Penetration of Macromolecular Drug Carriers[J]. JNCI Journal of the National Cancer Institute, 2006, 98(5): 335-344. |
| [39] |
Bae Y, Nishiyama N, Fukushima S, et al. Preparation and Biological Characterization of Polymeric Micelle Drug Carriers with Intracellular pH-Triggered Drug Release Property:Tumor Permeability, Controlled Subcellular Drug Distribution, and Enhanced in Vivo Antitumor Efficacy[J]. Bioconjugate Chemistry, 2005, 16(1): 122-130. DOI:10.1021/bc0498166 |
| [40] |
Liu Z, Zhang N. pH-Sensitive Polymeric Micelles for Programmable Drug and Gene Delivery[J]. Current Pharmaceutical Design, 2012, 18(23): 3442-3451. |
| [41] |
Forgac, Michael. Vacuolar ATPases:Rotary Proton Pumps in Physiology and Pathophysiology[J]. Nature Reviews Molecular Cell Biology, 2007, 8(11): 917-929. DOI:10.1038/nrm2272 |
| [42] |
Xu H, Paxton J W, Wu Z. Enhanced pH-Responsiveness, Cellular Trafficking, Cytotoxicity and Long-Circulation of PEGylated Liposomes with Post-Insertion Technique Using Gemcitabine as a Model Drug[J]. Pharmaceutical Research, 2015, 32(7): 2428-2438. |
| [43] |
Zhang X, Chen D, Ba S, et al. Poly (r, lr, -histidine) Based Triblock Copolymers:pH Induced Reassembly of Copolymer Micelles and Mechanism Underlying Endolysosomal Escape for Intracellular Delivery[J]. Biomacromolecules, 2014, 15(11): 4032-4045. |
| [44] |
Neri D, Supuran C T. Interfering with pH Regulation in Tumours as a Therapeutic Strategy[J]. Nature Reviews Drug Discovery, 2011, 10: 767-777. |
| [45] |
You J O, Auguste D T. Nanocarrier Cross-Linking Density and pH Sensitivity Regulate Intracellular Gene Transfer[J]. Nano Letters, 2009, 9(12): 4467-4473. |
| [46] |
Fleige E, Quadir M A, Haag R. Stimuli-Responsive Polymeric Nanocarriers for the Controlled Transport of Active Compounds:Concepts and Applications[J]. Advanced Drug Delivery Reviews, 2012, 64(9): 866-884. DOI:10.1016/j.addr.2012.01.020 |
| [47] |
Jin-Xia X U, Jian-Bin T, Lu-Hang Z, et al. Advances in the Study of Tumor pH-Responsive Polymeric Micelles for Cancer Drug Targeting Delivery[J]. Acta Pharmaceutica Sinica, 2009, 44(12): 1328-1335. |
| [48] |
Liu R, Li D, He B, et al. Anti-Tumor Drug Delivery of pHSensitive Poly (ethylene glycol)-Poly (L-histidine-)-Poly (Llactide) Nanoparticles[J]. Journal of Controlled Release, 2011, 152(1): 49-56. DOI:10.1016/j.jconrel.2011.02.031 |
| [49] |
Gu Y, Zhong Y, Meng F, et al. Acetal-Linked Paclitaxel Prodrug Micellar Nanoparticles as a Versatile and Potent Platform for Cancer Therapy[J]. Biomacromolecules, 2013, 14(8): 2772-2780. |
| [50] |
Zhao Z, Ding C, Wang Y, et al. pH-Responsive Polymeric Nanocarriers for Efficient Killing of Cariogenic Bacteria in Biofilms[J]. Biomaterials Science, 2019, 7(4): 1643-1651. DOI:10.1039/C8BM01640B |
| [51] |
胡晖, 范晓东. pH敏感性高分子材料[J]. 化学与生物工程, 2004, 21(5): 1-3. |
| [52] |
Hou G, Qian J, Xu W, et al. A Novel pH-Sensitive Targeting Polysaccharide-Gold Nanorod Conjugate for Combined Photothermal-Chemotherapy of Breast Cancer[J]. Carbohydrate Polymers, 2019, 212: 334-344. |
| [53] |
Beloqui A, Coco Régis, Memvanga P B, et al. pHSensitive Nanoparticles for Colonic Delivery of Curcumin in Inflammatory Bowel Disease[J]. International Journal of Pharmaceutics, 2014, 473(1-2): 203-212. DOI:10.1039/C8BM01640B |
| [54] |
孙平. 新型pH敏感性材料及其给药系统在现代药剂学中的应用进展[J]. 中国医药生物技术杂志, 2016, 11(1): 42-46. |
| [55] |
Li Q, Ye L, Zhang A, et al. The Preparation and Morphology Control of Heparin-Based pH Sensitive Polyion Complexes and Their Application as Drug Carriers[J]. Carbohydrate Polymers, 2019, 211: 370-379. |
| [56] |
Song C, Lin T, Zhang Q, et al. pH-Sensitive Morphological Transitions in Polymeric Tadpole Assemblies for Programmed Tumor Therapy[J]. Journal of Controlled Release, 2019, 293: 1-9. |
 2019, Vol. 33
2019, Vol. 33 
